靶向CysC基因shRNA慢病毒载体的构建对NSCLC A549细胞增殖的影响及机制初探*
郑大炜,郭娜
南阳市中心医院呼吸科(河南南阳 473009)
肺癌是全球发病率和病死率排名靠前的恶性肿瘤之一,我国更是肺癌患病大国,2014年全国肿瘤登记中心的数据显示我国肺癌发病率为35.23/10万,在全部恶性肿瘤发病中占19.59%;病死率为27.93/10万,在全部恶性肿瘤发病中占24.87%[1-2]。而非小细胞肺癌(non-small cell lung cance,NSCLC)在所有肺癌患者中高达85%,5年生存率低至15%[3]。究其原因发现,术后肿瘤复发和转移是影响NSCLC患者预后的重要原因[4]。研究显示,手术联合化疗在一定程度上可延长患者的生存时间,但也易对患者造成一定损伤影响其生活质量[5]。因此明确肺癌发病机制,寻找新的NSCLC治疗靶点和药物,为患者提供更好的诊疗手段,延长患者生命,提高生活质量,是目前甚至将来最主要的任务之一。半胱氨酸蛋白酶抑制剂C (Cystatin C,Cys C)是一种属于Cys Ⅱ家族的分泌型蛋白,又称CST3,可抑制包括半胱氨酸蛋白酶在内的多种蛋白水解酶活性,在炎性反应及肾癌、卵巢癌、结直肠癌等恶性肿瘤发生、发展中有一定影响[6-7]。但目前在NSCLC中的研究报道较少。2017年5月至2018年12月,本研究通过构建CysC-shRNA慢病毒载体,探讨CysC对NSCLC细胞增殖的影响及可能机制。
1 材料与方法
1.1 材料 NSCLC A549细胞、TOP10大肠杆菌感受态细胞和293T细胞购自中国科学生命院上海细胞研究所;RPMI-1640培养基、胎牛血清(FBS)、胰蛋白酶和青霉素-链霉素溶液均购自美国Gibco公司;T4连接酶、限制性内切酶Age Ⅰ和EcoR Ⅰ及连接试剂盒均购自美国NEB公司;慢病毒载体Pglv2-U6-Puro及包装质粒购自上海吉玛基因化学有限公司;质粒提取试剂盒、RNA提取试剂盒、逆转录试剂盒及转染试剂盒Lipofectamine购自美国Invitrongen公司;qRT-PCR试剂盒购自美国Thermo Fisher公司;MTT购自美国Sigma公司;细胞总蛋白提取和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒蛋白定量试剂盒购自北京天根生化科技有限公司;兔抗人β-actin、PI3K和Akt单克隆抗体购自美国Abcam公司;二抗购自北京中杉金桥公司。
1.2 方法
1.2.1 细胞培养和分组 将A549细胞和TOP10大肠杆菌感受态细胞接种于RPMI-1640培养基,置于37℃、5% CO2培养箱中,当细胞密度达到80%~90%时用胰酶进行消化传代。本研究共分为3组:CysC-shRNA组、Ctr-shRNA组和空白对照组,前者须将CysC-shRNA重组慢病毒转染A549细胞,中间须将Ctr-shRNA重组慢病毒转染A549细胞,后者无须任何处理。
1.2.2 构建CysC-shRNA重组慢病毒 根据GenBank中人CysC基因序列及shRNA设计原则合成CysC-shRNA序列:5′-GCTCCTGCTGGCCATCCTG-3′,同时设计并合成阴性对照序列Ctr-shRNA:5′-TGCGAACGACTTCTTCGCC-3′;将其与T4连接酶、限制性内切酶Age Ⅰ和EcoR Ⅰ双酶切后慢病毒载体连接,后将其转化TOP10大肠杆菌感受态细胞,并将其接种于含青霉素-链霉素溶液的LB平板上继续培养16 h,挑取菌落进行测序,挑选序列正确克隆构建CysC-shRNA重组慢病毒和CysC-shRNA重组慢病毒,并将其转染293T细胞进行包装、浓缩及滴度测定,以上步骤均在上海吉玛基因化学有限公司帮助下完成。
1.2.3 重组慢病毒感染A549细胞 将CysC-shRNA和Ctr-shRNA重组慢病毒分别感染处于对数生长期的A549细胞,继续培养72 h,后在荧光倒置显微镜下观察各组GFP表达情况。
1.2.4 用qRT-PCR检测各组CysC mRNA水平 收集转染后处于对数生长期的各组单细胞悬液进行检测,参考总RNA提取和逆转录试剂盒操作说明书进行总RNA提取和cDNA合成,后采用qRT-PCR法检测各组CysC mRNA水平,其中CysC上下游引物分别为:5′-GCTCTTTCCAGATCTACGCT-3′和5′-AGGCAGCCGATGCTACTATT-3′;反应体系(20 μL):cDNA产物1 μL、上下游引物各0.5 μL、SYBR Green Master mix液 10 μL和双蒸水8 μL;反应条件:95℃ 15 s、95℃ 5 s、60℃ 30 s,共循环45次,内参基因是GAPDH,以2-ΔΔCT描述CysC mRNA相对表达水平。
1.2.5 MTT实验 转染后,调整各组细胞密度至1×104个/mL,并将其接种于96孔板上,每孔添加100 μL,并设置3个复孔,继续培养,并分别于第1、3和5天向每孔中避光加入20 μL 5 mg/mL MTT液,混匀,继续培养4 h,弃孔中废液,并向每孔加入100 μL DMSO液,摇床振荡 3 min,放酶标仪上检测 490 nm处各孔OD值,以OD值表示细胞增殖能力。
1.2.6 细胞克隆形成实验 转染后,调整各组细胞密度至1×104个/mL,并将其接种于6孔板上,每组设置3个复孔,继续培养,每隔2~3 d换液1次,并于倒置显微镜下观察细胞生长状况,培养10~12 d后,用4%多聚甲醛固定细胞30 min,再用结晶紫染色15~25 min,待其自然干燥后观察细胞集落生长情况,并拍照。
1.2.7 Western blot实验 转染后,收集各组对数生长期细胞,参考总蛋白提取试剂盒提取总蛋白,用BCA蛋白试剂盒进行蛋白定量分析,后进行Western blot实验:(1)按需要配置不同浓度分离胶和浓缩胶;(2)向槽中填满2×电泳缓冲液,平稳拔出梳子,按每孔50μg计算上样量,将不同体积蛋白及蛋白Marker依次加入孔内;(3)设置电流为 120 mA,通电1 h进行电泳;(4)在Marker标示下按不同蛋白大小切胶,再按滤纸-胶-PVDF膜-滤纸结构依次摆放,将蛋白恒流转至 PVDF膜;(5)加封闭液使其封闭;(6)向每条膜加入稀释后的β-actin、PI3K和Akt单克隆抗体,4℃过夜;(7)TBST洗膜;(8)再向每条膜上加入稀释好的二抗,37℃1 h,TBST洗膜;(9)ECL显影。
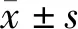
2 结果
2.1 荧光显微镜下观察转染效果 重组慢病毒感染A549细胞,72 h后于荧光显微镜下观察CysC-shRNA组和Ctr-shRNA组GFP表达情况(图1),发现CysC-shRNA组GFP表达水平明显低于Ctr-shRNA组,提示重组慢病毒构建成功。

注:A:Ctr-shRNA组;B:CysC-shRNA组
2.2 重组慢病毒沉默效果鉴定 用qRT-PCR检测各组CysC mRNA水平评估沉默效果,CysC-shRNA组、Ctr-shRNA组和空白对照组CysC mRNA水平比较差异有统计学意义(P<0.05),CysC-shRNA组CysC mRNA水平明显低于Ctr-shRNA组和空白对照组(t=31.508、P=0.000,t=29.113、P=0.000);提示沉默效果好。见表1。
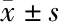
表1 各组CysC mRNA水平比较
2.3 各组细胞增殖能力比较 从第1天开始,CysC-shRNA组、Ctr-shRNA组和空白对照组3组OD值比较差异有统计学意义(P<0.05),以CysC-shRNA组细胞增殖能力最差,Ctr-shRNA组和空白对照组无明显差异。见表2。
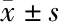
表2 各组OD值比较
2.4 各组细胞集落形成能力比较 空白对照组、Ctr-shRNA组和CysC-shRNA组细胞集落形成个数分别为(83±16)个、(80±14)个和(15±3)个,CysC-shRNA组集落形成数量明显低于Ctr-shRNA组和空白对照组(P<0.05),但Ctr-shRNA组和空白对照组比较则差异无统计学意义(P>0.05)。见图2。
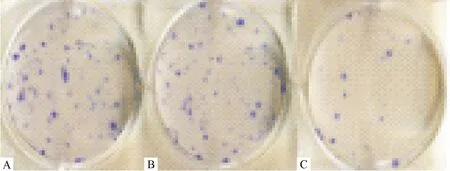
注:A:空白对照组;B:Ctr-shRNA组;C:CysC-shRNA组
2.5 各组PI3K和Akt蛋白含量比较 CysC-shRNA组PI3K和Akt蛋白明显低于Ctr-shRNA组和空白对照组,但后两组比较则差异无统计学意义(P>0.05)。见图3。

图3 各组PI3K和Akt蛋白含量比较
3 讨论
以手术治疗为主、放化疗为辅的综合治疗方式是目前NSCLC的治疗方案,但多数患者易复发,且转移率较高,导致病死率居高不下,因此探讨NSCLC的具体发病机制对患者预后十分重要[8]。近年,国内外学者对肿瘤微环境研究较多,且发现其与肿瘤发生、发展及预后密切相关,而微环境中蛋白酶异常则是其主要特征之一,主要包括金属蛋白酶、丝氨酸蛋白酶和半胱氨酸蛋白酶三类,以利于肿瘤细胞进入血液或淋巴循环,并到达特异部位继续生存[9-10]。研究表明,在乳腺癌、头颈癌及肺癌等多数恶性肿瘤中存在蛋白酶高水平表达,导致肿瘤预后不良[11-12]。CysC则是一种重要的蛋白酶抑制剂,这是因为该蛋白C端有2个二硫键,可抑制半胱酸蛋白酶B、H及L等,保护细胞免受异常蛋白酶水解,同时参与调控细胞内外其他蛋白酶表达[13-14]。研究显示,半胱氨酸蛋白酶是CysC的主要底物,而半胱氨酸蛋白酶活性紊乱是肿瘤转化的重要特征之一[15]。研究发现,CysC在恶性肿瘤细胞中过表达,抑制死亡细胞释放蛋白酶导致不适当降解,调控组织蛋白活性,从而促进细胞增殖、转移及侵袭等[16-17]。Zhang等[18]和Ohara等[19]学者发现结直肠癌和肺癌中均存在CysC高表达,但均未涉及其具体作用。
shRNA是目前成熟RNA干扰技术之一,已在生物学和医学生物学等领域得到广泛运用。本研究基于上述CysC在肺癌中的异常高表达,采用shRNA和慢病毒重组的方式敲低CysC,从而探讨其对NSCLC的影响。本研究中荧光显微镜下GFP表达情况及CysCmRNA水平均提示CysC-shRNA和Ctr-shRNA设计良好,沉默效率较高,保证了后续实验结果的真实性。后续研究结果均提示敲低CysC可明显抑制NSCLC细胞增殖及集落形成能力,与Yan等[20]研究一致,即沉默CysC可在一定程度抑制食管癌细胞EC9706增殖。那CysC是如何发生作用的呢?本研究通过Western blot实验发现敲低CysC后,NSCLC细胞PI3K和Akt蛋白水平明显下降,提示下调CysC抑制NSCLC细胞增殖,与PI3K和Akt蛋白有关,PI3K和Akt是PI3K/Akt信号转导通路的关键因子。PI3K/Akt信号转导通路是PI3K/Akt信号转导通路的关键因子,是大部分细胞生长因子的下游通路,在肺癌、卵巢癌等多种恶性肿瘤中表现活跃,帮助肿瘤细胞逃避免疫,促进增殖[21]。
综上认为,靶向下调CysC可明显抑制NSCLC细胞增殖,与PI3K/Akt信号通路相关。

