hnRNPs参与肿瘤发生机制的研究进展
刘玉娟 吴海芳 罗吉 综述 傅芬 审校
肿瘤严重影响人类的健康,发病率呈逐年上升的趋势,目前其发病机制仍不明确。核内不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNPs)是一大类RNA 结合蛋白超家族,具有功能的多样性和复杂性。hnRNPs调控基因表达的作用在疾病研究,尤其是在肿瘤的研究中,引发了广泛关注。大量研究表明,hnRNPs 与肿瘤的发生发展密切相关,其可通过选择性剪接参与肿瘤相关基因转录的调控,影响肿瘤能量代谢,维持端粒酶高活性,促进上皮间质转化以及促进血管形成等多种机制参与癌症的发生发展。本文对hnRNPs 家族与肿瘤的关系以及其参与肿瘤的相关机制做一综述。
1 hnRNPs家族及其生理功能
在真核细胞中,DNA逆转录生成的RNA,由于其在核内随机分布以及长短不一的特性,被称作核内不均-RNA(heterogeneous nuclear RNA,hnRNA)。在核内不均-RNA加工成为成熟mRNA的过程中,需要多种蛋白的参与,根据结合RNA种类的不同,这些蛋白被分为3类:核小核糖核蛋白、mRNA蛋白以及hnRNPs。
核内不均一核糖核蛋白是一大类RNA结合蛋白超家族,它们的分子大小和等电点各不相同,分子量大小从34到120 kDa不等,依据分子量大小将其细分为hnRNPA1-U。hnRNPs 家族成员在结构上具有类似性,大多包含2 个RNA 结合区域和一个核定位区域。hnRNPs 作为RNA 结合蛋白可以通过RNA 结合区域与信使RNA 的非编码区结合,参与mRNA 的转录、加工、成熟,并在细胞转运过程中稳定mRNA,同时参与调控翻译等过程[1]。研究表明,hnRNPs 还参与DNA的复制、重组、修复、剪接位点的选择,以及细胞的增殖与凋亡等生物学过程[2](表1)。
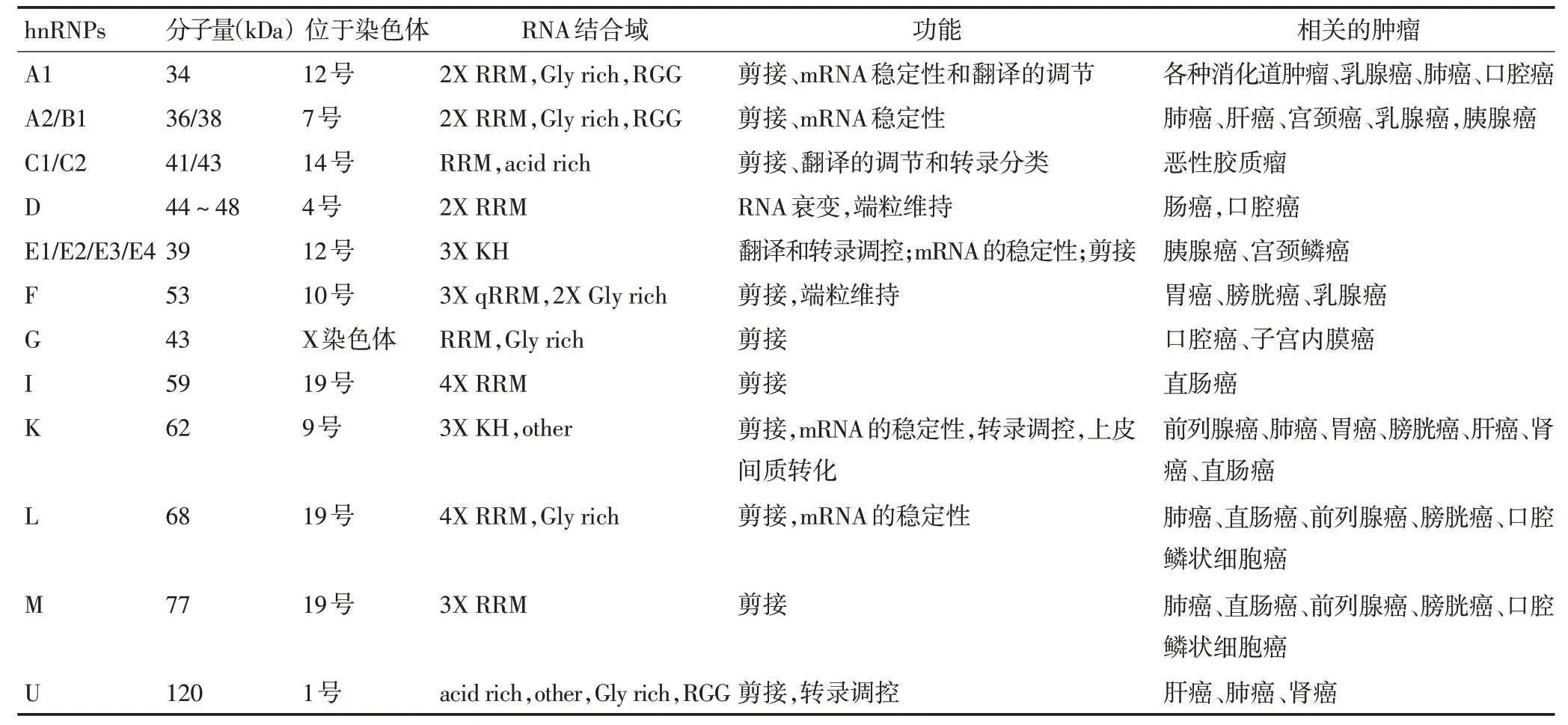
表1 hnRNPs的功能及与肿瘤的关系
2 hnRNPs在肿瘤中的表达
现有研究表明,hnRNPs 与多种癌症的发生发展密切相关。hnRNPs 在肺癌、宫颈癌、乳腺癌,以及各种消化道肿瘤等中显示高表达水平[3-8],且hnRNP A2/B1 已被作为肺癌的早期诊断标志物之一[7],hnRNP A1可作为肠癌进展的标志物[8]。hnRNPs的高表达可以促进肿瘤细胞的增殖、侵袭、转移,并且会影响患者的预后[4-9]。此外,hnRNPs还可能通过损伤修复机制参与肿瘤的耐药[10]。因此,hnRNPs 在多种癌症中的异常表达,可作为肿瘤早期诊断的标志物以及评估预后及耐药的指标,具有广泛的应用前景。
3 hnRNPs参与肿瘤发生发展的可能机制
肿瘤的发生是一个复杂的过程,是多种因素共同作用的结果。hnRNPs可通过多个途径影响mRNA的选择性剪接,从而促进肿瘤的发生发展。其可能的机制如下。
3.1 hnRNPs 调节细胞癌基因和抑癌基因或凋亡基因的表达
肿瘤的发生可以被认为是一种促进癌基因和抑制抑癌基因或凋亡基因异常表达的结果。因此,调节基因的表达对肿瘤发生发展至关重要。hnRNPs通过选择性剪接,可对细胞癌基因、抑癌基因或凋亡基因表达进行调控。在对前列腺癌的研究中,hnRNP L直接调控一系列RNA 的选择性剪接,包括编码前列腺癌的关键致癌受体的RNA,并可通过反向剪接调控环状RNA的形成,在前列腺癌[11]。
hnRNPs蛋白具有调节凋亡基因的表达,包括转录的起始和延长、可变剪接、mRNA的稳定性、翻译以及蛋白的降解等功能。研究表明,hnRNPs蛋白在癌症中的异常表达,导致靶细胞凋亡基因功能受损,包括外源性(Fas,caspase-8,caspase-2,c-FLIP)和内源性调节因子(Apaf-1、caspase-9、ICAD)、编码Bcl-2蛋白的基因、IAP和p53抑癌基因[12]。Zhao等[13]的研究表明,hnRNP A2/B1在人胶质母细胞瘤细胞株(U251细胞)中高表达,IE86基因通过促进hnRNP A2/B1介导的信号通路,促进U251细胞增殖,抑制细胞凋亡,这可能与hnRNP A2/B1介导的Bcl-x的选择性剪接有关。
抑癌基因p53是维持基因组完整性和细胞存活的主要调控基因之一。p53的异常低表达与细胞转化和肿瘤发生有关,而其高表达则诱导细胞死亡和抑制细胞生长。Seo等[14]发现在细胞DNA遭受依托泊苷药物所致的损伤时,早期hnRNP L从细胞核转运到细胞质,hnRNP L表达增加,并与p53 mRNA的5'UTR结合,促进p53 mRNA的翻译,从而诱导细胞凋亡;相反,在hnRNP L基因敲除后p53蛋白水平下降,使细胞停滞在G2/M期,阻止凋亡。提示hnRNP L能够作为p53翻译的正性调节因子,促进细胞周期阻滞和凋亡。
3.2 hnRNPs影响细胞能量代谢
细胞能量代谢失调被认为是癌症一大特点。正常细胞和癌症细胞的一个特征性改变是能量代谢调节的变化,即从氧化磷酸化向糖酵解转变。代谢的转变是通过糖酵解过程中的关键酶,即丙酮酸激酶(pyruvate kinase,muscle,PKM)的剪接亚型的转换实现的。正常细胞表达丙酮酸激酶M1异构体(PKM1),肿瘤细胞则主要表达M2异构体(PKM2)。从PKM1向PKM2转变,有利于促进有氧糖酵解,将糖酵解代谢物结合到合成的大分子上以促进细胞生长[15]。PKM1/M2亚型是通过两个互斥外显子的选择性剪接而产生的。研究表明[16],该选择性剪接事件由异质核蛋白hnRNP家族成员hnRNP A1、hnRNP A2和聚嘧啶束结合蛋白控制。hnRNP蛋白通过选择性剪接调节能量代谢,从而调节细胞增殖,促进肿瘤的发生。
3.3 hnRNPs维持“端粒酶”活性
近年有关端粒酶与肿瘤关系的研究进展表明,端粒酶参与了对肿瘤细胞的凋亡和基因组稳定的调控。与端粒酶的多重生物学活性相对应,肿瘤细胞中也存在复杂的端粒酶调控网络。通过蛋白质-蛋白质相互作用在翻译后水平对端粒酶活性及功能进行调控是目前研究端粒酶调控机制的热点之一。正常的细胞表现为端粒酶低活性,而人类肿瘤中广泛地存在着较高的端粒酶活性,其能够延长人类肿瘤细胞中的端粒,这种活性导致细胞永生化,从而增加人类肿瘤细胞的侵袭性[17-18]。端粒酶阳性的肿瘤有卵巢癌、淋巴瘤、急性白血病、乳腺癌、结肠癌、肺癌等[19]。
对恶性肿瘤细胞的端粒结构的研究发现,几种hnRNPs能够与端粒相结合,导致端粒酶活性的增强,可使细胞发生恶性转化[20]。研究最多的是hnRNP A1,它能够与端粒DNA结合,增加端粒酶的活性;hnRNP A1含量的降低导致端粒酶活性的降低,hnRNP A1可通过解绕G-四聚体或G-G发夹结构来刺激端粒伸长[21]。研究表明[22-23],hnRNP A1和A2具有促进细胞增殖的作用,在恶性肿瘤细胞中同时抑制hnRNP A1和A2,可以抑制肿瘤细胞增殖,并诱导凋亡。hnRNP A1和A2只有在具有端粒酶活性的细胞中才能维持端粒的功能,且只有同时抑制hnRNP A1和A2才能导致癌细胞端粒功能失调和DNA损伤反应。大多恶性肿瘤细胞具有高表达的端粒活性,但在正常细胞中不表达或低表达,而hnRNPs能够与端粒相结合,增强端粒酶活性,使细胞发生恶性转化。因此可通过打破hnRNPs与端粒的结合,来抑制端粒酶活性和功能,从而抑制细胞增殖,可能成为一种治疗癌症的新方法。
3.4 hnRNPs参与上皮-间质转化
上皮-间质转化(epithelial-to-mesenchymal tran⁃sition,EMT)是指在某些特殊的生理或病理条件下,上皮细胞失去极性,转变为具有活动能力、能在细胞基质自由移动的间质细胞的过程。这一过程使细胞获得了较高的迁移、侵袭、抗凋亡和降解细胞外基质的能力,与肿瘤的侵袭转移密切相关。hnRNPs 可通过选择性剪接参与上皮-间质转化[24]。Bonomi 等[25]的研究显示,高水平的hnRNP A1 通过与ΔRon(一种有利于EMT 的构成活性的亚型)的沉默子结合抑制ΔRon的产生,此外其抑制上皮间质转化,还有激活间质-上皮转化程序逆转EMT 的特性。而另一些研究表明,hnRNPs 能够促进EMT,促进癌症的发生发展。Dai 等[26]的研究表明,hnRNP A2/B1 通过下调E-cad⁃herin 和上调N-cadherin 和波形蛋白,刺激人胰腺癌的侵袭能力,促进EMT。在EMT 过程中,CD44 表达从变异亚型向标准亚型的转变,是对细胞进行上皮间质转化必不可少的[27]。在乳腺癌中,hnRNP 激活选择性剪接的开关,从而精确控制CD44 剪接异构体,导致EMT[28]。因此,有理由认为,调节hnRNPs的表达,防止EMT的发生,有望成为一种潜在的新的抗肿瘤治疗方法。
3.5 hnRNPs促进血管生成
在肿瘤生长和转移中,血管生成起了重要的作用。VEGF-A 是生理和病理血管生成的重要调节因子。而hnRNP L是VEGFA表达的关键转录后调节因子,它可以同时诱导多个缺氧RNA开关,并且除了调节VEGF 外,还可以调节一些致癌基因的表达,促进癌症进展[29]。在常氧条件下,大部分hnRNP L定位在细胞核中,而细胞质中少量的hnRNP L 与miR-574-3p 结合,阻止与靶VEGFA mRNA 结合,抑制VEGFA mRNA 的翻译;而在缺氧条件下,hnRNP L 从细胞核中释放,在细胞质内hnRNP L 上的Tyr359 位点磷酸化并在细胞质积聚,与miR-574-3p 分离,分离后的hnRNP L 与VEGFA mRNA 3'UTR 区定位的富CA 成分相结合,刺激VEGFA mRNA的翻译,促进肿瘤的发生[30]。除hnRNP L外,hnRNP其他家族成员也参与了VEGF的调节,与肿瘤的形成密切相关[31-33]。
4 小结
综上所述,肿瘤的发生发展是一个复杂的过程,是多因素共同参与的结果,其具体的发病机制较复杂。很多肿瘤早期缺乏特异性肿瘤标记物,且对化疗药物耐药,是目前肿瘤早期发现及治疗的一个难点。hnRNPs作为RNA结合蛋白,在生理状态下参与核酸代谢的多个方面;在病理状态下,hnRNPs可通过多种机制参与癌症的发生发展。大量研究已经证实,hnRNPs在多种癌症中异常表达,可作为肿瘤早期诊断的标志物,以及评估预后及耐药的指标,具有广泛的应用前景,且有望成为肿瘤治疗的靶点。

