晚期非小细胞肺癌EGFR突变与18F-FDG PET/CT代谢参数的相关性及其对预后评估的影响
廖恺 程刚 黄颖
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的组织学类型,约占所有肺癌的85%[1]。随着个体化精准治疗的发展,NSCLC的治疗除常规的手术、放化疗之外,针对肿瘤恶性表型分子的靶向治疗也逐渐被应用于临床。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)能够阻断EGFR的信号传导,进而影响肿瘤细胞增殖分化,对EGFR突变阳性的NSCLC患者有着良好的治疗效果[2-3]。使用EGFR-TKIs前需要明确肿瘤组织EGFR基因的突变状态,检测方法主要是DNA测序,标本可以是肿瘤组织、胸水肿瘤细胞、外周循环肿瘤细胞等。但这种方法具有一定的局限性,如部分标本采集困难、存在采样误差、因各种原因导致的样本无法使用、检测时间偏长等,这也限制了EGFRTKIs在临床的应用。
有研究表明,EGFR 基因可以通过NOX4/ROS/GLUT1轴影响肿瘤的糖代谢[4],18F-FDG PET/CT可以通过检测肿瘤细胞18F-FDG 的摄取了解肿瘤的糖代谢情况,因此是否可以将18F-FDG PET/CT 作为一种评估EGFR基因状态的无创、快速的手段成为临床关注的重点。此外,18F-FDG PET/CT 在NSCLC 的预后评估中发挥着重要作用[5],EGFR 基因突变状态是否对18F-FDG PET/CT用于NSCLC预后评估造成影响有待研究。本研究对就诊于重庆医科大学附属第一医院的晚期NSCLC 患者资料进行回顾性分析,旨在了解患者EGFR 突变状态与18F-FDG PET/CT 代谢参数的相关性及其对预后评估的影响。
1 材料与方法
1.1 一般资料
回顾性分析2017年1月到2018年12月于重庆医科大学附属第一医院行18F-FDG PET/CT 检查的晚期(临床Ⅲ~Ⅳ期)NSCLC 患者。纳入标准:1)行病理组织EGFR 基因检测;2)需在初次接受治疗前28天以内行18F-FDG PET/CT 检查;3)临床信息完整;4)临床分期Ⅲ~Ⅳ期。排除标准:1)合并其他恶性肿瘤;2)接受抗肿瘤治疗后再进行PET/CT或基因检测;3)糖尿病患者;4)原发病灶直径<1 cm(排除部分容积效应的影响)。收集的信息包括:年龄、性别、吸烟史、原发病灶最长径、TNM 分期、血清癌胚抗原(car⁃cinoembryonic antigen,CEA)值、18F-FDG PET/CT 相关代谢参数。本研究将“吸烟者”定义为每日吸烟1 支以上或每周吸烟超过4 次,连续3 个月及以上,或者行18F-FDG PET/CT 前吸烟数量累计≥100 支[6],其余则被定义为“未吸烟者”。TNM分期按照国际肺癌肿瘤协会(IASLC)第8版TNM肺癌分期标准判定,对于未获得病理检测结果的淋巴结转移病灶和远处转移病灶,以影像学表现结合患者的临床资料为评定标准。
1.2 方法
1.2.118F-FDG PET/CT图像获取 采用Philips Gem⁃ini TF 64 PET/CT检测系统;18F-FDG由重庆医科大学附属第一医院核医学科医用回旋加速器生产,放化纯度>95%。检查前患者空腹6 h以上,空腹血糖≤6.1 mmol/L。静脉注射18F-FDG 显像剂,剂量3.70~5.55 MBq/kg体质量,安静休息1 h后行PET/CT显像,扫描范围为颅顶至大腿根部。CT扫描参数:电压120 kV,电流100 mA,层厚4.0 mm;PET扫描参数:4D采集,层厚4.0 mm,头颈部扫描5 min/床位,头颈部以下部位3 min/床位。CT数据采用衰减校正,迭代法重建图像,获得冠状位、矢状位、轴位图像传至EBW工作站。
1.2.2 图像分析 由1 名专业的核医学医师对图像进行判读,对于原发病灶,以最大标准摄取值(maxi⁃mum standardized uptake value,SUVmax)=2.5为阈值,在PET/CT 融合图像上自动勾画感兴趣区,再对各层按原发病灶肿瘤轮廓逐层进行手动修改。由机器自动测量感兴趣区的SUVmax、平均标准摄取值(mean standardized uptake value,SUVmean)、肿瘤代谢体积(metabolic tumor volume,MTV)。在肝脏右叶连续三个层面以直径6 cm 勾画感兴趣区(避开肝门区和囊肿),得到3个肝脏SUVmean,取平均值即为SUV肝血池。在主动脉弓连续三个层面以直径3 cm勾画感兴趣区,得到3 个纵隔血池的SUVmean,取平均值即为SUV 纵隔血池。用原发病灶SUVmax 分别除以SUV肝及纵隔血池,即可得到SUVtumor/liver、SUVtumor/mediastinum[7]。糖酵解总量(total lesion glycolysis,TLG)通过公式TLG=MTV×SUVmean计算。
1.2.3 病例随访 随访方式为医院信息管理系统联合电话随访。观察事件为无进展生存期(progression free survival,PFS),定义为患者从进行PET/CT扫描的第1 天到疾病进展、死亡或随访终止的时间,本研究的末次随访时间为2020年4月30日。疾病进展标准:随访明确提示观察的肿瘤病灶增大>20%或者出现新的病灶。
1.3 统计学分析
采用SPSS 25.0、Medcalc 19.0.7、Graphpad Prism 8.3.0软件进行统计学分析。分类变量用χ2检验,数值变量用t检验或非参数检验,相关性分析采用二元Logistic回归,分析EGFR突变的独立预测因子。对于无进展生存状态的生存分析,采用绘制ROC生存曲线分析代谢参数的最佳截断值,运用Kaplan-Meier曲线及Cox回归评估代谢参数对生存状态的预测价值。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者的一般临床资料
符合纳入标准的患者共109 例(男性61 例,女性48例),其中48例(44.0%)患者EGFR突变阳性,61例(56.0%)患者EGFR 基因突变状态为野生型。EGFR突变更容易发生在女性患者(72.9% vs. 21.3%,P<0.001)。109 例患者初次诊断为肺癌的平均年龄是(61.57±11.13)岁,且突变型组及野生型组之间年龄的差异无统计学意义。57 例患者有吸烟史,不吸烟的患者比吸烟的患者更容易发生EGFR 突变(67.3%vs.22.8%,P<0.001)。本研究发现腺癌患者更容易发生EGFR 突变(52.4% vs. 18.5%,P=0.002)。此外,比较两组肿瘤的TNM 分期、临床分期、血清CEA 值、肿瘤最长径等临床信息,除N分期(P=0.016)外,其余指标组间差异均无统计学意义。患者EGFR 基因突变状态与一般临床资料的具体情况见表1。
2.2 18F-FDG PET/CT 代谢参数与EGFR 基因突变状态的相关性
对比EGFR突变型组及野生型组的PET/CT代谢参数(表2),发现EGFR突变型组SUVmax(8.71 vs.10.75,P=0.003)、SUVtumor/liver(4.52 vs. 6.45,P=0.003)、SU⁃Vtumor/mediastinum(4.39 vs.5.90,P=0.019)、TLG(80.35 vs.258.06,P=0.001)、MTV(16.00 vs.46.66,P=0.001)均较EGFR野生型组低,且组间差异具有统计学意义,而SUVmean组间差异无统计学意义[(4.67±2.39)vs.(5.05±1.47),P=0.302]。
2.3 EGFR基因突变的影响因素
在PET/CT 相关代谢参数关于EGFR突变的诊断效能的ROC 曲线分析中,SUVmax、SUVmean、SUVtu⁃mor/liver、SUVtumor/mediastinum、MTV 和TLG 的最佳截断值分别为9.58、5.08、5.13、10.14、37.76和283.08,对应的曲线下面积(AUC)分别为0.664、0.664、0.631、0.686、0.684。再分别以最佳截断值对代谢参数分组。单因素分析结果显示性别、吸烟史、CEA 值、病理组织类型、低SUVmax(≤9.58)、低SUVmean(≤5.08)、低SUVtumor/liver(≤5.13)、低SUVtumor/medias⁃tinum(≤10.14)、低MTV(≤37.76)、低TLG(≤283.08)与EGFR 突变相关。多因素分析结果显示,女性(OR=12.154,P<0.001)、腺癌(OR=4.822,P=0.019)、低SU⁃Vmax(≤9.58,OR=4.347,P=0.005)是预测EGFR 突变的独立影响因子(表3)。此外还探究了联合3个独立影响因子预测EGFR 突变状态的ROC曲线(图1),结果显示AUC为0.840。
2.4 18F-FDG PET/CT各代谢参数预测晚期NSCLC患者PFS的价值
本次患者的平均随访时间为(11.39±8.27)个月,最长随访时间为35个月,截至最后一次随访,发生进展的患者有92例。预测PFS状态的ROC曲线显示SUVmax(AUC=0.649,P=0.059 5),SUVmean(AUC=0.596,P=0.222 5),SUVtumor/liver(AUC=0.643,P=0.064 1),SUVtumor/mediastinum(AUC=0.637,P=0.100 7),MTV(AUC=0.749,P=0.000 2),TLG(AUC=0.747,P=0.000 3)的预测PFS状态的最佳截断值分别为5.80、4.55、3.84、5.73、14.85、75.13。以最佳截断值分组发现所有参数的组间Kaplan-Meier生存曲线差异具有统计学意义(表4)。
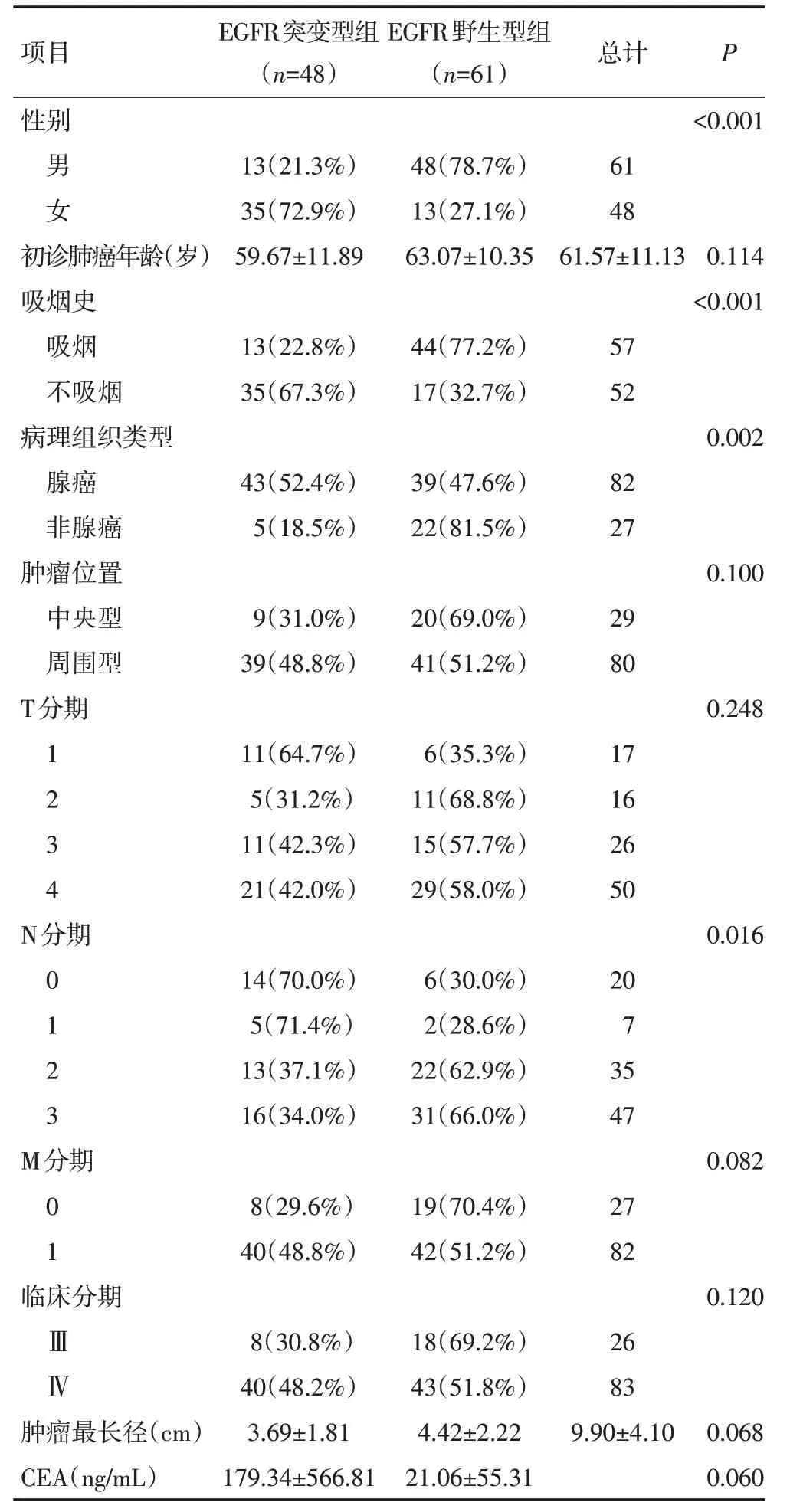
表1 患者临床特征与EGFR基因突变的关系

表2 PET/CT代谢参数与EGFR基因突变的关系
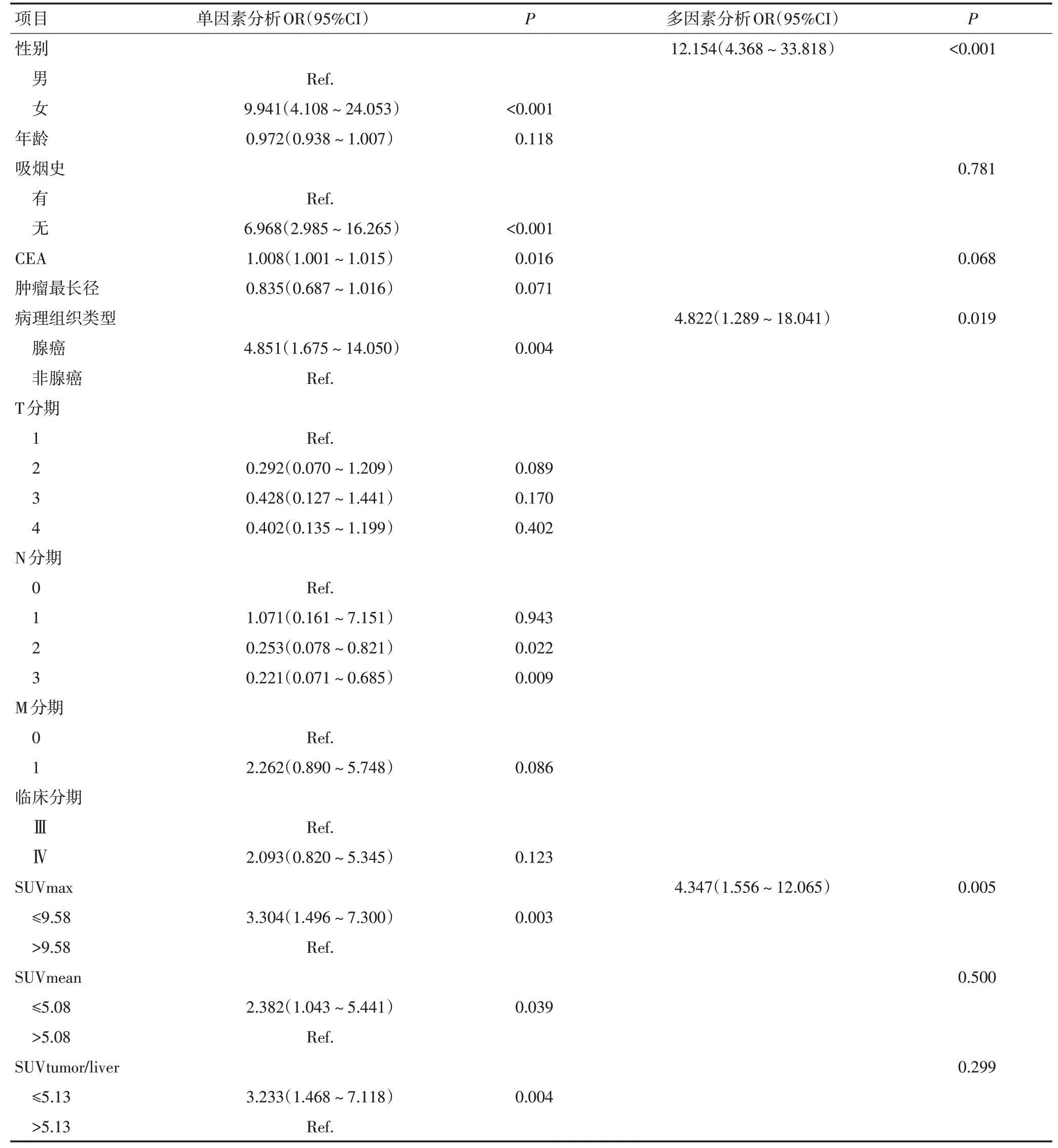
表3 单、多因素Logistic分析参数与EGFR基因突变的关系
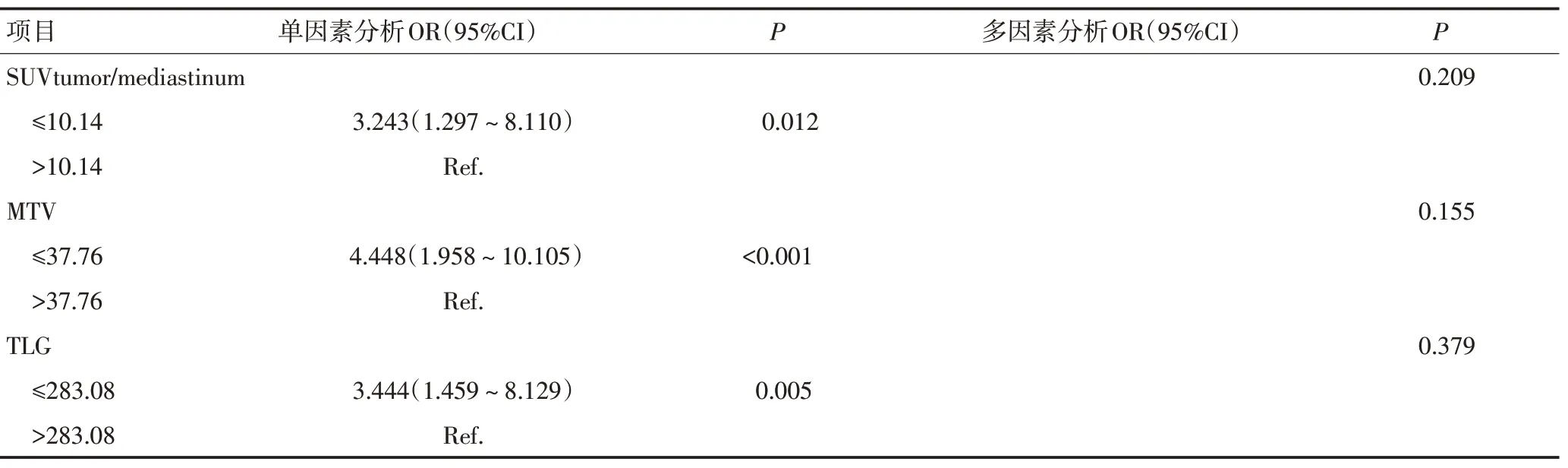
表3 单、多因素Logistic分析参数与EGFR基因突变的关系 (续表3)
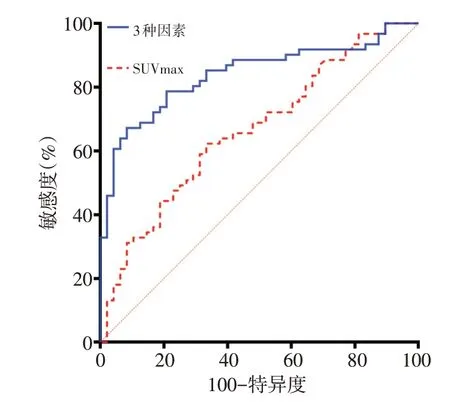
图1 联合3种因素(性别、病理组织类型、SUV值)的ROC曲线(AUC=0.840,P<0.000 1)及SUVmax的ROC曲线(AUC=0.664,P=0.003 4)
2.5 EGFR基因突变状态对PET/CT代谢参数评估预后的影响
对突变型组及野生型组患者分别行ROC生存状态分析,得到两组各个参数预测PFS状态的最佳截断值(表5)。Cox 单因素回归分析显示,在EGFR 突变组中,所有纳入研究的代谢参数均具有预测PFS的价值,其中体积参数MTV拥有最大的风险比。在EGFR野生型组中,仅有MTV、TLG 能够预测PFS 的价值。分别将各组有统计学意义的参数进行多因素Cox 回归,发现两组均仅MTV 具有预测PFS 的价值。纳入Cox 回归方程结果显示,在EGFR 突变型组中,MTV>14.85 患者的疾病进展风险更高,风险比为2.724(95%CI:1.371~5.415,P=0.004,图2)。在EGFR 野生型组中,MTV>12.48 患者的疾病进展风险更高,风险比为3.195(95%CI:1.536~6.646,P=0.002,图2)。
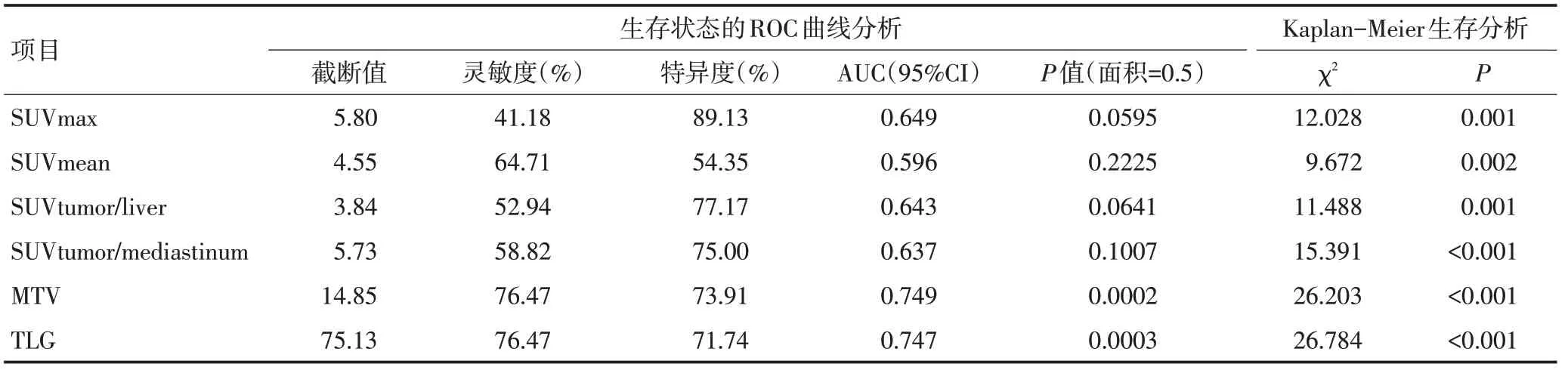
表4 18F-FDG PET/CT代谢参数预测晚期NSCLC患者的PFS状态及Kaplan-Meier生存分析
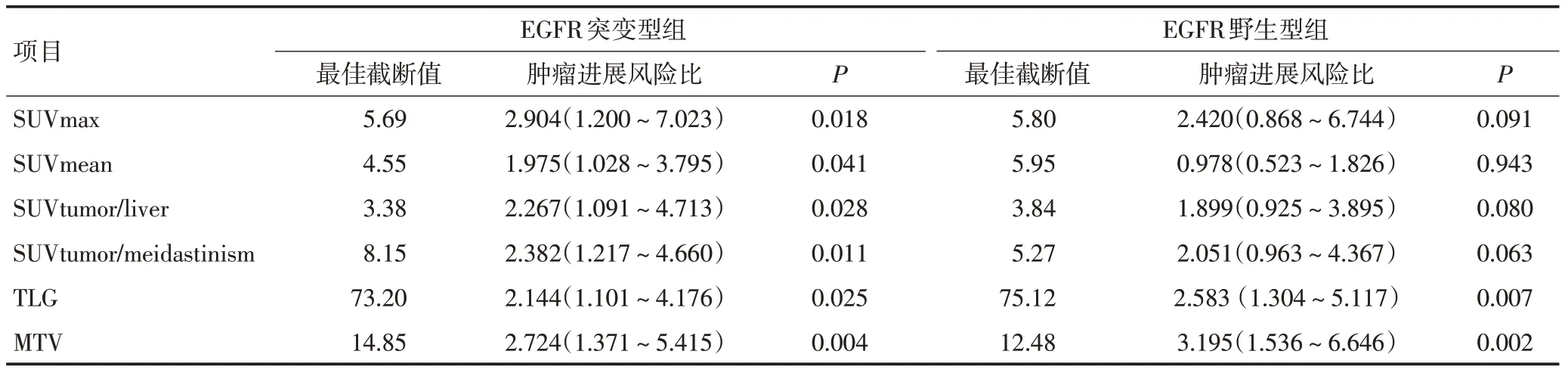
表5 根据EGFR不同突变状态分组PET/CT代谢参数的预后评估价值
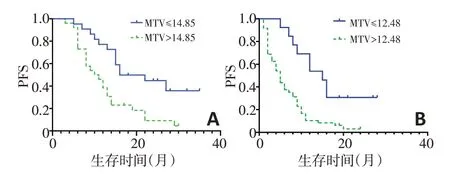
图2 EGFR突变型组及野生型组生存曲线图
3 讨论
18F-FDG PET/CT 作为一种全身检查手段,不仅可以了解NSCLC病灶的位置、大小等形态学特征,而且还与肿瘤细胞的许多分子生物学特征相关,包括病理组织类型、葡萄糖转运蛋白1(glucose transporter type1,GLUT1)的表达、乏氧状态等[8]。EGFR 基因及其表达的产物可以通过影响多条信号传导通路,如RAS/RAF/MAPK通路、PI3K/AKT通路等,影响肿瘤的生物学特征[9]。NOX4基因编码的蛋白质可充当氧传导器,催化分子氧转化为活性氧(reactive oxygen spe⁃cies,ROS),ROS 可参与GLUT1 的表达,有研究发现EGFR 突变的NSCLC 细胞株中NOX4基因、GLUT1表达水平降低,ROS 活性降低,提出了EFGR 基因可能会通过NOX4/ROS/GLUT1轴影响FDG的摄取[4,10-11]。
本研究探讨了EGFR 突变状态与18F-FDG PET/CT 相关代谢参数(SUVmax、SUVmean、SUVtumor/liv⁃er、SUVtumor/mediastinum、TLG、MTV)及部分临床资料的相关性。发现EGFR 突变型组的所有参数均低于EGFR野生型组。此外,本研究还联合了患者的部分临床资料,多因素Logistic 分析发现女性、腺癌、低SUVmax(≤9.58)可以作为预测晚期NSCLC 患者EG⁃FR 突变的独立影响因子。联合这3 种因素的EGFR突变状态ROC曲线AUC为0.840。
既往研究中,SUVmax 与EGFR 突变状态的关系存在一定的争议。Lv 等[12]研究发现,低SUVmax(<7.0)的NSCLC 患者更容易发生EGFR 基因突变,Gao等[13]进行多因素Logistic 分析发现,低SUVmax(≤11.5)是EGFR 基因突变的独立预测因子之一。但也有部分研究发现SUVmax与EGFR突变状态没有明显的相关性[14-15],造成这种差异多是由于实验方案的设计不同,例如选取的样本多为单中心研究,不同人种驱动基因突变谱之间有一定差异,研究的纳入、排除标准不一致等,同时SUVmax 还会受到采集时间、图像的采集方式及重建模式的影响。本研究发现EG⁃FR 突变与更低的FDG 摄取相关,并且结合临床资料可以更好的评估晚期NSCLC患者的EGFR突变状态,这将有助于患者EGFR-TKIs靶向治疗的选择。
多项研究表明18F-FDG PET/CT代谢参数在NSCLC的预后评估中具有一定价值[16]。单独的SUVmax仅表现了肿瘤病灶的最高代谢摄取,难以反映肿瘤空间特征与生物学行为,相较而言,体积代谢参数MTV、TLG将肿瘤的体积与代谢两方面信息结合,可以反映病灶的肿瘤负荷,具有更好的预后评估价值[17-19]。本研究探讨了18F-FDG PET/CT代谢参数对晚期NSCLC患者PFS的预测价值,ROC生存曲线分析发现,MTV、TLG的诊断效能优于SUV。为了解代谢参数对预后的评估价值是否会受到EGFR突变状态的影响,本研究分别分析了EGFR突变型组及野生型组代谢参数的预后评估效能,多因素Cox回归分析发现两组均只有MTV为预测预后状态的独立因子,但两组MTV的最佳截断值与高MTV的风险比均不同。
本研究存在一定的局限性,第一,本研究为单中心回顾性研究,选择均为住院患者,可能存在一定的选择偏倚;第二,尽管纳入患者的治疗方式多按照标准的临床指南,并且由于临床分期相近,疾病的管理方案相差不大,但治疗方式的异质性仍会对治疗结果造成影响;第三,由于晚期NSCLC患者大多未进行手术及淋巴结清扫,临床信息收集到的TNM 分期并非病理确诊的TNM 分期,多是通过影像学方法进行的TNM 分期,存在隐匿性淋巴结的可能性;第四,因为在随访期内死亡的人数不多并且随访时间偏短,所以仅分析了患者PFS,未进行总生存期的分析;第五,由于本研究样本中ALK 及ROS 基因融合突变的病例数很少,故未分析ALK 及ROS 基因融合突变的影响。
综上所述,本研究发现EGFR突变可能与更低的FDG 摄取相关。女性患者、病理组织类型为腺癌、SUVmax≤9.58 是EGFR 突变的独立预测因子。18FFDG PET/CT 体积代谢参数在预测晚期NSCLC 患者的PFS上具有良好的预测效能。但是,由于EGFR状态可能会影响肿瘤细胞的代谢,因此在使用体积代谢参数评估晚期NSCLC 患者预后时,可以考虑使用不同的评估标准。未来仍需进一步进行多中心、前瞻性的研究来探讨EGFR 突变与18F-FDG PET/CT 代谢参数的关系,并制定合适的预后评估标准。

