雷公藤甲素对2型糖尿病小鼠耳蜗毛细胞的保护作用
扶玉珍 姚方辉
(1 湖北医药学院组织学与胚胎学教研室,2 十堰市太和医院(湖北医药学院附属太和医院)普外科,十堰 442000)
糖尿病性耳聋是一种以高频听力下降为主的感音神经性耳聋,长期高血糖及糖基化终末产物(advanced glycation end-products,AGEs)的不断聚积导致的氧化应激可激活多种凋亡信号通路造成耳蜗毛细胞的不可逆性损害[1]。雷公藤甲素具有抗炎、免疫调节、抗肿瘤等多种药理作用[2-4]。雷公藤甲素对糖尿病大鼠视网膜神经节细胞具有保护作用[5],但是雷公藤甲素对糖尿病耳蜗毛细胞的影响研究较少。本研究建立了2型糖尿病小鼠模型,观察雷公藤甲素对2型糖尿病小鼠耳蜗毛细胞的保护作用并探讨了其作用机制,旨在为糖尿病耳蜗病变的治疗提供新的理论依据。
1 材料和方法
1.1 实验试剂
雷公藤甲素(购于成都普思生物科技有限公司);链脲佐菌素(美国Sigma 公司);小鼠胰岛素(INS)酶联免疫检测试剂盒(上海朗顿有限公司);琥珀酸钠(武汉博士德生物工程有限公司);氯化硝基四氮唑蓝NBT(美国Amresco 公司);磷酸化细胞外信号调节蛋白激酶(phosphoextracellular signal-regulated kinase,p-ERK)、细胞外调节p-ERK 的总蛋白(ERK)、E2 核因子相关因子2(nuclear factor-erythroid 2-related factor-2,Nrf2)、硫氧还蛋白(thioredoxin,Trx)及p-JNK、cleaved-caspase-3 抗体(美国Santa Cruz 公司);
1.2 2型糖尿病小鼠模型建立及给药方法
SPF级Balb/c雄性小鼠,4~5周,体质量22~25 g,(湖北医药学院实验动物研究中心)。随机分为正常组(Control)、糖尿病组(T2DM)和雷公藤甲素组(T2DM+TPL),每组10只。3组均适应性喂养1 周。1 周后对照组喂以基础饲料,2型糖尿病模型组喂以高脂高糖饲料(48.50%基础饲料,20.00%蔗糖,20.00%蛋黄粉,10.00%熟猪油,1.00%胆固醇,0.50%脱氧胆酸钠)[6]。各组喂养相应饲料4 周后均禁食不禁水12 h,2型糖尿病模型组1%链脲佐菌素(STZ)40 mg/kg 腹腔注射1次,1 周后相同条件下2型糖尿病模型组第2次腹腔注射STZ 40 mg/kg。对照组相对应腹腔注射等体积的柠檬酸-柠檬酸钠缓冲液。于第2次STZ 注射后每隔5 d 小鼠尾静脉取血测空腹血糖值(FBG),监测血糖及体质量。并采用生物素双抗体夹心酶联免疫吸附法(ELISA)测定小鼠胰岛素(FINS)水平,按小鼠胰岛素酶联免疫检测试剂盒说明操作。计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=(FBG×FINS)/22.5。以小鼠尾静脉空腹血糖值大于11.1 mmol/L 及出现胰岛素抵抗为建模成功[7]。2型糖尿病动物模型建立成功后1 周,雷公藤甲素组小鼠给予雷公藤甲素 0.1 mg/kg 灌胃,连续治疗6周,正常组和糖尿病组小鼠每天给予等体积生理盐水灌胃1次。
1.2 耳蜗基底膜琥珀酸脱氨酶(SDH)染色及耳蜗毛细胞计数
4%的水合氯醛腹腔注射麻醉小鼠后4~5 min,在解剖显微镜下用解剖镊迅速开颅,打开听泡取出耳蜗,用细针尖挑破圆窗膜及摘除镫骨,开放前庭窗和圆窗。从蜗顶钻一小孔,将NBT 工作液(0.05 mol/L 琥珀酸钠溶液,0.05 mol/L 磷酸缓冲液,0.1%NBT 按1:1:2 配制)从圆窗内缓慢灌入耳蜗内,可见工作液从蜗顶的小孔内流出,即为耳蜗蜗管内灌注成功,继之将耳蜗置于该NBT工作液中37℃孵育1 h;将耳蜗置于10%福尔马林内室温固定2 d,再将耳蜗放于7% EDTA 二钠脱钙液中(pH6.9),室温下直到耳蜗软化。体视显微镜下分离耳蜗基底膜,平铺基底膜于滴有甘油的载玻片上,覆盖盖玻片封片。最后,将基底膜铺片置于光学显微镜下(放大200倍)以相等的距离200 µm 从耳蜗顶回至底回取25个点进行活外(OHC)、活内(IHC)毛细胞计数(n=3),统计分析。
1.3 小鼠耳蜗中氧化应激相关信号通路、抗氧化蛋白分子及凋亡分子的蛋白表达检测
分离耳蜗组织,加入裂解液提取总蛋白,进行蛋白浓度检测后,进行SDS-PAGE 蛋白电泳分离蛋白,转膜,PBS 洗涤3次,加入脱脂牛奶封闭1 h,然后加入ERK、p-ERK、Nrf2、Trx 和p-JNK、cleaved-caspase-3 的一抗,室温孵育过夜,第2 天应用 TBST 洗涤3次。并加入相应的二抗,室温孵育1 h,应用TBST 进行3次洗膜。最后进行荧光显色操作。ECL 发光法进行显影并采集图像,计算目的蛋白的相对表达量。
1.4 统计学处理
统计学分析通过 SPSS 19.0 for Windows 软件,先进行正态性及方差齐性检验后,行t检验及单向方差分析,实验数据用±s表示。
2 结果
2.1 FBG 与HOMA-IR 监测
结果显示(图1),糖尿病模型小鼠第2次STZ腹腔注射第5天,FGB及HOMA-IR均值与正常组(5.86±0.64)mmol/L、2.58±0.21相比开始升高(8.15±0.82)mmol/L、3.96±0.22,HOMA-IR的变化与FGB呈正相关。至ST 注射后第20天,糖尿病小鼠模型建立成功,此时糖尿病组小鼠FGB、HOMA-IR 基本达到糖尿病标准(11.15±1.82)mmol/L、5.14±0.36。至STZ 注 射后第35天,糖尿病组FBG 和HOMA-IR值达实验最高值(32.60±0.73)mmol/L,17.10±0.25。
2.2 各组小鼠耳蜗毛细胞结构及缺失数量
耳蜗基底膜SDH 染色观察(图2),T2DM 小鼠耳蜗毛细胞与正常Control组相比,体积减小,数量减少,排列不规则。耳蜗顶回至底回相等距离(200 µm)内、外毛细胞计数结果显示,糖尿病组小鼠耳蜗毛细胞与正常组相比,外毛细胞缺失显著(P<0.01),内毛细胞亦有减少(P<0.05),说明2型糖尿病耳蜗毛细胞退化,且以底回外毛细胞损伤为主(图 2)。雷公藤甲素 0.1 mg /kg 处理后T2DM+TPL组与T2DM组相比,内、外毛细胞数量均有不同程度增加(P<0.05),提示雷公藤甲素可以减轻2型糖尿病小鼠耳蜗毛细胞损伤,对毛细胞退化起保护作用。
2.3 各组小鼠p-ERK/Nrf2/Trx 蛋白的表达
结果显示(图3),T2DM组和T2DM+TPL组小鼠耳蜗中Trx、Nrf2 和p-Erk 的蛋白表达量有不同程度低于对照组,且T2DM组低于T2DM+TPL组(相应P值为P<0.05,P<0.01,P<0.01)。而T2DM组和T2DM+TPL组小鼠耳蜗中p-JNK 的蛋白表达量均有不同程度的高于对照组,且T2DM组高于T2DM+TPL组(P<0.01)。各组小鼠ERK、JNK 的蛋白表达水平差异无统计学意义(P>0.05)。
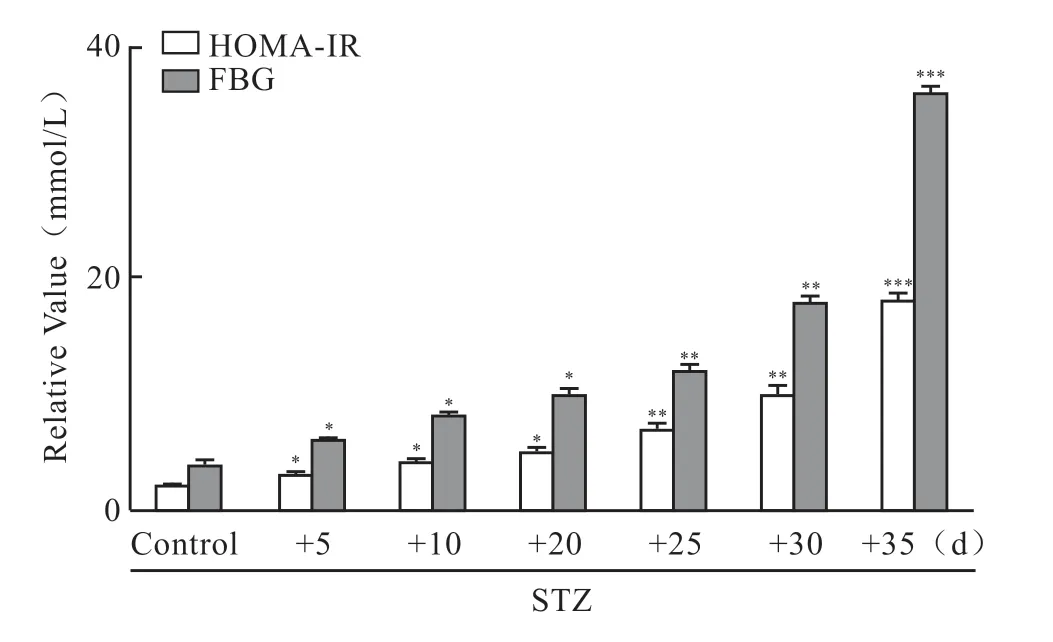
图1 FBG 与HOMA-IR 分析
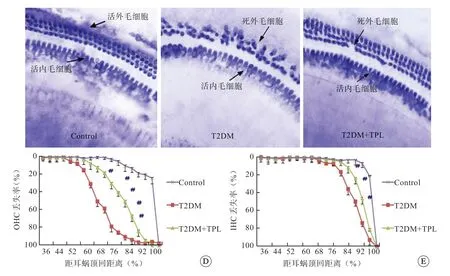
图2 各组小鼠耳蜗基底膜SDH 染色铺片(A-C,×200)及耳蜗外毛细胞(D)、内毛细胞(E)计数统计分析
2.4 各组小鼠凋亡相关蛋白的表达
结果显示(图4),T2DM组和T2DM+TPL组小鼠耳蜗中cleaved-caspase-3 的蛋白表达量有不同程度的高于对照组,且T2DM组高于T2DM+TPL组(P<0.01)。
3 讨论
神经退行性病变是一种缓慢进展性疾病,包括糖尿病性耳聋、视网膜色素变性、帕金森病等,主要病理变化是神经元的退行性变性和凋亡。其发病机制研究表明,神经细胞内过度氧化应激产生的氧化还原失衡在神经元损伤、死亡中起重要作用[8-9]。2型糖尿病长期高血糖导致晚期AGEs生成增加,AGEs通过与其主要的受体RAGEs结合产生大量ROS促发氧化应激[10-11]。许多研究表明ROS在感音神经性耳聋的发病过程中起着不可忽视的作用[12]。耳蜗内有用来灭活自由基的高水平的抗氧化酶类,其中硫氧还蛋白Trx与硫氧还蛋白还原酶(thioredoxin reductase,TrxR)及NADPH 共同构成硫氧还蛋白系统(Trx系统)。Trx系统在清除体内过量ROS的过程中起到了非常重要的作用[13],消除耳蜗处于自由基的高代谢水平。另一方面,外毛细胞侧面含有的独特结构(囊腔结构)是氧自由基产生的关键场所及受累的部位[14]。ROS增加导致毛细胞发生细胞凋亡及丢失[15]。Cleaved-caspase-3表达水平的高低直接反映细胞凋亡程度[16-17]。
Keap1-Nrf2-ARE 通路是细胞抗氧化应激的一个最重要的抗氧化防御机制之一,在生理状态下,胞质中Keap1-Nrf2 与核心泛素结构CUI3-Rbx1 相互作用,Keap1 作为E3 泛素连接酶,靶向引导Nrf2 的泛素化和降解[18]。氧化应激时Nrf2 被磷酸化或者Keap1 的构象发生变化,Nrf2 核转位,介导下游抗氧化蛋白的表达。研究表明Nrf2-ARE 途径调节了Trx 和TrxR 的基因表达[19]。

图3 各组小鼠耳蜗毛细胞内抗氧化分子蛋白电泳图(A);B:Trx 蛋白表达的IOD值分析;C:Nrf2 蛋白表达的IOD值分析;D:p-JNK蛋白表达的IOD值分析;E:p-ERK蛋白表达IOD值分析;*P<0.05,**P<0.01
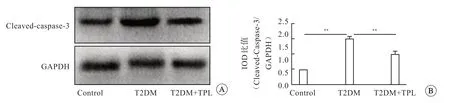
图4 各组小鼠耳蜗毛细胞内凋亡分子蛋白电泳图(A)和cleaved-caspase-3 蛋白表达的IOD值分析(B);**P<0.01
凋亡信号调节激酶1(apoptosis signalregulating kinase 1,ASK1),属于丝裂原激活蛋白激酶激酶激酶(MAPKKK)家族成员,c-jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)是ASK1 下游的重要凋亡分子。ASK1-JNK信号通路是促进细胞凋亡的一条重要的信号转导通路。
正常条件下Trx与Ask1的N末端结合形成Trx-ASK1 复合物抑制Ask1 的活性及其介导的细胞凋亡。在氧化应激时,Trx 从Trx-Ask1 的复合物中释放,活化的Ask1 激活下游凋亡信号通路,引起细胞凋亡和炎症[20]。已有研究发现Trx 通过其氧化还原作用抑制凋亡信号途径,从而对视网膜起到神经保护作用[21]。
本研究结果表明,糖尿病组小鼠耳蜗毛细胞与正常组比较体积小、数量少,排列松散且不规则;Trx表达降低,而凋亡分子cleaved-caspase-3表达升高。提示糖尿病长期高血糖及AGEs 聚积所致的氧化应激导致了耳蜗毛细胞内退行性变性和凋亡,引起耳蜗毛细胞损伤。同时抗氧化相关信号通路Nrf2/Erk1/2 被抑制,而JNK信号通路被激活。
同时,雷公藤甲素组小鼠耳蜗毛细胞与糖尿病组比较体积增大,数量增多,排列规则;耳蜗组织中的抗氧化分子ERK 磷酸化、Nrf2、Trx表达升高,JNK 磷酸化和凋亡分子cleaved-caspase-3表达降低。表明雷公藤甲素可通过激活 p-ERK 和Nrf2 /Trx 抗氧化信号通路,抑制JNK信号减轻糖尿病高血糖所致的耳蜗毛细胞氧化应激延缓耳蜗毛细胞的凋亡,对耳蜗毛细胞具有保护作用。
综上所述,雷公藤甲素能减轻糖尿病耳蜗毛细胞氧化应激损伤诱导的细胞凋亡,其机制可能调控了ERK、JNK 和Nrf2信号通路有关,有望成为治疗2型糖尿病耳蜗毛细胞损伤的有效药物。