3 种富含多糖面包的体外消化酵解特性
柳芳伟,张珊珊,陈苏明,聂少平,胡婕伦,谢明勇
(南昌大学 食品科学与技术国家重点实验室,中国-加拿大食品科学与技术联合实验室(南昌),江西 南昌 330047)
糖尿病是一种以高血糖为特征的代谢紊乱疾病[1]。目前糖尿病的治疗主要依靠药物,但药物治疗费用高、副作用大,为此有报道提出可以通过饮食干预[2-3],即让糖尿病患者食用具有低血糖指数的食物,从而使得糖尿病患者在食用该类食物后血糖波动小,长此以往使病情得到改善。
膳食多糖是指来源于天然食物(如植物、真菌、藻类等)的多糖[4]。它们通常不能被人体的胃肠道酶分解,而是在人体的大肠内被细菌利用,酵解产生短链脂肪酸,从而降低肠道pH值,调节肠道菌群平衡[5]。本实验基于本课题组前期对多糖结构及活性的研究,选择魔芋、瓜尔胶、燕麦β-葡聚糖3 种多糖作为研究对象。此外,有研究表明,食用这3 种多糖可以增强饱腹感进而减少食量,非常符合糖尿病患者“少食多餐”的饮食原则[6-8]。为降低面包中快消化淀粉(rapid digestion starch,RDS)含量,本实验选用了一些营养价值较高且对餐后血糖水平影响较小的食物,如紫薯、黄豆、薏苡仁,将其作为夹心包裹在面皮中,做成夹心面包。其中紫薯直链淀粉含量高于其他薯类,直链淀粉含量越高越容易老化回生形成抗性淀粉[9]。而黄豆中膳食纤维具有促进消化、调节胰岛素水平等功能[10]。薏苡仁则具有降血糖、抗肿瘤、清除自由基等功效。
食物血糖生成指数(glycemic index,GI)反映的是食物对餐后血糖升降的影响。通常将白面包定为标准食物,其GI定为100,根据GI的不同可以将食物分为:高GI食物(GI>70)、中GI食物(55<GI<70)和低GI食物(GI<55)[11-12]。GI越高,食物对餐后血糖的影响越大,不适合糖尿病患者食用。食物血糖负荷(glycemic load,GL)体现的是碳水化合物的量对血糖的影响[13-14]。采用GL与GI结合评价食物可反映一定量的食物中可利用碳水化合物引起的血糖应答[15],更为科学合理。
1 材料与方法
1.1 材料与试剂
魔芋精粉 湖北强森魔芋科技有限公司;瓜尔胶香港嘉森有限公司;燕麦β-葡聚糖 张家口一康生物科技有限公司;胃蛋白酶、胰酶、胆盐 美国Sigma-Aldrich公司;淀粉葡萄糖苷酶、葡萄糖测定试剂盒、淀粉总量检测试剂盒、可利用碳水化合物和膳食纤维测定试剂盒爱尔兰Megazyme公司;氯化血红素 上海阿拉丁有限公司;VK1、刃天青 北京索莱宝科技有限公司;蛋白胨 美国BD Difco公司;酵母浸膏 英国Oxoid公司;其他无机试剂均为国产分析纯。
1.2 仪器与设备
Varioskan Flash全波长多功能酶标仪、超净工作台美国Thermo公司;FE-28台式pH计 瑞士梅特勒-托利多国际贸易有限公司;厌氧手套箱 美国COY公司;FreeZone冷冻干燥机 美国Labconco公司;DSH-10A快速水分测定仪 上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 面包的制备
含膳食多糖的面包:称取100 g按质量比22∶1混合的高筋面粉和膳食多糖,加入60 g水、1 g酵母、1.8 g盐和0.01 g抗坏血酸,混合制成面团,将一定质量的面团用擀面杖辊压成面皮,在面皮上加入煮熟的紫薯、黄豆和薏苡仁,做成夹心面包。将面包置于发酵箱中发酵90 min(温度37 ℃、相对湿度75%),转移至烤箱,烘烤35 min(上、下底温180 ℃)后取出,冷却、包装。
不含多糖的面包(对照面包):将多糖面包中的膳食多糖换成等质量的高筋面粉,其他成分均不变。
白面包:在100 g高筋面粉中加入60 g水、1 g酵母、1.8 g盐和0.01 g抗坏血酸,混合制成面团,将面团切分成小块后揉成圆形,置于发酵箱中发酵90 min(温度37 ℃、相对湿度75%),转移至烤箱,烘烤35 min(上、下底温180 ℃)后取出,冷却、包装[16]。
1.3.2 产品基本理化性质测定
采用快速水分测定仪测定水分质量分数;采用淀粉总量检测试剂盒测定总淀粉质量分数;采用可利用碳水化合物和膳食纤维测定试剂盒测定可利用碳水化合物质量分数。
1.3.3 膳食面包的体外模拟消化
1.3.3.1 模拟消化用的电解质溶液配制
根据Minekus等提出的静态体外消化方法对面包进行体外消化[17]。消化液中盐的浓度如下:模拟唾液:15.1 mmol/L KCl、3.7 mmol/L KH2PO4、13.6 mmol/L NaHCO3、0.15 mmol/L MgCl2·(H2O)6、0.06 mmol/L (NH4)2CO3;模拟胃液:6.9 mmol/L KCl、0.9 mmol/L KH2PO4、25 mmol/L NaHCO3、47.2 mmol/L NaCl、0.1 mmol/L MgCl2·(H2O)6、0.5 mmol/L (NH4)2CO3;模拟肠液:6.8 mmol/L KCl、0.8 mmol/L KH2PO4、85 mmol/L NaHCO3、38.4 mmol/L NaCl、0.33 mmol/L MgCl2·(H2O)6。
1.3.3.2 膳食面包的体外消化模型
模拟口腔消化:将5 g绞碎的面包与5 mL模拟唾液(含有750 U的α-淀粉酶和7.5 μmol的CaCl2)混合,混合体系pH值为7,放入37 ℃的恒温摇床中振荡2 min;模拟胃消化:将口腔消化后的样品与10 mL模拟肠液(含有4 000 U的胃蛋白酶和1.5 μmol的CaCl2)混合,用1 mol/L的HCl溶液调节pH值至3.0后将样品置于37 ℃的恒温摇床中孵育2 h;模拟小肠消化:将胃消化后的样品与20 mL模拟肠液(含有4 000 U的胰酶、0.4 mmol的胆汁和12 μmol的CaCl2)混合,用1 mol/L的NaOH溶液调节pH值至7.0后置于37 ℃条件下恒温振荡3 h。在小肠消化过程中,分别于20、30、60、90、120、180 min时,取500 μL消化液于2 mL离心管中,并立即在99.9 ℃下高温灭酶5 min[18],5 000 r/min离心5 min,取上清液。每个产品一式三份进行体外消化。
1.3.3.3 淀粉水解率的测定
取100 μL消化上清液,加入1 mL醋酸钠缓冲溶液(0.4 mol/L、pH 4.75)和30 μL淀粉葡萄糖苷酶溶液,在60 ℃条件下水浴45 min[19-20],5 000 r/min离心5 min。取25 μL反应后上清液,加入750 μL葡萄糖氧化酶溶液,在50 ℃条件下水浴20 min,在510 nm波长处测定吸光度,根据葡萄糖标准品计算葡萄糖质量。将葡萄糖质量换算成淀粉质量,再利用淀粉总量检测试剂盒测定总淀粉质量,并通过式(1)计算淀粉水解率。以时间为横坐标,淀粉水解率为纵坐标,绘制淀粉消化曲线[21]。
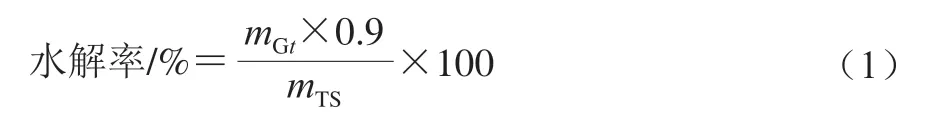
式中:mGt表示取样时间点消化液中葡萄糖质量/mg;0.9表示由葡萄糖换算为淀粉的系数;mTS表示样品中总淀粉质量/mg。
1.3.3.4 快消化淀粉、慢消化淀粉、抗消化淀粉相对含量的计算
根据淀粉的消化速率可将淀粉分为:RDS,即在20 min内消化的淀粉;慢消化淀粉(slowly digestible starch,SDS),即在20~180 min内消化的淀粉;抗消化淀粉(resistant starch,RS),即超过180 min不消化的淀粉[22-23]。根据公式(2)~(4)分别计算各样品中RDS、SDS和RS的相对含量。


式中:m20为水解20 min后产生的葡萄糖质量/mg;mFG为未水解时淀粉中的游离葡萄糖质量/mg;m180为水解180 min后产生的葡萄糖质量/mg;0.9为葡萄糖换算成淀粉的系数;mTS为样品中总淀粉质量/mg。
1.3.3.5 估计血糖生成指数和估计血糖负荷的测定
估计血糖生成指数(estimate glycemic index,eGI)参考Akerberg[24]和Lau[25]等的方法计算,公式如式(5)所示。

式中:HI为水解指数/%,是指被测食物体外水解曲线下面积与等量标准食物(白面包)体外水解曲线下面积之比。
估计血糖负荷(estimate glycemic load,eGL)是指该食物的eGI与摄入该食物的实际可利用碳水化合物质量的乘积(本研究中摄入该食物的质量按50 g计算),计算公式[26]如式(6)所示。

1.3.4 膳食面包的体外模拟酵解
1.3.4.1 粪便接种物的制备
新鲜粪便样本取自糖尿病患者和健康受试者各10 名,其均有良好的饮食习惯,至少3 个月以上未服用过抗生素,并且均未出现过肠道疾病。将取好的粪便立即转移至厌氧手套箱,用磷酸盐缓冲液按固液比1∶4稀释,漩涡混匀,500×g离心5 min,上清液通过3 层无菌纱布,得到粪便滤液。
1.3.4.2 发酵培养基的制备
每1 L酵解培养基中含有3 g细菌蛋白胨、3 g酵母浸膏、0.1 g NaCl、40 mg K2HPO4、40 mg KH2PO4、10 mg MgSO4·(H2O)7、10 mg CaCl2·(H2O)6、2 g NaHCO3、1 gL-盐酸半胱氨酸、0.5 g胆盐、20 μL VK1、2 mL Tween-80、0.02 g氯化血红素、1 mL混合维生素、5 g消化冻干样品(将消化后的样品倒入透析袋,透析26 h后冻干[27])或菊粉,调节pH值至7.0左右,121 ℃高压蒸汽灭菌15 min[28]。
1.3.4.3 酵解
在厌氧环境(5% H2、5% CO2、90% N2)下,将粪便接种物加入到发酵培养基中,漩涡混匀,使每根Hungate厌氧管中均含有体积分数1%的粪便提取液。加塞、封盖,置于37 ℃厌氧环境下培养,在0、6、12、24、48 h 5 个时间点分别取出相应的厌氧管,酵解液混匀后分装到小管中,于-80 ℃下冻存,用于后续指标测定。以菊粉和蒸馏水分别作为阳性、阴性对照,每个时间点、每个平行设置单独的厌氧管[29]。
1.3.4.4 pH值的测定
取不同时间点的酵解液1 mL于10 mL的离心管中,用FE-28台式pH计测定酵解液的pH值。
1.3.4.5 糖酵解过程中糖消耗情况分析
参考张冠亚的方法测定糖质量浓度[30]。在试管中加入490 μL蒸馏水、10 μL酵解液、500 μL质量分数3%的苯酚和2 mL浓硫酸,30 min后于490 nm波长处测定吸光度。配制0.1 mg/mL的标准葡萄糖溶液并稀释成6 个不同质量浓度梯度,用于绘制标准曲线。糖消耗率按式(7)计算。

1.4 数据处理与分析
实验所得数据采用SPSS统计软件进行单因素方差分析,并采用Tukey HSD法进行两两比较,P<0.05则认为差异具有统计学意义。采用GraphPad Prism 7.0软件作图。
2 结果与分析
2.1 面包的主要成分质量分数

表1 面包的主要成分质量分数Table 1 Contents of major components in breads
面包主要成分质量分数测定结果如表1所示,含多糖面包总淀粉质量分数在50%~60%之间,可利用碳水化合物质量分数在67%~73%之间,均较白面包中总淀粉和可利用碳水化合物质量分数低。
2.2 面包的淀粉水解率
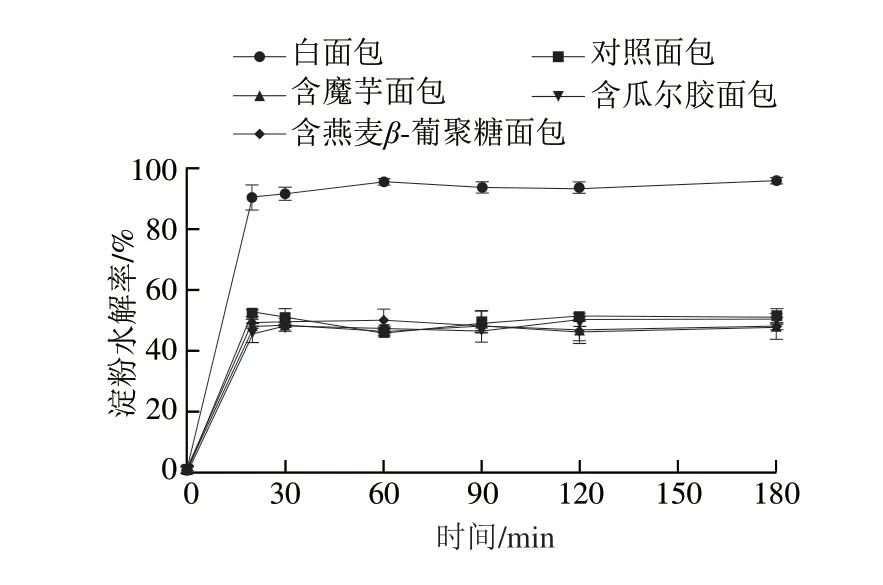
图1 面包在消化过程中的淀粉水解曲线Fig.1 Starch hydrolysis curves during bread digestion
采用体外实验的方法对面包进行消化模拟,其淀粉水解率分析结果如图1所示,各面包在0~20 min时淀粉水解速率急剧上升,在20 min后,淀粉的水解速率基本趋于平衡。且在小肠消化180 min时,白面包的水解率为96.24%,不含多糖面包的水解率为52.62%,3 种多糖面包的淀粉水解率在49%~52%之间,其中含瓜尔胶面包(51.62%)>含燕麦β-葡聚糖面包(50.35%)>含魔芋面包(49.86%)。3 种多糖面包的淀粉水解率较小,可能与淀粉的晶体结构改变和黏度变化有关。Zheng Mingjing等将添加了瓜尔胶的莲子淀粉与不添加瓜尔胶的莲子淀粉进行比较,发现添加了瓜尔胶的莲子淀粉具有更低的淀粉水解率,并解释可能是由于瓜尔胶改变了淀粉的结构和黏度,从而推迟了淀粉的体外消化[31]。
2.3 面包中RDS、SDS、RS相对含量比较
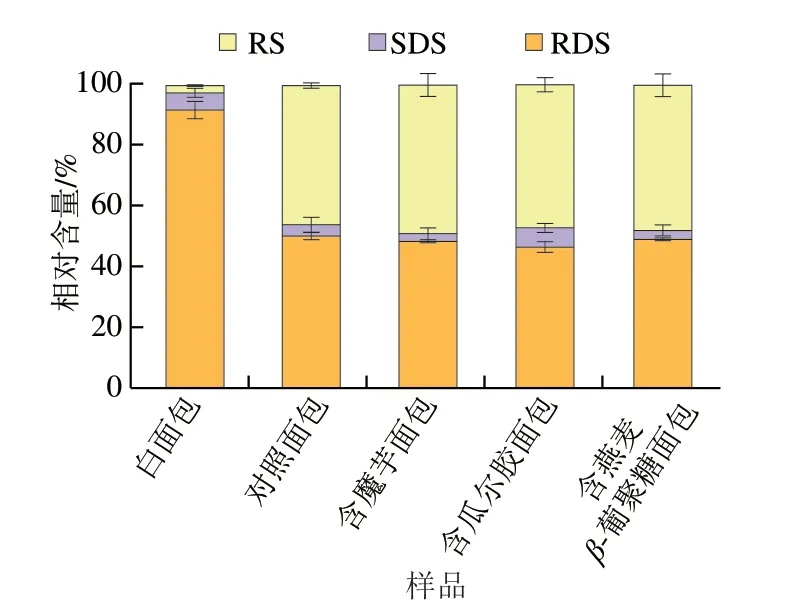
图2 面包的淀粉组分及相对含量Fig.2 Starch composition of breads
面包中RDS、SDS、RS相对含量如图2所示,3 种多糖面包的RDS、SDS、RS相对含量分别为45%~53%、2%~7%、45%~49%。其中含魔芋面包、含燕麦β-葡聚糖面包和含瓜尔胶面包的RS相对含量分别为50.14%、49.65%、48.38%。白面包和不含多糖面包的RS相对含量分别为3.76%和47.38%。白面包的RDS相对含量明显高于其他几款面包,这可能是由于白面包的多孔结构使得与酶大面积接触从而使淀粉快速水解。除白面包外其他几款面包呈现高RS相对含量的现象,这可能是由于脂质的存在,阻止了淀粉的糊化[32]。
2.4 面包的eGI和eGL

表2 面包的eGI和eGLTable 2 eGI and eGL values of breads
有的食物虽然GI很高,但食物中摄入的可利用碳水化合物含量低,会导致其GL相对较低。因此通过结合GI和GL来选择食物,这样既考虑到食用后对血糖变化影响,又照顾到食用量对血糖负荷的影响[33]。
面包的eGI和eGL如表2所示。不含多糖面包的eGI为53.24,含魔芋面包、含瓜尔胶面包和含燕麦β-葡聚糖面包的eGI分别为52.41、52.84、52.71,均小于55,属于低GI食物。本实验中以摄入食物50 g计算,得到不含多糖面包、含魔芋面包、含瓜尔胶面包、含燕麦β-葡聚糖面包的eGL分别为9.79、9.16、9.00、8.76,不含多糖面包的eGL显著高于3 种多糖面包的eGL(P<0.05)。一般认为GL<10为低血糖负荷食物,10≤GL≤19为中血糖负荷食物,GL≥20为高血糖负荷食物[34]。因此,3 种多糖面包在摄入50 g时属于低血糖负荷食物,对血糖影响较小。这可能归因于3 种多糖面包具有低可利用碳水化合物和高抗性淀粉含量的特性,使得它们在胃肠消化中水解产生的葡萄糖含量较少。
2.5 酵解过程中的pH值变化情况

图3 面包消化后产物在正常受试者粪便中酵解的pH值变化情况Fig.3 pH change of the digested products of breads during fermentation by fecal bacteria from normal people

图4 面包消化后产物在糖尿病患者粪便中酵解的pH值变化情况Fig.4 pH change of the digested products of breads during fermentation by fecal bacteria from diabetic patients
在酵解实验中pH值的变化情况在一定程度上可以反映酵解体系中碳水化合物的消耗程度和短链脂肪酸的产生情况。如图3所示,3 种多糖面包在正常受试者粪便中酵解至24 h时pH值均显著下降,其中含燕麦β-葡聚糖面包降幅最大,在24~48 h间,pH值的降幅趋于平缓。如图4所示,3 种多糖面包在糖尿病患者粪便中酵解至12 h时pH值均明显下降,3 种多糖面包的降幅相近,在酵解12 h后,降幅趋于平缓甚至稍有上升,这可能与有机酸的消耗有关[35]。在48 h的酵解过程中,含魔芋面包、含瓜尔胶面包、含燕麦β-葡聚糖面包在用正常受试者粪便酵解时,pH值分别下降了2.51±0.08、2.56±0.02、2.59±0.06,在用糖尿病患者粪便酵解时,pH值分别下降了2.29±0.02、2.28±0.02、2.24±0.03。由此可知,面包在正常受试者粪便中酵解的pH值下降量高于在糖尿病患者粪便中酵解的pH值下降量。这可能是由于正常受试者粪便中菌群比糖尿病患者粪便中的菌群具有更高的丰富度和多样性,使得产生的有机酸含量更高。
2.6 酵解过程中糖消耗情况
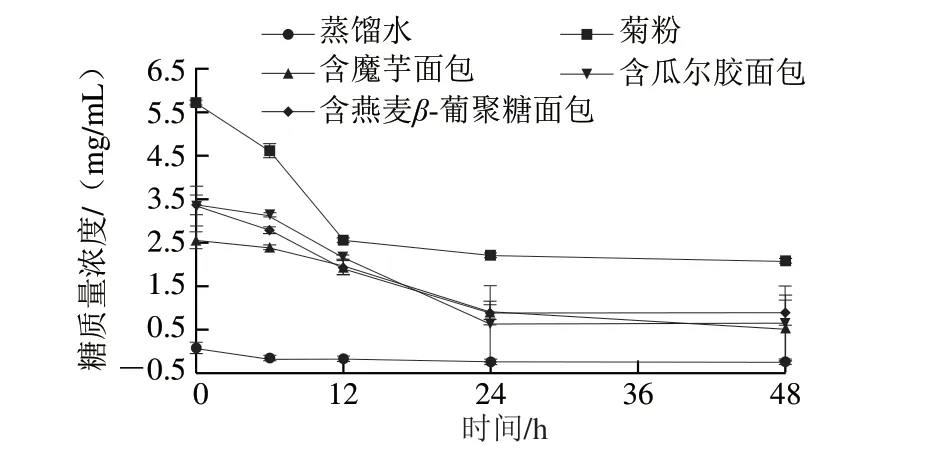
图5 面包消化后产物在正常受试者粪便中酵解的糖消耗情况Fig.5 Sugar consumption of the digested products of breads during fermentation by fecal bacteria from normal people
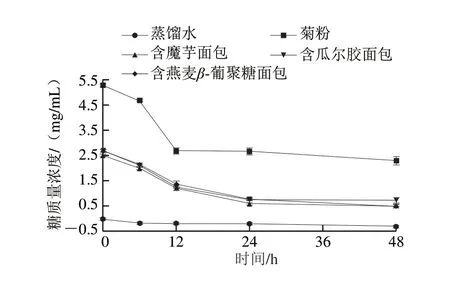
图6 面包消化后产物在糖尿病患者粪便中酵解的糖消耗情况Fig.6 Sugar consumption of the digested products of breads during fermentation by fecal bacteria from diabetic patients
在酵解体系中,肠道菌群会将高分子碳水化合物降解成小分子化合物供自身生长,且碳水化合物的被酵解程度绝大部分取决于它本身的性质。因此,糖含量不仅可以反映肠道菌群利用碳水化合物的情况,而且可以反映该碳水化合物是否易被肠道菌群利用[36]。如图5所示,3 种多糖面包在用正常受试者粪便酵解的过程中,糖消耗率分别为:含魔芋面包(80.00±1.10)%、含瓜尔胶面包(81.22±2.53)%、含燕麦β-葡聚糖面包(72.79±1.97)%,菊粉的糖消耗率为(63.46±0.59)%。如图6所示,3 种多糖面包在用糖尿病患者粪便酵解的过程中,糖消耗率分别为:含魔芋面包(78.36±0.63)%、含瓜尔胶面包(72.59±0.94)%、含燕麦β-葡聚糖面包(81.88±0.46)%,菊粉的糖消耗率为(56.47±1.12)%。不论是在正常受试者粪便中酵解还是在糖尿病患者粪便中酵解,3 种多糖面包的糖消耗率均明显高于菊粉,可以认为,3 种多糖面包消化后产物可以很好地被粪便中肠道菌群利用。除了含燕麦β-葡聚糖面包之外,另外两种多糖面包和菊粉在用糖尿病患者粪便酵解过程中糖消耗率比在用正常受试者粪便酵解过程中糖消耗率有所降低,对比酵解过程中pH值的变化情况来看,这可能也与粪便中的菌群丰富度有关[37]。
3 结 论
本研究中以高筋面粉、黄豆、薏仁、紫薯为主要原料并添加一定量的膳食多糖制作成富含多糖的面包,通过分析基本指标并进行体外模拟胃肠消化实验,结果表明,这3 种多糖面包具有低可利用糖类、高抗性淀粉等特点,属于低GI食物,当以食物质量为50 g计算时,3 种多糖面包的eGL显著低于不含多糖面包(P<0.05),且均为低血糖负荷食物。此外,通过将3 种多糖面包的消化后产物分别用正常受试者粪便和糖尿病患者粪便进行体外模拟大肠酵解实验,结果发现,未被消化的碳水化合物在正常受试者和糖尿病患者肠道菌群的作用下均可被大量利用,供肠道菌群生长。说明这3 种面包在一定食用量范围内对血糖的影响较小且不消化糖类被菌群的利用率高,适合控糖人群食用。

