条斑紫菜多糖的降解条件优化及其生物活性
姜 慧,孔立敏,王 翀,王彦波,傅玲琳,周 涛
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
条斑紫菜(Porphyra yezoensis)是一种多产于东亚国家的经济型褐藻,在我国江苏沿海有较大的栽培区域,以此为原料加工的产品外销量约占全球条斑紫菜贸易总量的一半,但基本都是初级加工产品。研究表明条斑紫菜多糖有抗氧化、降血脂、抑制癌细胞增长、免疫调节等多种生物活性[1],而多糖的生物活性常与其结构以及分子质量有关[2-4],但由于条斑紫菜多糖(Porphyra yezoensispolysaccharide,PSPY)分子质量较大、表观黏度较高和水溶性相对较低等原因,其产品开发和活性研究受到限制,故对多糖进行降解,降低多糖分子质量和表观黏度,基本结构暴露更多的活性基团有利于提高多糖的生物活性。
降解多糖有超声波降解法[5]、酶降解法[6]和化学降解法等多种方法,化学降解又分为酸降解、碱降解和氧化降解,其中H2O2和VC联合降解法环保并且接近植物体内氧化还原反应[7],如Hou Yun等[8]研究表明经H2O2-VC降解的岩藻糖基本结构无明显变化,降解后多糖的抗氧化性增强;Chen Bingjie等[9]用H2O2-VC降解羊栖菜多糖,发现降解后多糖的抗氧化性显著提高,再结合本课题组的前期研究[10-13],本实验采取H2O2-VC联合法降解PSPY,并对降解条件进行优化以制备具有较高自由基清除活性的多糖。对条斑紫菜降解多糖(degradedPorphyra yezoensispolysaccharide,DPSPY)进行表征和活性研究,与PSPY进行对比,为研发具有良好抗氧化、降血脂、提高免疫活性的PSPY相关功能性食品提供理论依据,以延长产品商业链,提高条斑紫菜的附加值。
1 材料与方法
1.1 材料与试剂
条斑紫菜(Porphyra yezoensis)购于江苏南通昌钰海苔有限公司。
木瓜蛋白酶、猪胰酶、肌醇、普鲁兰多糖、1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH)、DMEM高糖完全培养液、磷酸盐缓冲液(phosphate buffer,PBS) 吉诺生物医药技术公司;脂多糖 美国Sigma公司;胎牛血清 浙江杭州四季青生物工程有限公司;MTT细胞增殖检测试剂盒、中性红 上海生工生物工程有限公司;磺胺、萘乙二胺(N-(1-萘基)乙二胺二盐酸盐)、亚硝酸钾 上海阿拉丁试剂有限公司;总胆汁酸试剂盒 南京建成生物科技有限公司。其他试剂均为分析纯。
1.2 仪器与设备
HERAcell 150i型CO2培养箱 上海纳锘实业有限公司;SpectraMax Plus 38型酶标仪 美谷分子仪器公司;HF900 A2 Heal Force生物安全柜 力康生物医疗科技控股集团;ECLIPSE Ti-S型倒置显微镜 日本Nikon公司;Count star自动细胞计数分析仪 京百卓显科技有限公司;LDZX-30FBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;UV-2550型紫外-可见分光光度计 日本岛津公司;Trace GC Ultra DSQII型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 美国Thermo Fisher公司;2695高效液相色谱仪 美国Waters公司;NICOLET-380傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国热电公司。
1.3 方法
1.3.1 PSPY的制备
条斑紫菜60 ℃烘箱内干燥2 h破碎成粉,过100 目筛,粉末按固液比1∶20(m/V)加无水乙醇后于90 ℃下浸提2 h,重复3 次除色素,抽滤后滤渣烘干备用。取去除色素的粉末8 g,以1∶75(m/V)加去离子水于90 ℃下水提4 h,离心收集上清液,浓缩至原体积的1/6后加4 倍体积的无水乙醇,4 ℃静置12 h,收集沉淀,待乙醇挥发后加20 mL去离子水复溶得到糖溶液。
采用酶-S e v a g 复合法除蛋白,向糖溶液中按1 000∶1(V/m)加入木瓜蛋白酶,于50 ℃水浴锅中酶解1 h,100 ℃沸水浴灭活15 min,冷却后离心(8 000 r/min、10 min)除去变性蛋白沉淀,将所得的糖溶液与三氯甲烷和正丁醇按体积比20∶4∶1混合后静置分层,弃下层溶液,上层糖溶液继续按上述条件与三氯甲烷和正丁醇混合,反复至下层无浑浊蛋白。除蛋白后的糖溶液用3 500 Da透析袋透析72 h,4 h换一次水,结束后浓缩至5 mL再冷冻干燥,获得PSPY,多糖提取率按式(1)计算,得到多糖提取率为9.7%。

1.3.2 单因素试验
以DPPH自由基清除率为指标进行单因素试验,研究不同H2O2-VC浓度、温度、降解时间条件下降解PSPY得到的DPSPY对DPPH自由基的清除率。DPPH自由基清除率的测定参考Xu Jie等[14]的方法,2 mL多糖溶液与2 mL 0.1 mmol/L DPPH-乙醇溶液混合均匀,37 ℃恒温避光反应30 min,以VC作阳性对照,于517 nm波长处测定吸光度,DPPH自由基清除率按式(2)计算。

式中:A0为去离子水代替样品测得的吸光度;Al为样品溶液测得的吸光度;A2为无水乙醇代替DPPH测得的吸光度。
1.3.2.1 H2O2-VC浓度对DPSPY清除DPPH自由基的影响
取5 mg/mL的PSPY溶液,加入H2O2和VC,使溶液中H2O2和VC的终浓度均分别为0、2、4、6、8、10 mmol/L[15],50 ℃水浴1.5 h。再浓缩、醇沉、离心、复溶、透析、冷冻干燥,各处理条件同1.3.1节,处理得到6 组DPSPY,测3 mg/mL的DPSPY对DPPH自由基的清除率。
1.3.2.2 温度对DPSPY清除DPPH自由基的影响
取5 mg/mL的PSPY溶液,将溶液中的H2O2-VC浓度调至4 mmol/L,于30、40、50、60、70 ℃ 5 组温度下降解1.5 h。同1.3.2.1节处理得到5 组DPSPY,测3 mg/mL的DPSPY对DPPH自由基的清除率。
1.3.2.3 降解时间对DPSPY清除DPPH自由基的影响
取5 mg/mL的PSPY溶液,将溶液中的H2O2-VC浓度调至4 mmol/L后于50 ℃下分别降解0.5、1、1.5、2、2.5、3 h。同1.3.2.1节处理得到6 组DPSPY,测3 mg/mL的DPSPY对DPPH自由基的清除率。
1.3.3 响应面试验设计
在单因素试验基础上,利用Design Expert软件、Box-Behnken模型和响应面法,以3 mg/mL的DPSPY对DPPH自由基的清除率作为响应值,对影响降解的3 个因素进行优化,试验设计见表1。

表1 Box-Behnken模型设计因素与水平Table 1 Code and level of independent variables used for Box-Behnken design
1.3.4 DPSPY的制备
单因素试验和响应面法获取最佳降解条件,在此条件下降解水提多糖,经浓缩、醇沉、离心、复溶、透析、冷冻干燥,制备DPSPY。
1.3.5 PSPY和DPSPY组成及结构分析
利用硫酸苯酚法测定总糖质量分数[16];利用考马斯亮蓝法测定蛋白质量分数;利用硫酸钡比浊法进行硫酸根质量分数的测定[17]。
采用G C-M S 分析单糖组成[4,11]。分析条件:DD-17MS石英毛细管柱(30 m×0.25 mm,0.25 µm);升温程序:80 ℃保持3 min,以15 ℃/min升至190 ℃,保持4 min,然后以10 ℃/min升温至230 ℃,保持4 min;载气(N2)流速1.0 mL/min,进样量1 µL;分流比:20∶1,电子轰击离子源;电子能量70 eV;离子源温度230 ℃;质量扫描范围m/z45~500。
采用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)法测定多糖分子质量[18]。条件:UltrahydrogelTM2000色谱柱(7.8 mm×300 mm);示差折光检测器;流动相为20 mmol/L的硫酸钠溶液;流速为0.6 mL/min;柱温和检测器温度为(30±5)℃;进样量10 μL。
采用紫外-可见分光光度计扫描样品得到紫外-可见光谱图,从而检测纯度[19];采用FTIR仪在400~4 000 cm-1范围内进行扫描,分析多糖结构。
1.3.6 PSPY和DPSPY的体外抗氧化能力测定
1.3.6.1 还原力和DPPH自由基清除能力的测定
参考Liu Yong等[20]的方法测定PSPY和DPSPY的还原力。取0.5 mL样品溶液(0.25、0.5、1、2、4、8 mg/mL),加入0.5 mL 0.2 mol/L的PBS溶液、0.5 mL 1 g/100 mL的铁氰化钾溶液,50 ℃反应20 min后加0.5 mL 10 g/100 mL的三氯乙酸溶液,4 500 r/min离心10 min后取1 mL上清液,加入0.2 mL 0.1 g/100 mL氯化铁溶液,混匀后静置10 min,以VC作为阳性对照,于700 nm波长处测定吸光度,并以该吸光度表征还原力。
DPPH自由基清除能力测定方法同1.3.2节。
1.3.6.2 羟自由基清除能力测定
羟自由基清除能力的测定参照Liu Yong等[20]的方法,在0.5 mL样品溶液(0.25、0.5、1、2、4、 8 mg/mL)中加0.5 mL 9 mmol/L FeSO4溶液和0.5 mL 9 mmol/L的水杨酸-乙醇溶液,混匀后加入0.5 mL 9 mmol/L H2O2溶液,在37 ℃水浴中反应0.5 h,以VC作为阳性对照,于510 nm波长处测定吸光度,羟自由基清除率按式(3)计算。

式中:A0为去离子水代替样品测得的吸光度;Al为样品溶液测得的吸光度;A2为乙醇代替水杨酸-乙醇溶液测得的吸光度。
取0.2 mL样品溶液(0.25、0.5、1、2、4 mg/mL),加入50 mmol/L的Tris-HCl缓冲液1 mL,25 ℃水浴20 min后加入7 mmol/L邻苯三酚溶液1 mL,充分反应后加10 mol/L盐酸0.2 mL终止反应,以VC作为阳性对照,于420 nm波长处测吸光度,O2-·清除率按式(4)计算。

式中:A0为去离子水代替样品测得的吸光度;Al为样品溶液测得的吸光度;A2为乙醇代替邻苯三酚溶液测得的吸光度。
1.3.7 PSPY和DPSPY的体外胆酸盐结合能力测定
样品前处理参考何平伟[21]、Niu Yuge[22]等的方法,按照Yang Bao等[23]的方法采用总胆汁酸试剂盒测定多糖体外结合胆酸盐(胆酸钠、脱氧胆酸钠、鹅去氧胆酸钠、甘氨胆酸钠和牛磺胆酸钠)的能力。75 mg PSPY(或DPSPY)溶于6 mL 0.01 mol/L盐酸溶液,空白组只加盐酸溶液,于37 ℃水浴锅中模拟消化2 h后加600 μL 0.1 mol/L的NaOH溶液。取1 mL样液与1.5 mL 0.3 mmol/L胆酸盐溶液(溶剂为50 mmol/L pH 6.9 PBS)、2 mL 10 mg/mL猪胰酶充分混合,8 000 r/min离心10 min后取上清液。按照总胆汁酸试剂盒说明操作测得上清液中胆酸盐浓度,以考来烯胺为阳性对照、纤维素为阴性对照,胆酸盐结合率按式(5)计算。

1.3.8 PSPY和DPSPY的体外免疫活性测定
1.3.8.1 对RAW264.7细胞增殖活性的影响
采用MTT细胞增殖检测试剂盒测定多糖对RAW264.7细胞增殖活性的影响。调整RAW264.7细胞密度为1×105个/mL,在96 孔细胞培养板中每孔接种50 µL,样品组加50 µL DMEM高糖完全培养液配制的50、100、200、500 µg/mL和1 000 µg/mL多糖溶液(终质量浓度为25、50、100、250 µg/mL和500 µg/mL),正常组加同体积的DMEM高糖完全培养液,阳性对照加同体积的20 µg/mL脂多糖(lipopolysaccharide,LPS)溶液,使LPS终质量浓度为10 µg/mL,37 ℃、5% CO2条件下分别培养24 h和48 h,细胞培养结束后,加10 µL 5 mg/mL的MTT试剂,均匀后继续培养4 h,弃培养液后加100 µL甲臜,振荡至全部溶解,测定570 nm波长处各孔溶液吸光度。
1.3.8.2 对RAW264.7细胞吞噬活性的影响
调整RAW264.7细胞密度为4×105个/mL,培养方法同1.3.8.1节,阳性对照组加入50 µL 10 µg/mL LPS,使终质量浓度为5 µg/mL,弃培养液后加100 µL、体积分数0.075%的中性红溶液,培养4 h后用PBS洗3 次除去中性红,再加入150 µL细胞裂解液(V(冰醋酸)∶V(无水乙醇)=1∶1),37 ℃静置1 h,振荡均匀后于570 nm波长处测各孔溶液的吸光度。
1.3.8.3 对RAW264.7细胞NO分泌量的影响
1.4 数据统计与分析
使用Excel 2010和SPSS 19软件进行数据处理和分析,Duncan’s法进行多组样本间差异显著性分析,使用Origin 2017软件进行绘图。
2 结果与分析
2.1 单因素试验结果

图1 H2O2-VC浓度(A)、温度(B)、降解时间(C)对DPSPY清除DPPH自由基活性的影响Fig.1 Effects of H2O2-VC concentration (A), temperature (B), and degradation time (C) on DPPH radical scavenging activity of DPSPY
如图1A所示,H2O2-VC的浓度在0~4 mmol/L时,DPSPY对DPPH自由基清除率有剂量依赖关系,可能是高浓度的H2O2-VC能促进多糖作用;H2O2-VC浓度在4~10 mmol/L范围内逐渐增加时,多糖对DPPH自由基清除率逐步降低,可能是当H2O2-VC浓度超过4 mmol/L时,多糖降解成更小的结构影响了清除效果。
如图1B所示,温度在30~50 ℃范围内时,DPSPY的DPPH自由基清除率与温度呈正相关;50 ℃后多糖的DPPH自由基清除率与温度呈负相关。适当提高温度可以促进分子运动,加速PSPY的降解反应;温度过高可能使H2O2挥发过量,导致PSPY降解效果变差,使PSPY中活性基团不能充分暴露,导致DPSPY对DPPH自由基的清除活性变弱。
如图1C所示,降解时间短于2 h时,DPSPY对DPPH自由基的清除率与时间呈正相关,2 h后降解反应仍在继续,可能使PSPY降解过度,从而使DPSPY清除DPPH自由基的活性降低。
2.2 响应面优化降解条件试验结果
2.2.1 试验设计与结果分析
根据单因素试验,H2O2-VC的浓度(X1)、温度(X2)、降解时间(X3)为三因素,3 mg/mL的DPSPY对DPPH自由基的清除率作为响应值,采用Box-Behnken设计试验,结果见表2。用Design Expert软件对表2结果进行二次回归分析,回归分析结果见表3。回归方程:

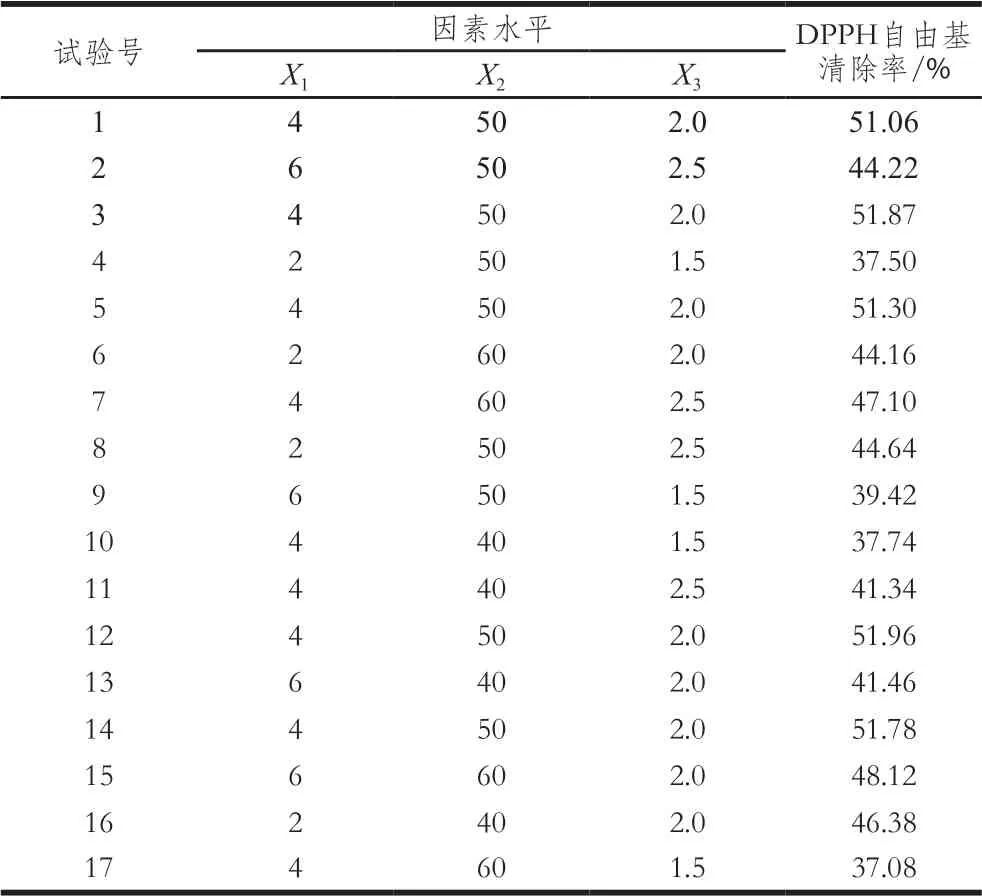
表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis

表3 回归模型方差分析Table 3 Analysis of variance of regression model
由表3看出,回归模型的P值小于0.000 1,模型极显著,失拟项P=1.196 9,不显著,表示二次回归模型可用于分析预测,无需引入更高次模型和新的变量。决定系数R2为0.996 2,表示试验误差较小。变异系数为1.12%,说明试验有较高的重复性、精度和良好的可靠性。校正决定系数与R2值接近,说明模型拟合度较好,具有准确性和较高的相关性。对DPSPY清除DPPH自由基能力的影响极显著(P<0.01),X2、X2X3对DPSPY清除DPPH自由基能力的影响显著(P<0.05),其他因素影响不显著。
2.2.2 交互作用结果分析结果


图2 交互作用的响应面及等高线图Fig.2 Response surface and contour plots showing the interactive effects of variables
响应面和等高线图可以反映变量之间的交互作用,响应面越陡峭,等高线呈椭圆形,表示交互作用越显著,由图2可知,H2O2-VC浓度与温度、温度和降解时间的交互作用显著,与方差分析的结果相同。
2.2.3 降解条件优化实验验证结果
通过Design Expert软件分析得出PSPY最佳降解条件为:H2O2-VC浓度4.16 mmol/L、降解时间2.12 h、温度52.46 ℃,理论上此降解条件得到的DPSPY对DPPH的清除率为52.14%。修正条件为H2O2-VC浓度4.1 mmol/L、52.4 ℃下降解2.1 h,此时3 mg/mL DPSPY对DPPH自由基的清除率达51.01%,接近理论值52.14%。
2.3 PSPY和DPSPY的组成和结构分析结果
2.3.1 PSPY和DPSPY的组成

表4 PSPY和DPSPY的主要成分与单糖组成Table 4 Main components and monosaccharide compositions of PSPY and DPSPY
如表4所示,降解后多糖的总糖和硫酸根质量分数增加,蛋白质量分数降低,可能是H2O2-VC造成糖链上部分糖蛋白基团解离,少量带硫酸根的小分子聚糖被透析除去。PSPY和DPSPY主要由半乳糖、葡萄糖和少量的甘露糖、鼠李糖和木糖组成,降解前后单糖质量分数有轻微差别。
2.3.2 PSPY和DPSPY的分子质量


图3 PSPY、DPSPY的HPGPC图Fig.3 High performance gel permeation chromatography profiles of PSPY and DPSPY
PSPY、DPSPY的保留时间分别为14.43 min和17.42 min(图3),根据标准曲线方程和样品保留时间,得出PSPY、DPSPY分子质量分别为452、17 ku,表明H2O2-VC有效降解了PSPY。
2.3.3 PSPY和DPSPY的紫外-可见光谱

图4 PSPY和DPSPY的紫外-可见光谱图Fig.4 UV-visible absorption spectra of PSPY and DPSPY
图4 为PSPY和DPSPY的紫外-可见光谱图,PSPY和DPSPY在280 nm波长处有弱吸收峰,说明存在少量的蛋白质,符合组成分析结果;在260 nm及400~700 nm波长处未出现吸收峰,表示PSPY和DPSPY中基本无核酸和色素的存在。
2.3.4 FTIR图谱

图5 PSPY和DPSPY的FTIR图谱Fig.5 Fourier transform infrared spectroscopy spectra of PSPY and DPSPY
由图5可见,PSPY和DPSPY的FTIR光谱图峰位差异不大,说明降解没有改变PSPY的基本基团结构。其中3 441 cm-1附近为O—H伸缩振动特征吸收带,1 636 cm-1附近为羧基的C=O的非对称伸缩振动吸收峰[25]。在1 260 cm-1处有较弱的O=S=O的非对称伸缩振动峰,表明了硫酸基团存在。1 069 cm-1处属于葡萄糖残基的伸缩振动吸收峰,950 cm-1附近是吡喃糖环末端的次甲基的横摇振动峰,这两峰证明了吡喃糖的存在[26]。在824 cm-1处为α-型糖苷键的吸收峰,864 cm-1处为β-糖苷键的吸收峰[27]。
2.4 PSPY和DPSPY体外抗氧化实验结果
2.4.1 PSPY和DPSPY的还原力

图6 VC、PSPY和DPSPY的还原力Fig.6 Reducing power of VC, PSPY and DPSPY
如图6所示,PSPY和DPSPY的还原力明显弱于阳性对照VC,还原能力随质量浓度提高而增强,DPSPY的还原力优于PSPY。有研究表明多糖的还原力与分子质量大小有关,一定程度上多糖的还原力随分子质量的减少而增强[28-30],这与前面得到的DPSPY分子质量远小于PSPY的结果吻合。
2.4.2 PSPY和DPSPY对DPPH自由基清除率的影响
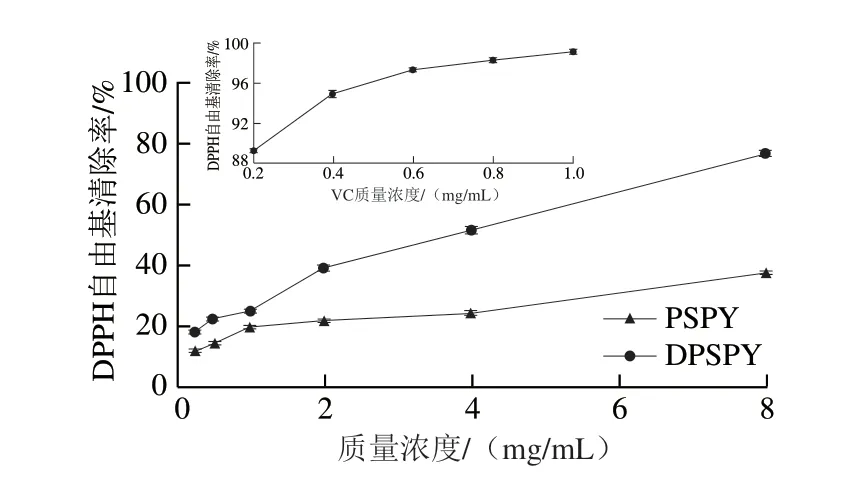
图7 VC、PSPY和DPSPY对DPPH自由基的清除率Fig.7 Scavenging capacity of VC, PSPY and DPSPY on DPPH radicals
如图7所示,PSPY和DPSPY对DPPH自由基的半抑制质量浓度(50% inhibition concentration,IC50)分别为15.07 mg/mL和3.71 mg/mL。两种多糖对DPPH自由基的清除能力与VC差距较大,且有剂量依赖关系。在相同质量浓度下,DPSPY对DPPH自由基的清除能力明显高于PSPY,表示H2O2-VC降解PSPY能增强其对DPPH自由基的清除能力,这一方面是由于降解使PSPY提供氢的活性基团暴露;另一方面,大量研究表明硫酸根含量高的多糖自由基清除活性相对较高[18],也可能是因为DPSPY中活性基团硫酸根质量分数更高。
2.4.3 PSPY和DPSPY对羟自由基清除率的影响

图8 VC、PSPY和DPSPY对羟自由基的清除率Fig.8 Scavenging capacity of VC, PSPY and DPSPY on hydroxyl radicals
由图8可知,VC、PSPY和DPSPY羟自由基清除率的IC50分别为0.25、19.25 mg/mL和10.86 mg/mL,同质量浓度下的羟自由基清除率由大到小依次为:VC>PSPY>DPSPY。4 mg/mL DPSPY的羟自由基清除率(31.18%)与0.2 mg/mL VC相当,这表明DPSPY能一定程度抑制机体的氧化损伤。

图9 VC、PSPY和DPSPY对·的清除率Fig.9 Scavenging capacity of VC, PSPY and DPSPY on superoxide anion radicals
2.5 PSPY和DPSPY的胆酸盐结合能力
胆酸盐结合能力常用来评价化合物其体外降血脂的活性。如图10所示,PSPY和DPSPY都能结合胆酸盐,DPSPY的胆酸盐结合率高于PSPY。人体胆酸盐多以共轭形式存在,如牛磺胆酸与甘氨胆酸;游离胆酸为非共轭胆酸,如胆酸与脱氧胆酸[31]。PSPY和DPSPY对牛磺胆酸钠和鹅去氧胆酸钠的结合率相对较高,其中DPSPY对牛磺胆酸钠和鹅去氧胆酸钠的结合率分别达到了62.64%、66.98%。DPSPY的胆酸盐结合力明显高于PSPY,可能与DPSPY的分子质量较小、硫酸根含量较高有关[18,25]。

图10 PSPY和DPSPY的胆酸盐结合率Fig.10 Cholate-binding rates of PSPY and DPSPY
2.6 PSPY和DPSPY体外免疫活性研究结果
2.6.1 PSPY和DPSPY对RAW264.7细胞增殖活性的影响

图11 PSPY和DPSPY对RAW264.7细胞增殖活性的影响Fig.11 Effects of PSPY and DPSPY on the proliferation of RAW264.7 cells
由图11可知,两种多糖能提高RAW264.7细胞的增殖能力,这与Zhao Ting等[32]的研究结果一致,都存在剂量依赖关系但不是很明显,延长培养时间对促进增殖无较大的影响。相同培养时间、相同质量浓度下,DPSPY促进RAW264.7细胞增殖的能力显著高于PSPY(P<0.05),表示H2O2-VC降解PSPY可提高其促RAW264.7细胞增殖活性。
2.6.2 PSPY和DPSPY对RAW264.7细胞吞噬活性的影响
由图12可知,LPS有较好的促进RAW264.7细胞吞噬中性红的作用,与正常组相比,PSPY和DPSPY处理组RAW264.7细胞的吞噬能力明显提高,且随着培养时间的延长而增强,无剂量依赖关系,这与黄菊青[24]和Zhao Ting[32]等的实验结果相似。有研究表明,细胞吞噬能力的强弱可间接反映免疫活性的高低[33-34],因此,PSPY和DPSPY可以通过提高RAW264.7细胞的吞噬能力从而提高细胞的免疫活性。

图12 PSPY和DPSPY对RAW264.7细胞吞噬中性红活性的影响Fig.12 Effects of PSPY and DPSPY on phagocytosis of RAW264.7 cells
2.6.3 PSPY和DPSPY对RAW264.7细胞分泌NO的影响

图13 PSPY和DPSPY对RAW264.7巨噬细胞分泌NO的影响Fig.13 Effects of PSPY and DPSPY on NO production of RAW264.7 cells
如图1 3 所示,与正常组对比,P S P Y 处理组RAW264.7细胞培养24 h和48 h后分泌的NO量均无明显变化,且不同质量浓度处理组也无显著差异。DPSPY处理组RAW264.7分泌NO的能力随着DPSPY质量浓度的增加而提高。DPSPY处理组组内显著性差异分析结果表明,DPSPY刺激RAW264.7细胞分泌NO的能力呈显著剂量依赖性,表明H2O2-VC降解可以提高PSPY刺激RAW264.7细胞分泌NO的活性。NO是巨噬细胞免疫应答中分泌的炎性介质,是巨噬细胞抵御病原体和杀伤刺激物的重要生物因子[35],NO的分泌水平可以反映巨噬细胞的活化水平,上述研究表明DPSPY可以提升RAW264.7细胞分泌NO的能力,提高细胞杀伤活力。
3 结 论
本实验建立了一种通过H2O2-VC法提高PSPY生物活性的方法。响应面法优化H2O2-VC降解PSPY的条件为:H2O2-VC浓度4.1 mmol/L、温度52.4 ℃、降解时间2.1 h。最佳条件下DPSPY的得率为73.89%。与PSPY相比,DPSPY的总糖、硫酸根质量分数增加,蛋白质量分数降低。FTIR分析结果表明,降解未改变PSPY链上的基团,PSPY和DPSPY的分子质量分别为452 ku和17 ku。PSPY降解后的还原力和DPPH自由基、羟自由基、O2-·清除活性得到明显提高,且清除活性有明显的剂量依赖性,表明PSPY抗氧化能力提高。5 种胆酸盐结合实验中,DPSPY与胆酸盐的结合率均高于PSPY。RAW264.7细胞模型系列实验中,DPSPY对促进细胞增殖、提高细胞吞噬能力和促进细胞分泌NO的活性更强。

