质谱法分析烘焙对花生过敏原Ara h 1潜在致敏性的影响
周红菲,吴志华,张 英,陈红兵
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330031;3.南昌大学中德联合研究院,江西 南昌 330047)
食物过敏被认为是当今社会一个重大的公共卫生问题,受影响的儿童与成年人数量在快速增长[1]。花生作为“八大食物过敏原”之一[2],引发的常见临床过敏症状有哮喘、皮肤瘙痒、过敏性鼻炎及口腔过敏综合症等。这是由于花生过敏原初次被机体摄入后,诱导特异性B细胞产生免疫球蛋白E(immunoglobulin E,IgE)抗体应答[3],使机体处于致敏状态。当处于致敏状态的机体再次接触相同过敏原,会使IgE受体交联引发致敏的肥大细胞或嗜碱性粒细胞活化和脱颗粒,释放生物活性介质,导致毛细血管扩张、血管通透性增加、平滑肌收缩等[4]。
目前已有17 种花生过敏原被世界卫生组织的过敏原命名数据库(http://www.allergen.org/)收录,其中Ara h 1是花生蛋白中含量最高的过敏原,约占花生总蛋白含量的12%~16%[5]。
烘焙作为常见的花生制品加工方式之一,在改善食物感官品质[6]的同时,也会破坏蛋白质的空间结构[7-9]。温度和热处理时间都会影响蛋白质结构的变化程度[10]。有研究表明,当温度在70~80 ℃时,蛋白质的二级结构会发生部分丢失,并伴随着三级结构可逆性地展开;当温度达到90 ℃时,会有新的分子内或分子间作用力形成;当温度接近100 ℃时,蛋白质会发生一定的聚集[10-11]。Hansen等[12]发现经过热处理后,花生过敏原的构象性表位遭到了破坏,从而丧失了90%的免疫反应性。虽然Rao Huan等[13]研究发现,当烘焙温度达到130 ℃并持续5 min时,可使花生蛋白的致敏性迅速降低,但多数研究表明花生蛋白致敏性会增强,因为烘焙后蛋白质的二、三级结构均遭到破坏,且蛋白具有更强的抗消化能力[14]。Moghaddam等[15]的研究同样得出烘焙可以导致花生蛋白致敏性增强的结论,可能是由于烘焙过程中形成了新的过敏原表位。热处理引起的空间结构变化,在破坏原有的过敏原表位或生成新的过敏原表位的同时[16-17],也会暴露更多的酶切位点,从而改变胃肠消化性[18-19]。
本研究通过基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption ionization-time of flight mass spectrometry,MALDI-TOF-MS)技术检测Ara h 1酶解肽段,结合蛋白空间结构模型,分析烘焙对花生过敏原Ara h 1的结构以及潜在致敏性的影响,以期为揭示加工前后蛋白构效关系提供新的思路。
1 材料与方法
1.1 材料与试剂
鲜花生购自江西省南昌市菜市场,将新鲜花生进行带壳烘焙,条件为170 ℃、35 min。之后将花生去壳、去红衣并研磨,利用丙酮脱脂,得到花生脱脂粉。
脲、硫脲、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(3-[(3-cholamidopropyl)dimethylammonio]propanesulfonate,CHAPS)、二硫苏糖醇(DLdithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAM)、碳酸氢铵(NH4HCO3)、乙腈(acetonitrile,ACN)(色谱级,纯度不低于99.9%);三氟乙酸(trifluoroacetic acid,TFA)(色谱级,纯度不低于99%)美国Sigma公司;Trypsin(测序级) 德国Promega公司。
1.2 仪器与设备
PB-10型pH计 德国Sartorius公司;真空离心浓缩仪 美国Labconco公司;BR680型酶标仪、迷你蛋白电泳仪 美国Bio-Rad公司;SQ-GS800光密度扫描仪北京宇艾奇科技有限公司;MALDI-TOF-MS仪 日本Shimadzu公司。
1.3 方法
1.3.1 蛋白质样品的提取
提取液:7 mol/L脲、2 mol/L硫脲、2 g/100 mL CHAPS、1 g/100 mL DTT,用超纯水定容至100 mL,调节pH值至8.8。
花生蛋白的提取:取0.3 g花生脱脂粉,加入15 mL提取液,60 ℃超声波(160 W)提取15 min。之后在20 ℃、9 000 r/min条件下离心20 min,弃去沉淀,用0.45 μm滤膜对上清液进行过滤。最终将蛋白溶液冻存于-20 ℃备用。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳定性分析
采取不连续体系的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析花生脱脂粉提取液中蛋白组分。将蛋白提取液中花生蛋白质量浓度稀释到1 mg/mL,上样量为15 μL。Marker上样量为7 μL,选用质量分数为12%分离胶、4%浓缩胶。设定电泳条件分别为恒流6 mA和12 mA,时间分别为30 min和90 min。电泳结束后,进行剥胶、染色、脱色等工序。采用SQ-GS800光密度扫描仪,对蛋白电泳凝胶进行图象采集和定性分析。
1.3.3 蛋白胶内酶解
从凝胶中切下目的条带,用超纯水冲洗多次。向胶块中加入脱色液(25 mmol/L NH4HCO3-50% ACN(NH4HCO3与50% ACN体积比为1∶1)),漩涡振荡10 min,直至胶块无色透明,吸去脱色液。
在脱色后的胶块中,加入少量100% ACN,于真空浓缩仪中56 ℃干燥约30 min,使胶块完全脱水。再利用100 mmol/L DTT和200 mmol/L IAM对蛋白胶块分别进行还原和烷基化。加入少量25 mmol/L NH4HCO3溶液,漩涡振荡,弃去上清液,再次干燥胶块。干燥好的胶块上加入Trypsin酶液(Trypsin与蛋白质量比为1∶30~1∶50),4 ℃放置1 h使酶液完全被吸收,另补加10 μL NH4HCO3溶液保湿,37 ℃孵育15 h。
收集肽段混合物。在胶块内加入质量分数10% TFA,收集上清液;再向胶块中加入肽段抽提液(含体积分数60% ACN、质量分数0.1% TFA),超声15 min,收集上清液;合并两次上清液,置于4 ℃备用。
1.3.4 质谱分析
先点0.5 μL样品于MALDI靶板上,再取0.5 μL α-氰基-4-羟基肉桂酸基质溶液覆盖其上,待样品与基质形成的共结晶薄膜干燥后进行检测。选择反射模式,每孔采集140 次,MS质量扫描范围:m/z 800~3 000。采用TOF-mix标准品进行外标法校准,校准后进行质谱数据采集。
通过Mascot网页进行在线肽指纹图谱匹配,搜库参数设定:选择UniProt数据库,种属为Other green plants,使用酶为Trypsin,允许2 个漏切位点。质谱数据及图谱处理:MALDI-TOF-MS产生的原始数据及图谱均由Biotech MALDI-MS软件导出,并结合Trypsin理论酶解肽段分子质量确定肽段序列。
2 结果与分析
2.1 SDS-PAGE条带分析结果
通过SDS-PAGE对鲜花生和烘焙花生的蛋白提取液分别进行了组分分析,如图1所示。主要过敏原蛋白Ara h 1位于约64 kDa处,即红色方框标记的条带。与鲜花生相比,烘焙花生样品的各过敏原条带均不同程度变浅,Ara h 1单体含量明显降低,且在大于180 kDa处出现了高聚物,可以看出烘焙明显导致了蛋白质的聚集。烘焙花生样品的泳道中也出现较多的弥散状条带,说明烘焙也可能造成蛋白质分子的降解。
热加工会导致花生蛋白的二级和三级结构的改变,表现出部分结构舒展,甚至还有分子聚集现象[11],从而影响蛋白质的可溶性。Schmitt等[6]的研究也得到了相似结果。本次提取蛋白采用的是高离液序列盐溶液,可以尽可能全面地提取出花生过敏原[20-21]。该提取液中含有的变性剂、还原剂等可以裂解已经聚集的蛋白,恢复蛋白质的可溶性,而烘焙花生的Ara h 1含量仍然显著降低,这可能是由于烘焙的温度较高、时间也较长,导致生成物聚集的程度较高。有研究表明,Ara h 1可以通过美拉德反应形成共价交联的六聚体[22],且烘焙加工后Ara h 1也会与Ara h 6形成交联[23],产生高聚物。

图1 鲜花生与烘焙花生蛋白的SDS-PAGE图Fig.1 SDS-PAGE profile of proteins in raw and roasted peanuts
2.2 MALDI-TOF-MS肽段分析结果
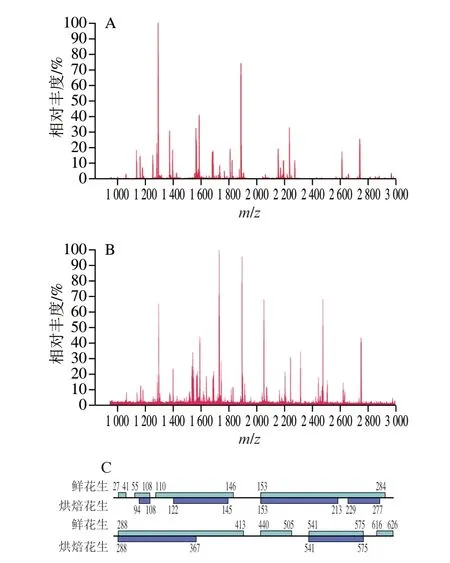
图2 鲜花生与烘焙花生蛋白的质谱图及氨基酸序列覆盖区域Fig.2 Mass spectra and amino acid sequences of proteins in raw and roasted peanuts
对图1中红色方框标记的泳道1和泳道2蛋白条带分别进行质谱鉴定,并搜索Uniprot数据库,均可成功匹配蛋白Ara h 1,蛋白序列登录号为P43238。鲜花生和烘焙花生样品蛋白打分分别为120 分和64 分,可能是烘焙加工造成的酶切肽段变化,致使结果与肽指纹图谱匹配度下降。如图2A、B所示,花生经烘焙后,MALDI-TOF-MS一级图谱中肽段分布情况发生了明显变化。鲜花生和烘焙花生样品中共检测到Ara h 1的71 条肽段,其中鲜花生中检测到70 条肽段,如图2C所示,氨基酸覆盖率达到79.2%。烘焙加工后,仅检测到31 条肽段,较鲜花生新增1 条肽段,缺失40 条肽段,氨基酸覆盖率为43.9%。这可能是由于烘焙使得花生中水分大幅降低[24],蛋白质结构变得紧密,掩盖了部分酶切位点,致使很多原先鲜花生中可检测到的肽段在烘焙样品中出现了缺失。
2.3 烘焙对蛋白质空间结构的影响

表1 鲜花生与烘焙花生肽段差异比较Table 1 Peptide profiles of raw and roasted peanuts

续表1
质谱检出的肽段及其位置差异在一定程度上可以反映花生烘焙前后蛋白质高级结构的变化。如表1所示,在鲜花生和烘焙花生样品中均检测到第67~70号肽段,这4 条肽段覆盖了541IFLAGDKDNVIDQIEKQAKDLAFPGS GEQVEKLIK575氨基酸序列。其胰蛋白酶理论酶切位点有5 个,经质谱只检测到4 个,烘焙花生蛋白保持着和鲜花生相同的酶解方式,没有酶切位点变化。说明这一区域结构较为稳定,烘焙对酶切位点的影响较小。
第56~66号肽段覆盖了两段多肽区域,分别为371Glu-Lys413和440Glu-Lys505。这些肽段在鲜花生均有检出,在烘焙后的花生中则均未检出。可能是由于烘焙使得Ara h 1结构趋于紧实[24],371Glu-Lys413和440Glu-Lys505这两片区域的酶切位点集中被遮挡,形成较大分子质量的多肽,可能已经超出设定的分子质量检测范围。出现与此情况类似的区域还有616Gly-Asn626、27Ser-Arg41和55Gln-Arg91等。
鲜花生中检出了第28号肽段193IIe-Arg202和第30号肽段195Val-Arg204,未检出第29号肽段193IIe-Arg204;而烘焙花生中检出193IIe-Arg204和195Val-Arg204,未检出193IIe-Arg202,说明烘焙改变了蛋白的结构,掩蔽了202Arg与203Ser之间的酶切位点,造成漏切,产生了分子质量较大的酶解肽段。
肽段199FDQRSR204(第31号肽段)在烘焙后的样品中未被检出,则可能是烘焙暴露了更多酶切位点,产生分子质量更小的肽段,如199FDQR202和203SR204等,这些肽段分子质量也在检测范围之外,因而未能检出。

图3 质谱检测发现的Ara h 1胰蛋白酶酶切位点Fig.3 Trypsin cleavage sites of Ara h 1 detected by mass spectrometry
利用Swiss-Model蛋白质结构同源建模服务器,在线构建Ara h 1的空间结构模型(结构模型仅展示171Arg-Arg586氨基酸序列部分)。Ara h 1是属于豌豆球蛋白家族的一类贮藏蛋白[25-26],是由3 个对称的单体非共价结合形成的三聚体结构[18,27]。图3为Ara h 1单体的空间结构,并分别标记出了鲜花生与烘焙花生中被胰蛋白酶识别出的酶切位点(C端)。可以发现,靠近Ara h 1单体C末端的α-螺旋上,酶切位点在烘焙前后未发生变化,说明这一区域的酶切位点没有被掩蔽。主要是因为Ara h 1单体末端α-螺旋上的疏水性残基有助于维持结构稳定[25],烘焙后这一区域结构变化不大,且Ara h 1高度稳定的三聚体结构的形成也正是由疏水相互作用介导。烘焙花生中漏切的酶切位点主要出现在α-螺旋和β-折叠结构的末端和无规卷曲中。烘焙过程中,α-螺旋和β-折叠结构可能遭到了一定程度的破坏[28],尤其是α-螺旋结构发生丢失[29],无规卷曲含量增多,可能使酶切位点被遮挡。烘焙后酶切位点被遮挡,也会对蛋白的消化性造成影响[30]。
2.4 蛋白结构变化对过敏原表位的影响
据报道,Ara h 1已知的过敏原线性表位有21 个[31-33]。质谱检出鲜花生的肽段涉及18 个过敏原线性表位,而烘焙花生中仅检出其中13 个。经过质谱前处理,其中,鲜花生中检出16 个过敏原线性表位被胰蛋白酶酶解,烘焙花生中仅发现12 个。由表1可知,在烘焙花生中发生缺失的过敏原表位肽,主要分布在371Glu-Lys413和440Glu-Lys505区域,由于酶切位点被掩蔽,会形成较大分子质量的多肽。说明在酶解作用下,鲜花生Ara h 1中多达88%的过敏原线性表位均遭到了破坏,烘焙后Ara h 1的部分酶切位点被掩蔽,过敏原线性表位的被破坏程度下降。由图4中的Ara h 1结构模型可以看出,Ara h 1单体结构分为了4 个区域[25],包括一端的α-螺旋结构、两个对称的反平行β-折叠结构、另一端的α-螺旋结构。大部分的Ara h 1的过敏原线性表位均集中分布在Ara h 1单体与单体接触区域。被破坏的过敏原表位与检出的酶切位点所在区域发生重叠。在烘焙之前,过敏原线性表位受到酶解的破坏较为严重,仅小部分过敏原线性表位保存完整性,有10 个过敏原线性表位被破坏。在烘焙后,有7 个过敏原线性表位被破坏,少于鲜花生样品。说明烘焙后,过敏原线性表位被胰蛋白酶酶解破坏的程度降低。在酶解作用下,相比于烘焙前Ara h 1被破坏过敏原线性表位的分布,烘焙后主要集中在Ara h 1单体两端的α-螺旋结构上,较少破坏两个反平行β-折叠区域的过敏原线性表位。说明烘焙可能造成了反平行β-折叠区域的结构紧缩,遮挡了相应的酶切位点,造成消化对过敏原线性表位的破坏程度下降[30],使得Ara h 1潜在致敏性增强。
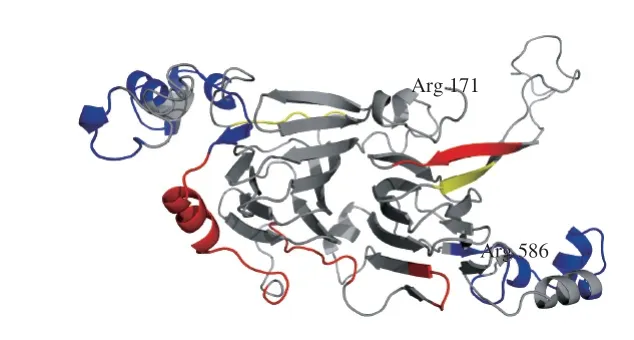
图4 质谱检测发现的Ara h 1过敏原线性表位Fig.4 Linear IgE-binding epitopes of Ara h 1 detected by mass spectrometry
Beyer等[34]研究也发现,较高温度的干热烘焙可以提高花生3 种主要过敏原的致敏性。烘焙过程中,可能会产生众多如伸展、聚集和交联等结构性的改变[35],花生组分之间也会发生反应(如常见的美拉德反应),对花生蛋白产生修饰作用。有研究表明,烘焙后花生全蛋白提取物[14]和纯化的Ara h 1致敏性均会增强[22],可能是由于美拉德反应对蛋白的修饰增强了过敏原表位耐胃肠消化的能力。另外,有研究也发现热加工会改变蛋白质二级与三级结构,不仅会影响对过敏原线性表位的破坏程度,也会对过敏原构象型表位产生掩盖、暴露或破坏等影响[35],从而影响潜在致敏性。因此,烘焙导致的Ara h 1结构变化,使得部分过敏原线性表位未被酶解破坏,可能是烘焙后花生潜在致敏性增强的重要原因之一。
3 结 论
本研究分析了烘焙对花生主要过敏原Ara h 1结构的影响,结果发现烘焙加工后,Ara h 1会发生聚集和降解。结合质谱和空间模型构象,对加工后Ara h 1的高级结构进行了分析,发现烘焙也可以改变Ara h 1的高级结构。高级结构的变化掩盖了部分酶切位点,从而减轻了酶解对过敏原线性表位的破坏程度,这可能导致烘焙加工后Ara h 1致敏性强于鲜花生。

