PAX-2阴离子交换树脂分离测量水泥固化体浸出液中的55Fe
马莉娜,宋丽娟,戴雄新
中国辐射防护研究院,山西 太原 030006

1 实验部分
1.1 试剂及仪器
PAX-2阴离子交换树脂(0.074~0.165 mm,交联度为8%);55Fe标准溶液的比活度为59 kBq/g,美国国家标准技术研究所(NIST);Fe、Ni、Zn、Cr、Co、Mn单元素标准溶液,1 g/L,国家有色金属及电子材料分析测试中心;浓HCl、六水合氯化铁均为市售分析纯。
Hidex-300SL液体闪烁计数器(LSC),芬兰Hidex公司;Prodigy电感耦合原子发射光谱仪(ICP-AES),美国利曼公司;UV-1800分光光度计(UV-vis),上海美谱达;Milli-Q Reference超纯水机系统,美国默克公司;Hisafe闪烁液,美国Perkinelmer公司;XS-204分析天平,精度为0.1 mg,美国梅特勒公司。
1.2 金属离子在PAX-2树脂柱上分配系数的测量
将完全烘干的PAX-2树脂0.27 g用高纯水浸泡后装入高10 cm、内径为0.36 cm的聚乙烯树脂柱。准备8个上述树脂柱,树脂柱分别用5 mL 0.01、0.10、1.00、2.00、4.00、6.00、8.00和10.00 mol/L的HCl预处理。配制混合标准溶液8份,其中Fe、Ni、Zn、Cr、Co、Mn的质量浓度均为25 mg/L,取混合标准溶液20 mL加入预处理的树脂柱,再用20 mL同样浓度HCl淋洗树脂柱,过柱液和淋洗液合并收集后,用ICP-AES测量8组HCl溶液中金属离子浓度。
1.3 分析流程
分析流程示于图1。水泥浸出液样品中加入稳定铁示踪剂后,用NaOH形成氢氧化物共沉淀,富集样品中的55Fe,样品中的Ca2+、Mg2+等金属离子同时与NaOH反应生成M(OH)x,随Fe(OH)3一起沉淀。沉淀用10 mL 10.0 mol/L HCl溶解后,通过PAX-2阴离子交换树脂,分别用20 mL 10.0 mol/L及2 mL 6.0 mol/L HCl淋洗树脂柱,最后用2 mL 0.1 mol/L HCl将Fe3+洗脱至20 mL液闪瓶中。取洗脱液30 μL用紫外分光光度计测量回收率。用液体闪烁计数器测量剩余样品中55Fe活度。

图1 水泥固化体浸出液中55Fe分析流程图Fig.1 Flow diagram of radioanalytical procedure for sequential determination of 55Fe in leaching solution
1.4 样品制备
取2 g水泥固化体样品,加入浓盐酸、浓高氯酸和浓硝酸的混酸(体积比为1∶1∶1),在电热板上160 ℃加热,酸液快蒸干时,补充酸液,持续加热至样品溶解,转移到100 mL容量瓶中,用高纯水定容,再将其稀释15倍,测得pH≈1,待用。称量0.290 4 g FeCl3·6H2O至20 mL PE闪烁瓶中,加入0.1 mol/L HCl配制成3 mg/g的Fe3+溶液,待用。在50 mL离心瓶中加入20 mL水泥浸出液样品,再加入3 mg用FeCl3·H2O配制的稳定Fe3+示踪剂。
1.5 化学分离
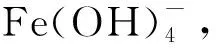
1.5.2化学分离过程 配制4 mol/L的NaOH溶液,取20 mL加入1.4节所述离心瓶中,形成2 mol/L的NaOH体系,产生沉淀,待离心瓶内温度降至室温后,盖上离心瓶盖,用振荡器振荡3 h,保证Fe3+完全沉淀,离心5 min,弃去上清液,加10 mL高纯水洗涤沉淀后,再次离心,弃去上清液。沉淀用10 mL 10.0 mol/L HCl溶解。将完全烘干的PAX-2树脂0.27 g用高纯水浸泡后装入高10 cm、内径为0.36 cm(≈1 mL)的聚乙烯树脂柱。将树脂柱安装在真空箱上,用5 mL 10.0 mol/L HCl预处理。用流速调节阀和真空泵控制样品流速,将离心瓶中的样品以2 mL/min的流速通过树脂柱,再用5 mL 10.0 mol/L HCl洗涤离心瓶,洗液一起通过树脂柱,然后分别用20 mL 10.0 mol/L及2 mL 6.0 mol/L HCl淋洗树脂柱,流速分别控制为1 mL/min及0.5 mL/min,随后用2 mL 0.1 mol/L HCl以1 mL/min的流速将Fe3+洗脱至20 mL液闪瓶中。
1.6 稳定Fe回收率的测定
配制400 μg/g的Fe标准溶液,取75、100、175、250、325、400 μL上述Fe标准溶液,分别加入30 μL 2.0 mol/L HCl、20 mL高纯水和0.2 mL 20%(m/V)的硫氰化钾溶液,摇晃均匀,放置15 min后,用紫外分光光度计在485 nm测量其吸光度,绘制标准曲线示于图2。从树脂柱上洗脱出的实际样品中取30 μL加入20 mL液闪瓶中,然后加入30 μL 2.0 mol/L HCl、20 mL高纯水和0.2 mL 20%的硫氰化钾溶液,在485 nm测量Fe的吸光度(A),根据标准曲线计算Fe的化学回收率。
影响立体仓库稳定的主要因素是货架重心高度,两端式同轨双车运行模式较单台堆垛机独立作业模式在货架形式上相差不大,采用式(8)描述的上轻下重原则,目标函数可有效降低货架重心,提升结构稳定性。

λ=485 nm图2 UV-Vis测量Fe标准溶液的标准曲线Fig.2 Standard curve of Fe standard solution by UV-Vis
1.7 液闪测量55Fe
55Fe洗脱液与闪烁液混合后由液体闪烁计数器测量55Fe的活度。样品中Fe3+会引起颜色淬灭导致测量效率极低。因此,样品中加入0.6 mL浓磷酸、4 mL高纯水,抑制颜色淬灭。然后加入14 mL Hisafe闪烁液混合均匀,在暗处放置20 h,等待化学发光最小时,每个样品测量1 h。LSC测量55Fe时选择的分析窗口为20~250道,淬灭校正曲线由式(1)、(2)[4]计算得到。
ε(55Fe)=1.53×TDCR0.91
(1)
(2)
式中:ε为55Fe的液闪测量效率;TDCR,两管、三管符合比;Ti为样品的三管符合计数;T0为空白样品的三管符合计数;Di为样品的双管符合计数;D0为空白样品的双管符合计数。
1.8 干扰元素的去污效果
为测定潜在干扰元素的去污因子,在20 mL的高纯水中加入3 mg Fe3+,0.05 mg稳定Ni、Co、Mn、Zn、Cr 1 g/L的标准溶液,按照1.3节所示流程用PAX-2树脂分离纯化。用电感耦合等离子发射光谱(ICP-AES)测量纯化后样品中各元素的浓度。
2 结果与讨论
2.1 PAX-2阴离子交换树脂对55Fe分离条件的确定
2.1.1金属离子在PAX-2树脂柱上的分配系数 根据金属离子在不同浓度HCl中通过PAX-2树脂柱达到平衡状态时树脂相和液相中金属离子的分配情况,可选择55Fe的最优分离条件。表示树脂柱上离子平衡状态的参数很多,用不同酸度时金属离子在PAX-2阴离子交换树脂上的分配系数Kd值[5-6]描述不同浓度离子交换树脂中离子平衡时的状态,Kd的计算如式(3)。
(3)
式中:cr为树脂中金属离子浓度,mol/L;cs为HCl溶液中金属离子浓度,mol/L;c0为加入树脂中的初始金属离子浓度,mol/L。 PAX-2树脂柱上金属离子在不同浓度HCl中的lgKd值示于图3。由图3可知:PAX-2阴离子树脂在8.00、10.00 mol/L HCl条件下对Fe3+的选择吸附性能很强,这是由于在8.00、10.00 mol/L的HCl中,Fe3+形成的络阴离子更稳定,且在PAX-2树脂上的吸附能力强。Ni2+、Mn2+在HCl溶液中不会形成络阴离子,Cr3+、Co2+、Zn2+与Cl-形成的络阴离子[10]在PAX-2树脂柱上吸附能力弱,因此,Ni2+、Cr3+、Co2+、Mn2+、Zn2+在高浓度HCl条件下很容易被淋洗,此性质有利于分离纯化55Fe。由图3还可看出,国产PAX-2阴离子交换树脂适用于55Fe的分离纯化,相对于进口树脂,采用国产树脂可大大降低分析成本,并打破国外对放化分析核心材料的垄断。

■——Fe3+,●——Co2+,▲——Ni2+,▼——Mn2+,◆——Zn2+,◀——Cr3+图3 PAX-2树脂柱上金属离子在不同浓度HCl中的lg Kd值Fig.3 lg Kd values of metal elements on PAX-2 resin column in different concentrations of HCl
2.1.255Fe在PAX-2树脂柱上的分离条件 选取10 mL 10.0 mol/L HCl溶解1.5.1节所制备的NaOH共沉淀的样品,上柱,样品流经树脂柱时,Fe3+与Cl-形成的络合物被保留在树脂柱上,不能与Cl-形成络阴离子的干扰离子Ni2+、Mn2+随液相流出。再用25 mL 10.0 mol/L HCl淋洗树脂柱,将在树脂柱上吸附能力较弱的Co2+、Zn2+、Cr3+与Cl-形成的络阴离子分离,再用2 mL 0.1 mol/L的HCl洗脱55Fe。得到55Fe的平均化学回收率为68%。样品上柱后,先用25 mL 10.0 mol/L HCl淋洗树脂柱后,再用2 mL 6.0 mol/L HCl 淋洗树脂柱,最后用2 mL 0.1 mol/L的HCl洗脱55Fe。测得55Fe的平均化学回收率为75%。这是由于在10.0 mol/L HCl中,Fe3+与Cl-形成的络阴离子在树脂柱上的吸附能力很强,导致用0.1 mol/L的HCl不能有效洗脱,化学回收率较低。用10.0 mol/L HCl 淋洗后再用2 mL 6.0 mol/L HCl 淋洗,络阴离子在6.0 mol/L HCl中在阴离子树脂上的吸附能力较弱,再用0.1 mol/L 的HCl更容易从树脂上洗脱55Fe,从而提高了55Fe的化学回收率。水泥浸出液样品(样品编号S1、S2)及空白样品(样品编号B1、B2)中55Fe的测量结果列入表1。由表1可看出,空白样品与实际样品中55Fe的回收率一致,均可达到75%以上。用PAX-2阴离子树脂分离纯化后,分析流程对干扰元素的去污程度很高,Ni、Mn、Cr的去污因子高于10 000,Co和Zn的去污因子分别可达769和629。
2.2 方法探测下限
本方法测量了两个空白样品和两个水泥浸出液样品,空白样品即高纯水中加入稳定Fe示踪剂,按照建立的流程分离纯化后分析55Fe回收率。根据式(4)计算得到该法的探测下限(MDC)[11],测量及计算结果列入表1。

表1 水泥浸出液样品及空白样品中55Fe的测量结果Table 1 Results of 55Fe in leaching solution samples and blank samples
(4)
式中:k=1.645(置信度为95%);B为液闪测量时空白样品的ROI空数;t为测量时间,s;R为55Fe的化学回收率;f为用于液闪测量的样品份额;ε为55Fe用液闪测量时的测量效率;m为浸出液样品质量,g。
由计算可得,该流程对水泥浸出液的探测下限为0.018 Bq/g,能够达到水泥浸出液的测量要求。
2.3 加标样品的测量
为验证方法的准确性,准备5个水泥浸出液样品分别标记已知活度的标准55Fe溶液,样品中标准55Fe的比活度分别为16.8、21.9、28.3、33.9、39.2 Bq/g,样品采用1.3节所示流程分离测量,测量结果示于图4。图4中直线y=x代表标记样品理论值(atheory(55Fe))与测量值(adet(55Fe))完全一致的状况。由图4可知:测量值与理论值的偏差在±3%以内,证明本方法准确可靠。图4中的x误差棒为样品中标记的55Fe标准溶液的系统误差,主要来源于55Fe标准溶液证书中所示误差,y误差棒为样品测量的系统误差,由放射性核素单次测量误差公式及误差传递公式计算得到[12]。
2.4 样品处理量和测量的周期
对于一组8个样品,NaOH与稳定Fe示踪剂形成沉淀浓集样品中55Fe,耗时3.5 h;55Fe在阴离子交换树脂柱上与干扰元素分离,耗时1.5 h;测量回收率,耗时0.5 h;液闪测量活度前,添加闪烁液后,需在暗处放置20 h除去化学发光;每个样品的LSC测量需1 h。综上,一组8个样品分析测量共计需时34 h。

图4 水泥浸出液样品标记55Fe理论值与测量值对比Fig.4 Comparison of expected and measured 55Fe activities in spiked leaching solution
3 结 论
通过测量PAX-2树脂吸附不同金属的Kd值及进行淋洗条件优化,确定了树脂分离55Fe的最优条件。在样品中加入已知活度的55Fe溶液,通过测量值与理论值的对比,验证了该法的可靠性。开发了55Fe测量流程,可用国产树脂替代55Fe放化分离流程中必须使用的进口阴离子交换树脂,降低了测量成本。采用该法测量水泥浸出液,平均化学回收率为76%±2%,MDC等于0.018 Bq/g。本流程也适用于其他含55Fe的液态样品的分离测量。

