新疆某规模化养殖场7、14日龄腹泻羔羊粪源非O157致病性STEC菌毒力基因分布调查
吾买尔江·牙合甫,王晓杰,古莱姆拜尔·谢日普,阿丽米热·买买提,韩俊成,杨 莉,罗金生,买吾兰·孜克牙
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐830052;2.新疆哈密市畜牧工作站,新疆 哈密839000;3.哈密动物疫病预防控制中心,新疆 哈密839000)
羔羊大肠杆菌病的病原为致病性大肠杆菌,产志贺毒 素大肠杆菌(shiga-like toxigenicE.Coli,STEC)引起的腹泻病较严重,传染源主要来自病羊和带菌羊。传染途径包括经带菌母畜哺乳或使用被污染的饲养器皿引起消化道感染,临床表现为肠炎型和败血型,也可继发肺炎、脑膜炎、关节炎及肾炎等疾病[1]。STEC是一种高致病性人畜共患病原微生物。虽然多数猪、牛、羊等养殖场发生的群体性致病菌传播STEC普遍以血清型O157∶H7为主爆发,但非O157 STEC食源污染事件正日益增多,且病例持续呈上升[1-2]。据报道,2000~2010年非O157 STEC发病率从0.12/10万增加到0.95/10万[3]。牛为STEC贮存宿主,携带率达71%以上,STEC对反刍动物的高危害性引起世界广泛关注[4]。志贺毒素是STEC主要的毒力基因,毒力因子包括stx1和stx2,stx1能引起腹泻但不表现全身系统感染症状;stx2是致病性大肠杆菌发挥致病性主要的毒力因子,其更容易引起溶血性尿毒综合征、出血性肠炎、血小板减少性紫癜、神经系统病变等疾病。毒素感染肾脏内皮细胞、肾小球和肾小动脉,导致病变[5-6]。与志贺毒素致病性相关的EHEC溶血素hylA基因,则主要引起肠外疾病,造成宿主多种细胞的细胞膜结构损伤,诱导促进炎症细胞因子的释放。吸附和抹杀基因(eae)编码的紧密黏附素可导致人肠上皮细胞产生黏附、抹平损伤,在致病过程中发挥重要作用[7]。
本试验选取新疆某地区规模化肉羊养殖场7、14日龄腹泻羊羔为研究对象,分析随日龄增加受致病菌感染程度,利用实验室分析技术筛查非O157 STEC相关stx1、stx2、eae、hlyA毒力基因,致力于提高羔羊成活率,为地方养殖户控制和预防致病性大肠杆菌病提供参考。
1 材料与方法
1.1 试验仪器与试剂
试验仪器:T100梯度PCR仪(美国BIO-RAD)、凝胶成像仪系统(美国BIO-RAD)、高速离心机(德国Eppendorf)、DYY-6C型电泳仪(北京六一仪器厂)、电子天平(梅特勒-托利多仪器有限公司)、电热恒温培养箱(上海一恒科学仪器有限公司)等。
试验试剂:LB肉汤、麦康凯、伊红美蓝等培养基购自奥博星生物技术有限公司;Taq Master Mix、DNA Marker 2000、琼脂糖、EZ-Vision DNA染料购自天根生物有限公司;菌株O157∶H7 CICC21530标准菌株由新疆农业大学动物医学学院苏占强副教授提供。
1.2 试验方法
采集新疆某区规模化肉羊养殖7、14日龄腹泻症状羔羊肛拭子新鲜粪便45份,4℃冷藏带回实验室。采用麦康凯、伊红美蓝培养基增菌培养发分离鉴定,另备一份采用TE Buffer缓冲液菌体裂解法制作DNA模板。引物序列和目的片段见表1,由上海生物工程有限公司合成。

表1 PCR引物序列和目的片段Tab.1 PCR primer sequence and product length
1.3 PCR反应条件
16S rDNA扩增条件:PCR反应体系共25.0μL。Taq MasterMix12.5μL、引物1.0μL、细菌DNA模板1.0μL、ddH2O 9.5μL。PCR反应参数:94℃预变性5 min;94℃变性15 s,54℃退火1 min,72℃延伸2 min,共35个循环;72℃延伸10 min,1.0%琼脂糖照胶分析[8]。
stx1、stx2、eae扩增条件:PCR反应体系共25.0μL。Taq MasterMix10.0μL、引 物0.4μL、细 菌DNA模 板1.0μL、ddH2O 13.2μL。PCR反应参数:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共34个循环;72℃延伸10 min,1.0%琼脂糖照胶分析[9]。
hlyA扩 展 条 件:PCR反 应 体 系 共25.0μL。Taq MasterMix12.5μL、引 物0.5μL、细 菌DNA模 板1.0μL、ddH2O 10.5μL。PCR反应参数:94℃预变性10 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,共30循环;72℃延伸3 min,1.5%琼脂糖照胶分析[10]。
rfbE、fliC扩 增 条 件:PCR反 应 体 系 共25.0μL。Taq MasterMix12.5μL、引 物1.0μL、细 菌DNA模 板1.0μL、ddH2O 9.5μL。rfbEPCR反应参数:95℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸45 s,共30个循环;72℃延伸10 min。fliCPCR反应参数:95℃预变性5 min;94℃变性30 s,58℃退火45 s,72℃延伸45 s,共30个循环;72℃延伸10 min,1.5%琼脂糖照胶分析[11]。
1.4 数据统计与分析
使用SPSS 19.0的Pearson's卡方检验对STEC阳性率进行统计分析。
2 结果与分析
2.1 分子生物学鉴定结果(见图1)
本试验对腹泻症状羔羊采集的45份粪便样品采用生化方法筛查,PCR方法进行大肠杆菌分离(16S rRNA)。
由图1可知,扩增16S rRNA(1 439 bp)目的基因条带,符合预期大小。最终腹泻症状羔羊粪便样品共分离大肠菌株40份,阳性率88.90%。

图1 16S rRNA的检测Fig.1 Detection of 16S rRNA
2.2 编码毒力基因stx1、stx2、eae、hlyA检测结果(见图2、图3)
由图2、图3可知,采用标准株大肠埃希菌CICC21530作为阳性模板进行毒力基因检测鉴定,扩增出目的条带stx1(655 bp)、stx2(477 bp)、hlyA(526 bp),未扩增出eae毒力基因。
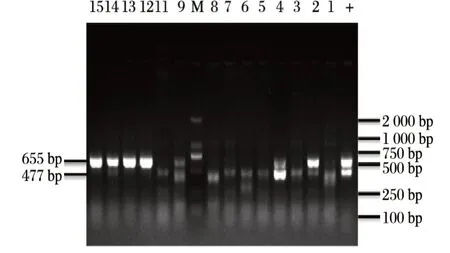
图2 编码毒力基因stx1、stx2扩增结果Fig.2 PCR test results of stx1、stx2 virulence genes
图3 编码毒力基因hlyA扩增结果Fig.3 PCR test results of hlyA virulence genes
2.3 新疆某羊养殖场7、14日龄羔羊STEC毒力基因结果(见表2)

表2 新疆某羊养殖场7、14日龄羔羊STEC毒力基因结果Tab.2 STEC virulence gene results of 7 and 14-day-old lambs in a sheep farm in Xinjiang 单位:%
本试验共分离到大肠菌株40株,其中7日龄17株,14日龄23株。由表2可知,7、14日龄羔羊粪源阳性菌株分离编码毒力基因stx1、stx2、hlyA分离较高(30.00%),其中扩增出编码毒力基因stx2和stx2+hlyA各3株(7.50%),编码毒力基因stx1、stx1+stx2、stx1+hlyA各2株(5.00%)。不同日龄腹泻羔羊分析,7日龄腹泻羔羊大肠菌株编码毒力基因阳性率较低,检出编码毒力基因stx1、stx2和stx1+hlyA各1株(5.88%),未检测出stx1+stx2、stx2+hlyA。14日龄腹泻羔羊大肠菌株均扩增出编码毒力基因,结果分析阳性率较低,其中stx2+hlyA编码毒力基因阳性率为13.04%,其次stx2、stx1+stx2编码毒力基因阳性率为8.70%。
2.4 O157鉴定结果(见图4)
由图4可知,对分离鉴定的编码毒力基因stx1和stx2的40株大肠杆菌进行O157(rfbE)、H7(fliC)鉴定发现,扩增出9株H7(fliC)非特异性目的条带,未扩增出O157特异性目的条带,视为非O157产志贺毒素大肠杆菌。

图4 O157鉴定结果Fig.4 Results of O157 identification
3 讨论
肠杆菌源致病菌以STEC O157∶H7为主,可通过食物传播[12]。STEC产生的产志贺毒素(STX)与人畜共患传染病相关,主要毒力因子包括志贺毒素stx1、stx2[13]。据报道,STEC O157∶H7是主要的爆发血清型[14]。研究表明,STEC非O157血清型同样可引起人畜共患传染病的传播[15]。牛、羊、骆驼等反刍动物是STEC的天然宿主,STEC可在牛、羊的浆液中存活较长时间,并产生stx,牛消化系统缺乏志贺毒素受体,因此牛不会表现出相应疾病症状,携带病原菌的牛的排泄物可通过水源、土壤、饲草料等传播[16-17]。STEC感染可导致人或家畜危及生命的并发症,如HC和HUS。0.3%~9.9%牛的粪便中可检测出STEC,在绵羊肉、粪便中也可检测出STEC[18-19]。羊养殖场STEC检出率为37.3%,stx以stx1为主,stx检出率达65.2%[20]。巴西绵羊粪源STECstx1、stx2、ehxA检出率87.7%[21]。本试验中,7、14日龄段腹泻羔羊阳性菌株(40份)中检测到非O157 STEC菌株(30.00%),其中stx2和stx2+hlyA阳性率较高(7.50%),表明STEC在羔羊幼龄时期定植,新生羔羊可能是STEC感染人类的潜在性重要宿主[22],推测该致病菌感染源来自母乳和乳房表皮。本试验采纳张妍等[23]报道的肉牛屠宰环节中非O157鉴定方法,共分离出40株编码毒力基因stx1和stx2,未扩增出O157(rfbE)特异性目的条带,因此视为非O157产志贺毒素大肠杆菌。巴西南部绵羊群50%STEC的试验动物中分离出阳性菌,并感染全部养殖场[18]。不同国家的绵羊养殖场STEC感染率普遍较高[24]。本研究分离株中stx2、hlyA编码毒力基因占主导地位。目前,stx亚型stx2a、stx2c、stx2d更易引起人类感染。报道显示,携带Stx2b的STEC与溶血性尿毒综合征散发病例存在关联性[25]。本研究未对stx亚型基因进行扩增分析,无法推断其亚型表达情况。hylA毒力基因诱导促进炎症细胞因子的产生,是反刍动物源STEC常见基因之一。本试验未扩增出编码毒力基因eae,数据结果与前期研究者一致[18,22]。eae毒力基因的存在与致病强度直接相关,但不能断定存在高致病性风险。Bekal等[26]报道,羊源eae菌株与人类的HC和HUS有关。相关研究显示,363样品中eae阳性率为9.92%,羊尸体阳性率为18.9%。eae基因存在于肠道致病性大肠杆菌中[27]。鉴定EPEC必须检测eae基因是否呈阳性[28]。本研究从7、14日龄腹泻羔羊粪便中分离出编码毒力基因stx1、stx2和hlyA,随羔羊日龄增长其阳性检出率增高(17.65%至39.13%)。目前,预防STEC仍需提高饲养管理水平,采取灌服巴氏消毒处理的母乳。免疫力较强的羔羊在育肥、屠宰加工过程中也可能通过各种方式感染,STEC污染达40%[29]。因此,饲养人员、羊毛交易商的健康也存在风险[25,28]。为预防STEC扩散,病死羔羊应无害化处理,少病原微生物交叉污染[30]。本研究不足以确定非O157 STEC在7~14日龄段腹泻羔羊中的患病率,因此增加检测样本的数量和规模,获得更全面的数据,对于分析养殖动物非O157 STEC感染的趋势更有利。
4 结论
7、14日龄腹泻羔羊源大肠杆菌中分离出stx1、stx2、hlyA相关编码毒力基因12株,其中编码毒力基因stx2和stx2+hlyA各3株,stx1、stx1+stx2、stx1+hlyA各2株,不同编码毒力基因、不同日龄羔羊阳性率差异不大。

