皱皮木瓜腐败微生物的分离鉴定
黄 荣,王晓丽,王兆升,*,李 游,方双杰
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.山东农业工程学院食品科学与工程学院,山东 济南 250100)
皱皮木瓜(Chaenomeles speciosa(Sweet) Nakai),多年生落叶小乔木,蔷薇科木瓜属植物,是我国南北方普遍种植的具有观赏价值的果树资源[1],主要分布于山东、安徽、甘肃、重庆、云南、浙江等省[2]。其果实含有丰富的营养及功能成分,如碳水化合物、蛋白质、VC、胡萝卜素、矿物质、多糖、酚类化合物、黄酮、齐墩果酸、熊果酸、皂甙和有机酸等,药食兼用。据报道,皱皮木瓜中的酚类化合物、黄酮等具有消炎、抑菌、抗氧化和抗肿瘤的作用[3]。齐墩果酸和熊果酸具有抗肿瘤[4]、抗炎、抗高脂血症[5]和抑制α-葡萄糖苷酶[6]的作用。鉴于皱皮木瓜较高的食用和药用价值,其深受消费者青睐。但皱皮木瓜存在采后极易受到微生物侵染而腐败变质的问题,极大地制约了皱皮木瓜产业的发展。
引起果实腐败的微生物主要是细菌和真菌。腐败微生物入侵果实主要通过代谢产生果胶酶、纤维素酶等细胞壁降解酶来降解果实中的多糖、纤维素、半纤维素和果胶,将上述物质分解成水和其他微生物所需的成分[7],果实细胞中的营养物质流出,进而被微生物所利用,致使果实腐败变质。常见的果实腐败微生物有欧氏杆菌(Erwinia carotovora)、芽孢杆菌(Bacillus)、灰葡萄孢菌(B.cinerea)、黑根霉(Rhizopus nigricans)、黑曲霉(Aspergillus niger)[8]、皮落青霉(Penicillium crustosum)、链格孢菌(Alternaria alternata)、粉红聚端孢(Trichoderma roseum)[9]、爪甲曲霉(Aspergillus unguis)[10]、青霉(Penicillium)、镰孢霉菌(Fusarium)[11]等,种类繁多,而且不同果实的致腐微生物种类差别也很大。目前关于皱皮木瓜致腐微生物的研究鲜有报道,因此有必要对导致皱皮木瓜腐败的微生物进行分离鉴定,以便根据致腐微生物的特性进行针对性抑制。
本研究以皱皮木瓜为原料,采用组织分离法对皱皮木瓜的致腐微生物进行分离纯化,观察其菌落形态,采用形态学和分子生物学等方法对其进行鉴定,旨在明确皱皮木瓜中腐败微生物菌群,以期为皱皮木瓜贮藏过程中的腐败控制提供理论支持。
1 材料与方法
1.1 材料与试剂
皱皮木瓜采摘自山东省临沂市沂州木瓜研究所,成熟度、大小相近,无病害、无机械损伤。霉菌培养采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、细菌培养采用营养琼脂(nutrient agar,NA)培养基和营养肉汤(nutrient broth,NB)培养基,酵母菌培养采用酵母提取物蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)培养基。
细菌基因组DNA提取试剂盒(DP302) 天根生化科技有限公司;真菌DNA提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒北京全式金生物技术有限公司;扩增引物 上海华大基因有限公司;微生物培养基所需材料 北京索莱宝科技有限公司。
1.2 仪器与设备
XFS-280A手提式压力蒸汽灭菌锅 浙江新丰医疗器械有限公司;SW-CJ-1CU超净工作台 苏州安泰空气技术有限公司;电热恒温培养箱 上海跃进医疗器械一厂;CX31生物显微镜 日本奥林巴斯公司;琼脂糖凝胶电泳、PCR仪 伯乐生命医学产品上海有限公司。
1.3 方法
1.3.1 腐败微生物的分离纯化
挑选无病虫害、无机械伤、成熟度一致的果实,表面用清水清洗后立即放入二氧化氯溶液中消毒1 min,并用无菌水冲洗,晾干,将其在4 ℃恒温环境进行贮藏。待皱皮木瓜果实表面出现深褐色斑点时,切取健康部位和病变部位的交界处组织25 g放置于75%乙醇溶液中浸泡30 s,取出后,用无菌水反复冲洗3 次,然后用灭菌纱布吸干组织块。将上述组织块放入装有225 mL无菌水的三角瓶中,置于恒温水浴振荡器中振荡1 h,使微生物细胞充分分散均匀,制成木瓜悬浮液。将木瓜悬浮液依次稀释为10-1、10-2、10-3、10-4、10-5。分别吸取不同稀释度的木瓜悬浮液0.1 mL于PDA、NA、YPD培养基,涂布均匀,每个稀释度涂布3 个平板。将PDA、YPD于28 ℃恒温培养箱中培养3~5 d,NA于37 ℃培养箱中培养1~2 d。待培养结束后,根据菌落形态、颜色、大小的不同,挑取各个平板上不同的菌落进行划线分离,直至得到纯培养物[12]。对于PDA平板上菌落,采用点植法进行进一步纯化培养,重复培养3 代。将分离得到的纯菌于4 ℃冰箱中保存备用。
1.3.2 回接实验
将新鲜、健康的皱皮木瓜表面清洗,然后立即放入二氧化氯溶液中消毒1 min,用无菌水冲洗,晾干。于无菌操作间,用打孔器在新鲜皱皮木瓜腰部对称打出若干小孔。在打孔处分别接入20 μL所筛选的病原菌悬浮液,以无菌生理盐水作为对照。为避免其他杂菌污染,将接种病原菌的皱皮木瓜用保鲜膜包裹。将上述木瓜放置于28 ℃恒温环境中,观察贮藏过程中组织变化和发病情况,根据腐败情况最终确定该菌是否为主要致病菌[13]。从回接后腐烂的组织上再次分离纯化,判断是否与最初纯化的菌种一致。
1.3.3 皱皮木瓜腐败微生物的鉴定
1.3.3.1 细菌鉴定
将从皱皮木瓜贮藏初期分离纯化后的细菌菌株在NA培养基上划线培养1~2 d后,观察菌株的菌落形态,包括菌落大小、形状、颜色、透明度、边缘结构、表面光滑度、菌落隆起形状、表面状态等,将观察到的菌落形态与标准菌株相比较,参照文献[14]进行形态学鉴定。同时,参照文献[14]对所分离的细菌菌株的生理生化特性进行鉴定,主要包括过氧化氢酶活性实验、淀粉水解实验、葡萄糖水解实验、阿拉伯糖水解实验、木糖水解实验、甘露醇水解实验、V-P实验、NaCl耐受性实验等。
挑取细菌平板上的单菌落,接种于N B 培养基中,37 ℃摇床培养12 h。取2 mL菌液10 000×g离心1 min后弃去上清液,按照天根公司的细菌基因组DNA提取试剂盒说明书提取2 株细菌的基因组DNA。采用扩增细菌的16S rDNA通用引物,前引物为63F(5’-AGAGTTTGATCCTGGCTCAG-3’)、后引物为1387R(5’-CCCGGGATCCAAGCTTAAG-3’)扩增目标细菌的16S rDNA,引物由北京六合华大科技有限公司合成。PCR扩增体系(50 μL)为:模板DNA 3 μL,5×Buffer(含Mg2+)10 μL,dNTP(各2.5 mmol/L)4 μL,10 μmol/L 27 F和1492 R引物各1 μL,酶1 μL,ddH2O 30 μL。PCR程序为:95 ℃预变性2 min;95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸1 min,循环30 次;72 ℃修复延伸5 min,4 ℃终止反应。PCR产物经1%琼脂糖凝胶电泳,用凝胶成像系统观察电泳条带,确定有无目的性条带出现。然后将PCR产物寄往生工生物工程(上海)股份有限公司测序,PCR产物用PCR引物直接测序。测序完成后,将得到的序列在NCBI的GenBank中进行BLAST分析,并进行多序列比对分析,选取序列相似性较高的标准菌株的基因序列,使用MEGA 7.0软件进行系统发育分析,采用邻接法构建系统发育树。
1.3.3.2 霉菌鉴定
将分离纯化后的霉菌菌株接种于PDA平板培养基上,28 ℃培养箱中培养6~7 d,制备显微镜载玻片。观察并记录菌落形态,包括菌落形状、大小、生长速度、菌落正反面颜色、菌丝颜色及形状、可溶性色素、渗出物的颜色等,参考文献[15-16]进行形态学鉴定。
将霉菌接种于PDA培养基上,28 ℃培养6~7 d,从培养基上刮取新鲜菌丝,采用CTAB法进行霉菌总DNA的提取。霉菌采用真菌ITS通用引物(ITS1:5’-T C C G TA G G T G A A C C T G C G G-3’和I T S 4:5’-TCCTCCGCTTATTGATATGC-3’)扩增ITS区的rDNA序列。反应体系50 μL(2×PCR Master Mix 25 μL,10 μmol/L引物ITS1和ITS4各2.0 μL,模板DNA 2 μL,ddH2O补足50 μL)。PCR程序:95 ℃预变性3 min;95 ℃变性30 s,58 ℃复性30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳,用凝胶成像系统观察电泳条带,确定有无目的性条带出现。然后将PCR产物寄往生工生物工程(上海)股份有限公司测序。测序完成后,将得到的序列在NCBI的GenBank中进行BLAST分析,并进行多序列比对分析,选取序列相似性较高的标准菌株的基因序列,使用MEGA 7.0软件进行系统发育分析,采用邻接法构建系统发育树。
2 结果与分析
2.1 回接实验结果
从腐败的皱皮木瓜中初步分离纯化出2 株细菌、6 株霉菌,没有分离出酵母菌。将分离出的菌株编号,分别为细菌(细菌X1、细菌X2)和霉菌(霉菌M1、霉菌M2、霉菌M3、霉菌M4、霉菌M5、霉菌M6),并将这8 株菌种回接到新鲜、健康并经过清洗消毒的皱皮木瓜表面,结果如图1所示。
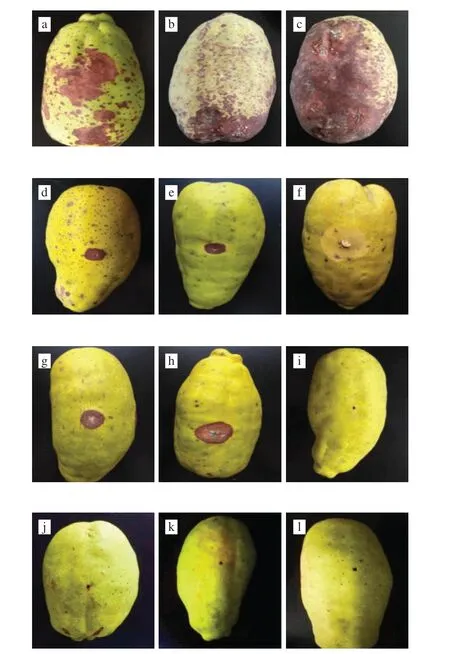
图1 皱皮木瓜病原菌回接实验结果Fig.1 Back inoculation of pathogenic microbes from C.speciosa
由图1可以看出,细菌X1和X2回接到健康的皱皮木瓜表皮后,表面出现褐色斑点。斑点最初为浅褐色,后期变为深褐色,并逐渐向四周扩展,皱皮木瓜变软。霉菌M1回接到皱皮木瓜表皮后,接种部位长出白色菌丝,病健交界部位为浅黄色,出现腐败现象,有很强的霉味。霉菌M2回接到皱皮木瓜表皮后发病,初期出现淡褐色圆形斑点,后变成深褐色,并逐渐向外扩展,变软腐败,具有腐败的气味。霉菌M3回接到皱皮木瓜表面后,表面先出现浅褐色斑点,随着贮藏时间的延长,逐渐变为深褐色,中心出现青绿色霉层。霉菌M4、霉菌M5和霉菌M6回接后,针刺部位失水变硬,出现褐色,并没有表现出霉变现象。将回接后皱皮木瓜腐败的部位重新进行微生物的分离,分离纯化后的菌株均与所接种菌株一致。由此可以确定,细菌X1、细菌X2和霉菌M1、霉菌M2、霉菌M3是引起皱皮木瓜腐败的微生物。
2.2 腐败微生物鉴定结果
2.2.1 细菌X1鉴定结果
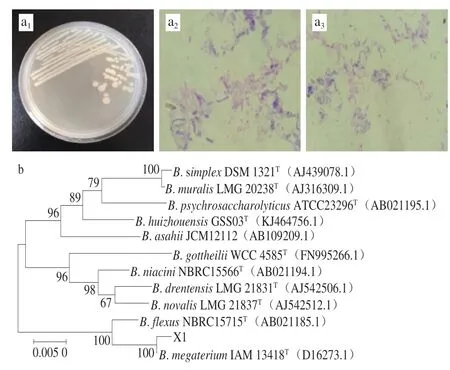
图2 细菌X1鉴定结果Fig.2 Identification of bacterial strain X1
由图2a可以看出,细菌X1菌落呈现乳白色,表面光滑、湿润、有光泽,呈圆形,中间凸起,不扩展,易挑取。在光学显微镜下,细菌呈现长杆状,单个成对或呈短链状排列,能形成芽孢。生理生化鉴定结果表明,细菌X1能水解淀粉,V-P实验呈阳性,过氧化氢酶实验呈阳性,能利用葡萄糖、阿拉伯糖、木糖、甘露醇,对NaCl的耐受性为7%。根据X1的菌落形态及生理生化检验结果,可初步确定细菌X1为芽孢杆菌属。
通过16S rDNA通用引物扩增细菌X1菌株的16S rDNA序列,将PCR产物进行测序。将测得的序列上传至NCBI基因库中,与已登录的该属其他标准菌株序列进行多重比对分析。由图2b可知,细菌X1与弯曲芽孢杆菌(B.flexus)遗传距离较近,与巨大芽孢杆菌(B.megaterium)遗传距离最近。其菌落形态和生理生化反应结果也与B.megaterium相符,因此,可以确定细菌X1为B.megaterium。
2.2.2 细菌X2鉴定结果

图3 细菌X2鉴定结果Fig.3 Identification of bacterial strain X2
由图3a可以看出,细菌X2菌落不规则,乳白色至奶油色不透明,表面褶皱偏湿润,中央扁平,边缘呈放射状,无晕环,杆状,单生或短链状。细菌X2的生理生化鉴定结果表明:能水解淀粉,V-P实验呈阳性,过氧化氢酶实验呈阳性,能利用葡萄糖、阿拉伯糖、木糖、甘露醇,对NaCl的耐受性为7%。X2的菌落形态及生理生化检验结果与芽孢杆菌属细菌一致,可初步确定细菌X2为芽孢杆菌属。
通过16S rDNA通用引物扩增细菌X2菌株的16S rDNA序列,将PCR产物进行测序。将测得的序列上传至NCBI基因库中,与已登录的该属的其他标准菌株序列进行BLAST分析并构建系统发育树。由图3b可知,细菌X2与假蕈状芽孢杆菌(B.pseudomycoides)亲缘关系最近。其菌落形态和生理生化反应结果也与B.pseudomycoides相符,因此鉴定细菌X2为B.pseudomycoides。
Bacillus细菌也会引起其他果蔬的腐败,嗜气芽孢杆菌(B.aerophilus)和类芽孢杆菌(P.agaridevorans)是腐败杨梅的主要病原菌[17]。此外,Bacillus在腐败的生菜[18]、胡萝卜、黄瓜、洋葱、西红柿[19]等均有发现。
2.2.3 霉菌M1鉴定结果


图4 霉菌M1鉴定结果Fig.4 Identification of mold strain M1
由图4a可知,霉菌M1菌落表面具有放射状沟纹,呈致密绒状。菌落最初暗黄绿色,后期变为暗黄绿色至蓝绿色,质地丝绒状,菌丝体白色,背面呈现暗黄色。分生孢子不对称,呈扁圆形或圆形,分生孢子梗顶端有1~2 条支链,分生孢子梗平滑、细长。由霉菌M1的菌落形态及显微镜观察结果,并参照文献[16],可初步判定霉菌M1为青霉属。
通过真菌ITS通用引物扩增霉菌M1菌株的序列并进行测序。将测得的序列上传至NCBI基因库中,与已登录的该属其他标准菌株序列进行BLAST分析并构建系统发育树。如图4b所示,霉菌M1与P.crustosum的同源性最高。其菌落形态及显微观察结果也与P.crustosum相符,因此鉴定霉菌M1为P.crustosum。P.crustosum也会引起甜樱桃[20]、灵武长枣[21]、新疆赛买提杏[22]等果实的腐烂。
2.2.4 霉菌M2鉴定结果
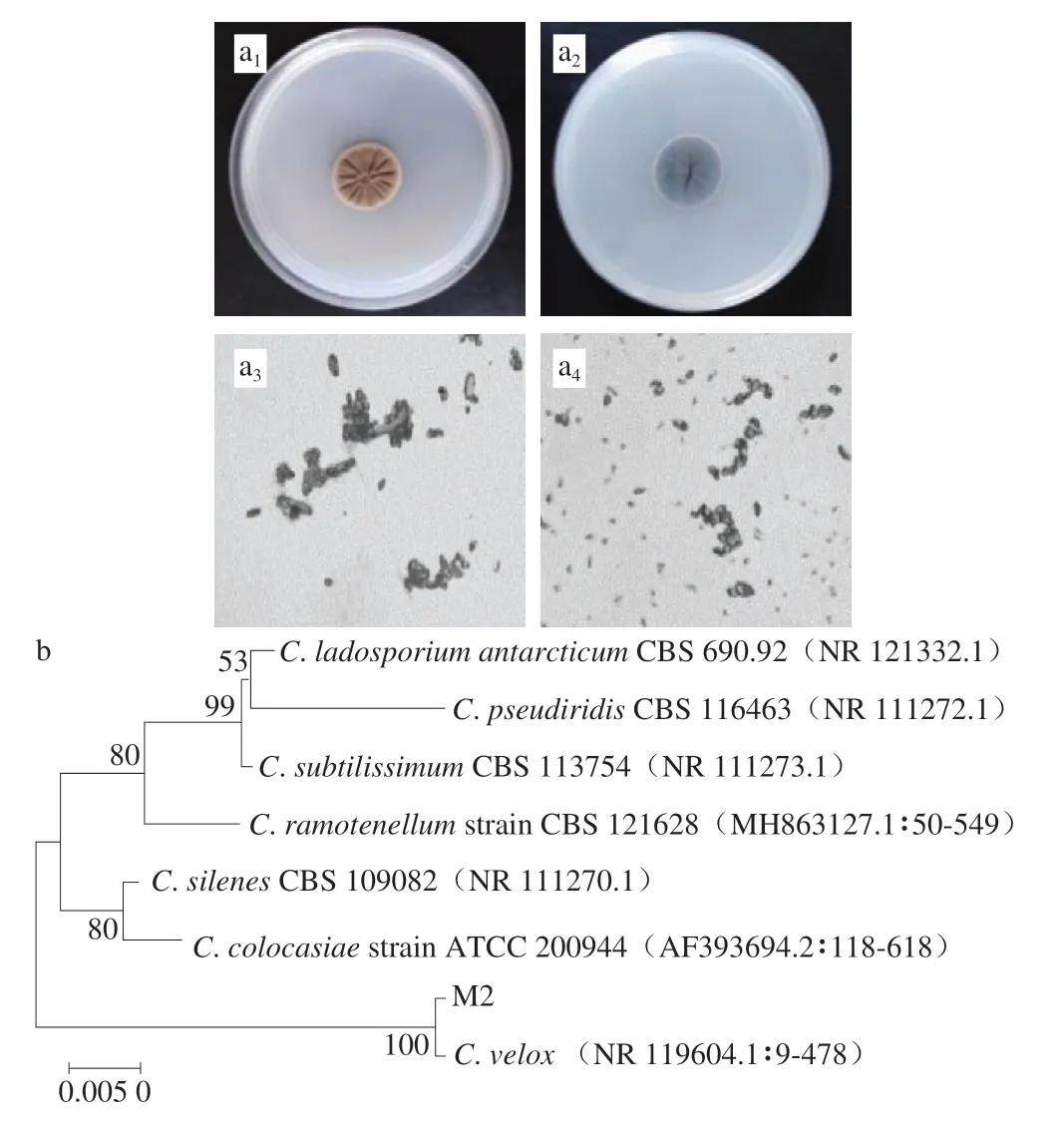
图5 霉菌M2鉴定结果Fig.5 Identification of mold strain M2
由图5a可以看出,霉菌M2菌落呈灰绿色,表面粗糙,具有放射状沟纹,背面蓝黑色,菌落局限,边缘整齐,菌丝有横隔,分生孢子呈卵形、球形、杆状。根据霉菌M2的形态学特征,并参照文献[16],可初步判定霉菌M2为枝孢菌属。
以真菌ITS通用引物对霉菌M2的菌株序列扩增,并进行测序。将测序结果在NCBI基因库中进行比对,下载已登录的该属的其他标准菌株序列,进行BLAST比对分析并构建系统发育树。如图5b所示,霉菌M2与枝孢霉菌(Cladosporium velox)二者位于同一分支,同源性最高。其形态学鉴定结果也与C.velox一致,因此鉴定霉菌M2为C.velox。有研究发现,Cladosporium也是导致莲藕[23]、蓝莓[24]、猕猴桃[25]腐败的微生物。
2.2.5 霉菌M3鉴定结果
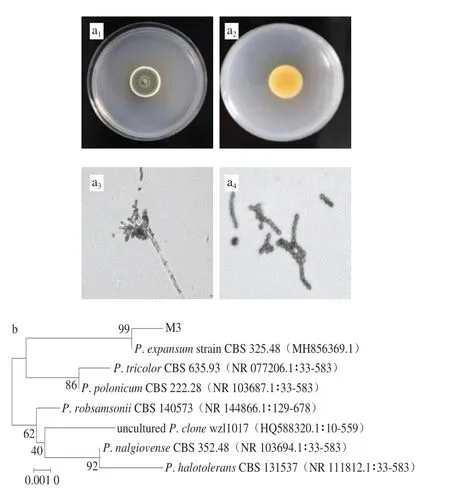
图6 霉菌M3鉴定结果Fig.6 Identification of mold strain M3
霉菌M3的形态学鉴定结果如图6a所示,菌落正面呈灰绿色,细绒状,周围绕以白边,具有多道同心环纹,背面呈暗黄色,由显微镜观察结果可以看出,分生孢子梗顶端呈扫帚状,具有不对称小梗,分生孢子密集一簇,近球形,壁平滑。根据霉菌M3的菌落及显微镜观察结果,并查阅文献[16]可知,霉菌M3特征与青霉属特征类似。
将霉菌M3的PCR产物进行测序,并将测得的序列上传至NCBI基因库中与该属的其他标准菌株序列进行BLAST比对分析,构建系统发育树(图6b)。霉菌M3与扩展青霉(P.expansum)的亲缘关系较近,可信度较高。结合其形态学鉴定结果,判定霉菌M3为P.expansum。
P.expansum属于半知菌亚门,是造成果蔬采后腐烂的主要致腐菌[26]。其致腐能力较强,可以局部改变pH值[27],有利于其成功侵染果实。据文献报道,P.expansum还可引起苹果[28]、梨[29]、桃[30]等果实腐烂,造成巨大的经济损失。
3 结 论
皱皮木瓜果实的腐败变质是几种病原菌共同作用的结果,通过形态鉴定、分子生物学鉴定,确定引起皱皮木瓜腐败的微生物主要有B.megaterium、B.pseudomycoides、P.crustosum、C.velox、P.expansum。本研究结果可以为皱皮木瓜贮藏过程中的微生物腐败进程和机制提供生物学证据,为进一步开发安全、绿色、高效的皱皮木瓜防腐保鲜技术提供理论支持。

