ABCG2抑制剂对ALA-PDT诱导皮肤癌细胞凋亡的影响
柳喜凤,张东晨(.河北省保定市第一中心医院公共卫生科,保定 07000;2.河北省保定市第一中心医院皮肤科,保定 07000)
皮肤癌是临床常见疾病,在长期受到紫外线照射或吸烟人群中的发病率较高[1]。皮肤癌的长期进展会影响患者的外貌,还导致患者病死率升高,严重影响患者的生活质量[2]。手术治疗能显著提高皮肤癌患者的生存率,但对于肿瘤病灶大、位置特殊的患者,术后创伤形成的瘢痕会给患者带来强烈的精神痛苦[3]。5-氨基乙酰丙酸(5-aminolaevulinic acid,5-ALA)是新一代的光敏感剂,可导致细胞中原卟啉IX(protoporphyrin IX,PPIX)蓄积[4]。光动力疗法(photodynamic therapy,PDT)是一种以光、光敏剂和氧分子相互作用为基础的非侵袭性治疗技术,可选择性破坏靶细胞、组织,还具有一定美容效果[5]。研究发现,病变部位PPIX的蓄积是影响ALA-PDT疗效的重要因素[6]。而三磷酸腺苷结合转运蛋白G超家族成员2(ATP-binding cassette transporter group 2,ABCG2)可调节内源性PPIX水平,过度表达会引起胞内PPIX水平降低[7]。ABCG2抑制剂可恢复三阴性乳腺癌细胞对ALA-PDT的敏感性[8]。但ABCG2抑制剂对ALA-PDT治疗皮肤癌的影响尚鲜有研究。本研究将探讨ABCG2抑制剂Ko-143对ALA-PDT诱导不同皮肤癌细胞凋亡的影响,以期为提高ALA-PDT对皮肤癌的疗效提供参考。
1 仪器与试药
1.1仪器 恒温培养箱(型号TY10GI2-2,美国Shellab公司);酶标仪(型号Stat Fax-2100,美国Awareness公司);流式细胞仪(型号Guauasoft 6L,美国Millipor公司);凝胶成像仪(型号GelDocEZ,美国Bio-Rad公司)。
1.2试药 人皮肤基底癌细胞TE354.T、人皮肤鳞癌细胞SCL-1(货号HTX2117C、HTX2657C,深圳市豪地华拓生物科技有限公司);5-ALA(货号YJ3004833,上海一基实业有限公司);ABCG2抑制剂Ko-143(货号A11475,美国Adooq Bioscience公司);RPMI-1640培养液(货号CP680110A,上海冠导生物工程有限公司);MTT试剂盒(货号M1020,北京索莱宝科技有限公司);Annexin-V-FITC/PI凋亡检测试剂盒(货号SNM530-FNI),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(货号ARB10949),丙二醛(malonydialdehyed,MDA)检测试剂盒(货号ARB12124),均购自北京百奥莱博科技有限公司;PPIX抗体(货号ab235595),ABCG2抗体(货号ab229193),B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(货号ab32124),Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(货号ab182734),活化型半胱氨酸天冬氨酸蛋白酶-3(Cleaved caspase-3)抗体(货号ab49822),GAPDH抗体(货号ab59164),羊抗兔lgG(货号 ab205718),均购自Abcam公司。
2 方法
2.1细胞培养 TE354.T、SCL-1细胞解冻复苏后,培养于含质量浓度为1 g·L-1胎牛血清的RPMI-1640培养液中,培养皿放在37℃、体积分数为5%的二氧化碳培养箱中,1~2 d更换1次培养液,待细胞覆盖培养皿底部80%左右时,用质量浓度为0.025 g·L-1的胰酶消化成单个细胞传代,取对数期细胞进行后续实验。
2.2MTT法检测TE354.T和SCL-1细胞增殖 取对数期TE354.T、SCL-1细胞,使用培养液将细胞悬液的密度调整为1×105个·mL-1,以每孔100 μL细胞悬液接种于96孔培养板。设置对照组、ALA-PDT组、Ko-143组和ALA-PDT+Ko-143组,每组6个复孔。对照组细胞不进行干预;ALA-PDT组细胞加入终浓度为2 mmol·L-1的5-ALA,避光孵育4 h,进行光照密度为10 J·cm-2(20 mW·cm-2,500 s)的PDT处理[9];Ko-143组加入终浓度为10 μmol·L-1的ABCG2抑制剂Ko-143[10];ALA-PDT+Ko-143组加入终浓度为2 mmol·L-1的5-ALA及终浓度为10 μmol·L-1的Ko-143,避光孵育4 h,进行光照密度为10 J·cm-2(20 mW·cm-2,500 s)的ALA-PDT处理。处理结束后放回培养箱中再孵育20 h,每孔加入3-(4,5)-2-噻唑-(2,5)-二苯基溴化四氮唑蓝[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide,MTT]10 μL,放回培养箱中继续孵育4 h,弃去培养液,每孔加二甲基亚砜(dimethylsurfoxide,DMSO) 150 μL,避光振荡溶解,测定各孔450 nm处的吸光度(A),计算增殖抑制率。增殖抑制率=[(A对照组-A实验组)/A对照组]×100%。
2.3流式细胞术检测TE354.T和SCL-1细胞凋亡 取对数期TE354.T、SCL-1细胞,使用培养液调整细胞悬液的密度为1×105个·mL-1,以每孔500 μL细胞悬液接种于24孔培养板,按2.2项下方法对细胞进行分组和处理。处理结束后,放回培养箱中孵育20 h,收集细胞,经胰酶消化后洗涤。将Annexin-VFITC、PI和结合缓冲液按1∶2∶50配制成Annexin-V-FITC/PI染液,使用Annexin-V-FITC/PI染液将细胞重悬,使其成为密度为1×107个·mL-1的细胞悬液,室温避光孵育15 min,在流式细胞仪上样,检测细胞凋亡率。
2.4ELISA法检测TE354.T和SCL-1细胞中的GSH-Px活性、MDA含量 取对数期TE354.T、SCL-1细胞,使用培养液将细胞悬液的密度调整为1×105个·mL-1,以每孔500 μL细胞悬液接种于24孔培养板,按2.2项下方法进行分组和处理。处理结束后,放回培养箱中孵育20 h。收集细胞,经消化后洗涤,在冰上将细胞制成匀浆后离心,取上清,参照ELISA试剂盒说明书中步骤,测定450 nm处各组样品与标准物的A值,用标准物浓度及相应A值绘制标准曲线,计算TE354.T、SCL-1细胞中GSH-Px的活性和MDA的含量。
2.5蛋白印迹法检测TE354.T和SCL-1细胞中PPIX、ABCG2、Bcl-2、Bax和Cleaved caspase-3蛋白的表达 取对数期TE354.T、SCL-1细胞,使用培养液将细胞悬液的密度调整为1×105个·mL-1,以每孔500 μL细胞悬液接种于24孔培养板,按2.2项下方法进行分组和处理。处理结束后,放回培养箱中孵育20 h,收集细胞并用裂解液裂解,提取总蛋白并测定浓度,取适量样本,加Buffer缓冲液并用沸水浴处理,使其变性,经凝胶电泳分离、半干法转膜和脱脂奶粉封闭后,加入按1∶800稀释的一抗(PPIX抗体、ABCG2抗体、Bcl-2抗体、Bax抗体、Cleaved caspase-3抗体和GAPDH抗体),4℃孵育过夜,用TBST洗涤3次(10 min·次-1),加入按1∶3 000稀释的二抗,室温孵育1 h,用TBST洗涤3次,增强化学发光法(enhanced chemiluminescence,ECL)发光显色,凝胶成像仪采集图片,用Image J软件分析灰度值。目的蛋白相对表达量=目的蛋白灰度值/内参GAPDH灰度值。

3 结果
3.1Ko-143对ALA-PDT诱导TE354.T和SCL-1细胞增殖抑制的影响 与对照组相比,ALA-PDT组和Ko-143组TE354.T、SCL-1细胞增殖抑制率均显著升高(P<0.05);与ALA-PDT组相比,ALA-PDT+Ko-143组TE354.T、SCL-1细胞增殖抑制率均显著升高(P<0.05)。见表1。

表1 各组TE354.T和SCL-1细胞增殖抑制率比较Tab.1 Comparison of proliferation inhibition rates of TE354.T and SCL-1 cells in each group
3.2Ko-143对ALA-PDT诱导TE354.T和SCL-1细胞凋亡的影响 与对照组相比,ALA-PDT组和Ko-143组TE354.T、SCL-1细胞凋亡率均显著升高(P<0.05);与ALA-PDT组相比,ALA-PDT+Ko-143组TE354.T、SCL-1细胞凋亡率均显著升高(P<0.05)。见图1和表2。

表2 各组TE354.T和SCL-1细胞凋亡率比较Tab.2 Comparison of apoptosis rate of TE354.T and SCL-1 cells in each group

图1 各组TE354.T和SCL-1细胞凋亡情况Fig.1 Apoptosis of TE354.T and SCL-1 cells in each group
3.3Ko-143对ALA-PDT诱导TE354.T和SCL-1细胞氧化应激的影响 与对照组相比,ALA-PDT组和Ko-143组TE354.T、SCL-1细胞中GSH-Px活性均显著降低,MDA含量均显著升高(P<0.05);与ALA-PDT组相比,ALA-PDT+Ko-143组TE354.T、SCL-1细胞中GSH-Px活性均显著降低,MDA含量均显著升高(P<0.05)。见表3。

表3 各组TE354.T、SCL-1细胞中GSH-Px活性和MDA含量比较 Tab.3 Comparison of GSH-Px activity and MDA content in TE354.T and SCL-1 cells in each group
3.4Ko-143对ALA-PDT诱导TE354.T和SCL-1细胞中ABCG2和PPIX蛋白表达的影响 与对照组相比,ALA-PDT组TE354.T、SCL-1细胞中ABCG2的表达水平差异均无统计学意义(P>0.05),PPIX蛋白表达水平均显著升高(P<0.05);Ko-143组TE354.T、SCL-1细胞中ABCG2蛋白表达水平均显著降低(P<0.05),PPIX蛋白表达水平均显著升高(P<0.05)。与ALA-PDT组相比,ALA-PDT+Ko-143组TE354.T、SCL-1细胞中ABCG2蛋白表达水平均显著降低,PPIX蛋白表达水平均显著升高(P<0.05)。见图2和表4。

图2 各组TE354.T和SCL-1细胞中ABCG2和PPIX的蛋白表达水平

表4 各组TE354.T、SCL-1细胞中ABCG2和PPIX蛋白表达水平比较Tab.4 Comparison of ABCG2 and PPIX protein expression levels in TE354.T and SCL-1 cells in each group
3.5Ko-143对ALA-PDT诱导TE354.T和SCL-1细胞中凋亡相关蛋白表达的影响 与对照组相比,ALA-PDT组、Ko-143组TE354.T、SCL-1细胞中Bcl-2/Bax蛋白的表达水平均显著降低(P<0.05),Cleaved caspase-3蛋白的表达水平均显著升高(P<0.05)。与ALA-PDT组相比,ALA-PDT+Ko-143组TE354.T、SCL-1细胞中Bcl-2/Bax蛋白的表达水平均显著降低,Cleaved caspase-3蛋白的表达水平均显著升高(P<0.05)。见表5和图3。

表5 各组TE354.T、SCL-1细胞中Bcl-2、Bax和Cleaved caspase-3蛋白表达水平比较Tab.5 Comparison of the expression levels of Bcl-2,Bax and cleaved caspase-3 in TE354.T and SCL-1 cells in each group
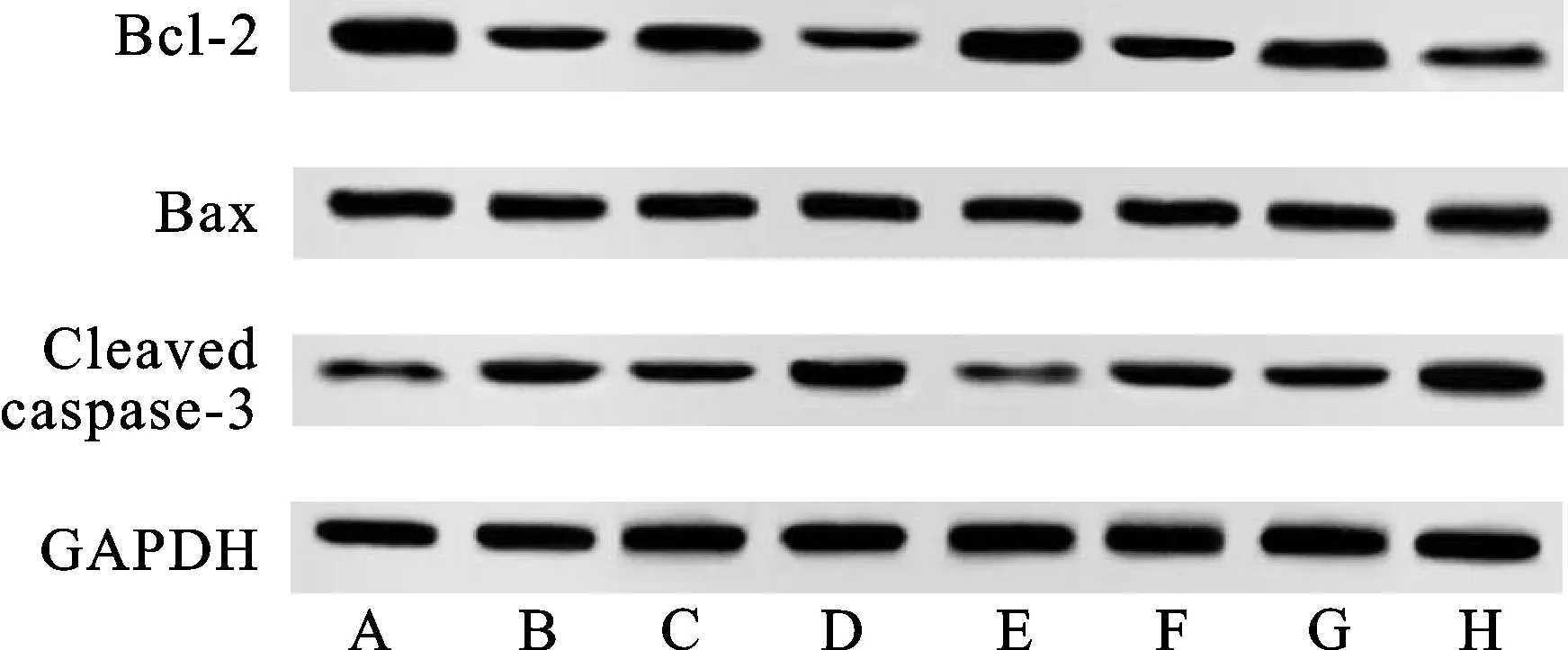
图3 各组TE354.T和SCL-1细胞中Bcl-2、Bax、Cleaved caspase-3蛋白的表达水平注:A~D分别为TE354.T细胞对照组、ALA-PDT组、Ko-143组和ALA-PDT+Ko-143组;E~H分别为SCL-1细胞对照组、ALA-PDT组、Ko-143组和ALA-PDT+Ko-143组。Fig.3 Expression of Bcl-2,Bax,cleaved caspase-3 in TE354.T and SCL-1 cells in each groupNotes:A-D were control group,ALA-PDT group,Ko-143 group and ALA-PDT+Ko-143 group of TE354.T cell,respectively; E-H were control group,ALA-PDT group,Ko-143 group and ALA-PDT+Ko-143 group of SCL-1 cell,respectively.
4 讨论
皮肤是最大的人体器官,能够保护机体免于发生物理损伤,然而,皮肤在长时间的紫外线或辐射等的照射下,会出现皮肤组织细胞中DNA的断裂,引起皮肤癌变[11]。皮肤基底细胞癌、皮肤鳞状细胞癌是分别由多能性基底样细胞、表皮角质形成细胞异常增生而形成的肿瘤,在恶性皮肤肿瘤中的发病率居前两位,近年来其发病率不断升高[12]。目前治疗皮肤癌的方法有很多,如手术、激光、冷冻、放疗和化疗等,其中手术治疗疗效显著,为首选治疗方案,但其在治疗某些特殊患者时具有很大的局限性,存在创面大、遗留疤痕、不良反应多和美容效果欠佳等缺点[13]。因此,寻找更合适的治疗手段对于皮肤癌的治疗具有重要意义。
ALA-PDT是新兴起的皮肤肿瘤的治疗方式,近年来,由于其具有创伤小、痛苦少、无皮损部位限制等优势,在皮肤浅表肿瘤的治疗中逐渐得到广泛应用。PDT是通过特定波长的激光激活光敏剂,同时与分子氧发生作用,从而产生活性氧分子,通过氧化作用导致细胞膜或蛋白质发生氧化损伤,进而导致细胞死亡[14]。5-ALA是一种血红蛋白合成中间物,在体内的量较少,但某些代谢旺盛的肿瘤细胞可选择性吸收、积累进入体内的外源性5-ALA[15]。5-ALA被肿瘤细胞吸收后代谢为内源性光敏剂PPIX,具有强光敏作用,在特定波长激光的照射下会被激活生成单态氧,进而杀伤细胞,达到治疗肿瘤的目的[13,16]。因此,ALA-PDT对肿瘤细胞的杀伤作用与肿瘤细胞中PPIX的蓄积水平有关。本研究显示,ALA-PDT可以显著提高TE354.T、SCL-1细胞的增殖抑制率及凋亡率,并降低Bcl-2/Bax蛋白的表达水平,提高Cleaved caspase-3蛋白的表达水平,提示ALA-PDT可以下调抑凋亡成员Bcl-2与促凋亡成员Bax的比值,并提高caspase-3活性,抑制皮肤基底细胞癌TE354.T细胞、皮肤鳞状细胞癌SCL-1细胞增殖并诱导其凋亡。GSH-Px是重要的抗氧化酶,可阻止脂质过氧化反应,保护细胞膜的结构和功能,而MDA作为脂质过氧化反应的最终产物,是检测氧化应激反应的重要参考指标[17]。本研究显示,ALA-PDT可以显著提高TE354.T、SCL-1细胞中PPIX蛋白的水平及MDA的含量,降低GSH-Px的活性,提示ALA-PDT会导致TE354.T、SCL-1细胞中PPIX蛋白蓄积,进而提高氧化应激反应,导致TE354.T、SCL-1细胞发生氧化应激损伤并凋亡。
ABCG2是ABC转运蛋白家族成员,在肿瘤中普遍高表达,其会主动将化疗药物泵出细胞外,导致癌细胞耐药[18]。孙伟等[19]研究表明,ABCG2介导恶性脑胶质瘤细胞内PPIX的外流,使用白藜芦醇抑制ABCG2的表达可增加细胞内PPIX的含量,从而提高PDT疗效。Ko-143是一种有效且具有相对选择性的ABCG2抑制剂,是ABCG2特异性抑制剂烟曲霉毒素C(fumitremorgin C,FTC)的衍生物,对ABCG2的抑制作用是FTC的10倍[10]。本研究显示,使用Ko-143辅助ALA-PDT处理TE354.T、SCL-1细胞后,细胞中ABCG2蛋白的表达水平均显著降低,同时PPIX蛋白的表达水平均显著升高,提示Ko-143在显著抑制ABCG2蛋白表达的同时,还能够使PPIX在胞内蓄积。同时,与ALA-PDT组相比,ALA-PDT+Ko-143组TE354.T、SCL-1细胞中GSH-Px的活性及Bcl-2/Bax蛋白的表达水平显著降低,MDA含量及Cleaved caspase-3蛋白的表达水平显著升高,细胞增殖抑制率及凋亡率均显著升高,提示Ko-143抑制ABCG2蛋白表达后,可提高ALA-PDT作用下细胞内PPIX蛋白的蓄积量,导致细胞氧化应激反应加剧,提高ALA-PDT对TE354.T、SCL-1细胞增殖的抑制及对凋亡的促进能力。
综上所述,ABCG2抑制剂Ko-143能抑制ABCG2的表达,提高PPIX蛋白在胞内的蓄积水平,对ALA-PDT诱导TE354.T、SCL-1细胞氧化应激损伤和凋亡具有促进作用,对临床减少ALA-PDT抵抗、提高ALA-PDT疗效可能具有一定价值。

