空气动力辅助离子化质谱组织涂片分析用于胶质瘤异柠檬酸脱氢酶基因状态的快速判别
王子璇,张雅馨,回相宜1,,张 扬,沈慧聪,季 楠,贺玖明, 张瑞萍,厉 欣*,马 强,再帕尔·阿不力孜,4
(1.中国检验检疫科学研究院,北京 100176;2.中国医学科学院北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;3.首都医科大学附属北京天坛医院,北京 100070;4.中央民族大学,生物成像与系统生物学研究中心,北京 100081)
胶质瘤是常见的原发性颅脑恶性肿瘤,具有发病率高、复发率高、死亡率高以及治愈率低的特点,在临床诊疗上面临诸多挑战[1-2]。2016年WHO中枢神经系统肿瘤分类第四版中首次在组织学分型基础上加入了基因特征,将弥漫性胶质瘤细分为异柠檬酸脱氢酶基因(Isocitrate dehydrogenase,IDH)野生型和突变型[3],确立了分子时代中枢神经系统肿瘤诊疗的新理念。IDH基因突变型的患者预后较好[4],无进展生存期和总生存期较长[5],因此尽早确定胶质瘤的IDH分型对于精确诊断、治疗方案制订以及预后判断具有重要意义[6]。目前,临床上使用基因测序法判断基因型,但其耗时长,延长了诊断周期,且只能用于指导术后治疗。因此,有必要建立一种快速判别胶质瘤IDH基因状态的分析方法。
敞开式质谱是一种新兴的质谱分析技术,包括解吸电喷雾离子化(Desorption electrospray ionization,DESI)技术[7]、介质阻挡放电离子化(Dielectric barrier discharge ionization,DBDI)技术[8-9]、萃取电喷雾离子化(Extractive electrospray ionization,EESI)技术[10-11]、纸喷雾离子化(Paper spray ionization)技术[12]、等离子体辅助多波长激光解吸离子化(Plasma assisted multi-wavelength laser desorption ionization,PAMLDI)技术[13]等,其特点在于样品分析前无需或只需较少的前处理步骤[14]。因此,除了具有质谱分析的灵敏度高、特异性强、分析通量高等优点外,还具有分析流程耗时短的显著优势[15]。本课题组前期开发了基于空气动力辅助离子化质谱(Air flow-assisted desorption electrospray ionization mass spectrometry,AFADESI-MS)及其成像技术(AFADESI-MSI),建立了检测食道癌组织代谢标志物的分析方法,并用于对冰冻组织切片上正常组织与癌变组织的判别,实现了食管癌组织的快速分子诊断[16]。
本文采用组织涂片替代代谢物分析常用的组织切片作为样品准备方法,考察了组织涂片用于代谢物快速质谱分析的可行性并进行定量方法学验证。进一步以胶质瘤组织涂片为样品,胶质瘤代谢标志物2-羟基戊二酸(2-HG)[17]与组织内含量较为恒定的花生四烯酸(AA)的质谱响应强度比值作为评价指标,采用敞开式质谱AFADESI-MS技术快速判别胶质瘤的IDH基因状态。所建立的分析方法有望为胶质瘤术中决策提供有力的技术支持。
1 实验部分
1.1 仪器与试剂
四极杆静电场轨道阱(Q-Orbitrap)质谱仪(QExactive,美国Thermo Fisher公司),搭载自主研发的 AFADESI 离子源;单通道微量移液器(德国Eppendorf公司);Leica CM1860切片机(德国Leica公司);PrimeHisto XE扫描仪(中国台湾PIE公司);乙腈、甲醇(质谱纯,美国 Fisher Scientific 公司),纯净水(杭州娃哈哈集团有限公司),D3-2-羟基戊二酸二钠盐标准品(批号:2-MJJ-169-1,加拿大 Toronto Research Chemicals 公司)。
1.2 样本信息
用于方法考察的鼠脑组织样品取材于雄性昆明种小鼠或雌性SD大鼠,实验动物均购自北京维通利华实验动物技术有限公司,按照相关方案和动物伦理要求进行收集。
临床标本为24例胶质瘤患者手术切除病理组织的冰冻样本,分为IDH1基因突变型和野生型各12例。临床标本由首都医科大学附属北京天坛医院神经外科按照样品采集规范和流程采集。
1.3 实验方法
1.3.1 样品制备分别制备鼠脑组织冰冻切片、组织匀浆膜和组织涂片样品用于考察方法的可行性。组织冰冻切片:将昆明种小鼠鼠脑组织自-80 ℃冰箱取出,置于-20 ℃恒温箱中复温2 h,使用Leica Cryo-Gel包埋胶将组织固定于切片机样品托,然后用冰冻切片机在-20 ℃环境下制作12 μm的脑冠状面冰冻切片;进一步将组织切片置于-20 ℃干燥1 h,然后置于室温下干燥备用。组织匀浆膜:取同源鼠脑组织60 mg,加入60 μL 4 ℃水配制鼠脑组织匀浆液,刮取少量匀浆液至与切片同一张载玻片上,用压板边缘涂抹均匀成膜,室温下抽真空干燥2 h。组织涂片:取同源鼠脑组织5 mg左右,置于载玻片上空白处,用自制聚四氟压板的斜面边缘直接涂抹成组织薄层,备用。
将含梯度D3-2-HG标准品的模拟脑组织涂片用于建立定量曲线:配制1 mg/mL D3-2-羟基戊二酸二钠盐标准品(分子式为:C5H3D3Na2O5,精确分子量为195.019 3 Da)储备液4 mL,再配成梯度浓度标准工作溶液,质量浓度分别为0.31、1.03、3.12、10.31、31.25、103.13、312.50 μg/mL。取SD大鼠脑皮质部分组织100 mg,加入4 ℃水配制成1 mg/mL组织匀浆液。为防止在载玻片上滴加溶液时出现边缘效应,先取100 μL梯度浓度标准工作溶液、100 μL匀浆液及120 μL甲醇混合,配成D3-2-HG质量浓度分别为0.10、0.32、0.98、3.23、9.77、32.27、97.66 μg/mL的组织匀浆液样品。将每张PVC膜等间距打出8孔阵列贴于载玻片上,分别吸取上述组织匀浆液各5 μL滴加于孔中心至填满每个孔,干燥器中常温干燥1 h。为更好地模拟真实组织样品中2-HG的检测,将干燥后的样品再用压板边缘刮取少量SD大鼠脑皮质区域组织样品,涂抹盖住样品孔,常温干燥1 h,以模拟质谱检测时脑组织对2-HG离子信号强度的基质抑制效应影响[18]。得到样品孔区域内同位素内标含量分别为0.05、0.16、0.49、1.61、4.88、16.11、48.83 pg/mm2组织的鼠脑组织涂片样品。每个浓度制作3组平行样品。
胶质瘤组织涂片样品:按上述方法取100 μL组织匀浆液加入100 μL水、120 μL甲醇混合,滴加于载玻片PVC膜样品孔中,干燥器中常温干燥1 h后,以压板边缘涂抹少量胶质瘤组织样品成薄层,常温干燥备用。
1.3.2 质谱条件离子源:AFADESI;扫描方式:全扫描/单离子监测 (Full scan/SIM);扫描模式:负离子模式;喷雾电压:7 kV;抽气流速:45 L/min;扫描范围:m/z70~1 000/140~160;加热气流速:0;加热气温度:0 ℃;分辨率:70 000;毛细管温度:50 ℃;吹扫气流速:0;喷雾溶剂流速:5 μL/min。
1.3.3 数据采集与处理质谱数据采集:质谱成像实验时,借助电动样品平移台移动含有样品的载玻片,以0.2 mm/s的线性扫描速度,0.2 mm的扫描间距逐行对样品全部区域依次进行扫描和质谱数据采集。快速判别实验时,从胶质瘤组织涂片样品阵列的一侧开始,以0.2 mm/s线性扫描速度向阵列另一侧对各涂片样品进行序贯扫描和数据采集。
质谱成像考察:采用Xcalibur软件将raw格式的质谱成像原始数据转化为cdf格式,导入自主研发的MassImager 2.0软件[19]进行成像,在成像图中离子信号均匀区域提取任意5*5像素点的平均质谱数据,导入Markerview(Version 1.2.1.1)软件进行质谱峰对齐,分别获得目标代谢物的离子强度。
定量方法学考察:对组织涂片中小区域范围扫描的同位素内标D3-2-HG的峰信号进行数据处理,获得响应强度与添加含量的线性回归方程。通过线性回归方程和涂片样品的平均相对强度计算D3-2-HG实测含量,以D3-2-HG的实测含量与理论含量计算方法的准确度,以每个样品含量的标准偏差和相对标准偏差(RSD)计算方法的精密度。在GraphPad Prism(Version 8.0.2(263))软件中用线性回归法计算同位素内标的标准曲线、检出限(LOD)和定量下限(LOQ)。
代谢组学评估:使用Simca-P(Version 14.1.1.2047)软件对数据质量进行评估。根据人类代谢组学数据库(Human Metabolome Database,HMDB,https://hmdb.ca/)的检索结果推测所含代谢物信息,对组织涂片中检出代谢物的覆盖度进行考察。使用SPSS 25.0软件建立胶质瘤组织涂片中检测2-HG/AA的受试者工作曲线(ROC),并计算曲线下面积(AUC)和截断值(Cut-off value)。
2 结果与讨论
2.1 组织涂片用于代谢物快速分析的可行性考察
2.1.1 组织涂片的均匀性考察生物组织通常具有结构和功能区域化的特点,这意味着组织代谢物的微区分布会导致其检出的偏倚性。为考察涂片操作对组织中代谢物的分散效果,对鼠脑的组织切片、组织匀浆膜和组织涂片的光学图像、HE染色图及不同离子的质谱成像图分别进行比较(如图1)。结果显示,组织切片光学图像中明显可见的结构微区在组织涂片中已被破坏并重新分布;组织切片质谱成像图中的代谢物离子显示出区域化分布特征,而组织涂片与组织匀浆膜类似,其质谱成像图中代谢物离子的分布较为均匀分散。因此,与组织切片相比,将组织涂片作为组织样品前处理方式具有更好的代谢物分散能力。
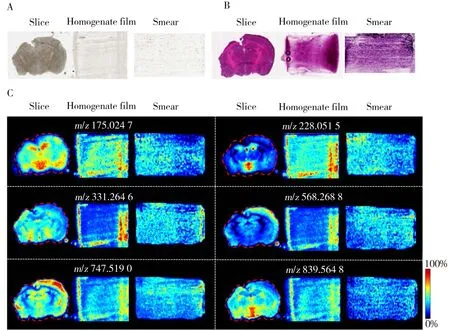
图1 组织切片、组织匀浆膜、组织涂片的均匀性对比Fig.1 Comparison of tissue section,tissue homogenate film and tissue smearA:optical images(光学成像图);B:H&E stain(HE染色图);C:ion images of metabolites(不同代谢物离子的质谱成像图)
2.1.2 组织涂片用于敞开式质谱分析的耗时考察在敞开式质谱的分析应用中,样品预处理步骤的耗时是整个分析流程能否实现快速分析的重要制约因素[20]。组织涂片的准备过程省略了制备组织切片的复杂操作环节,采用上述方法从低温保存的临床组织样品直接制备成组织涂片的耗时少于1 min,极大地降低了对脑组织中代谢物进行敞开式质谱分析的样品准备耗时。另一方面,敞开式质谱分析的耗时还与待测样品的面积相关,以0.2 mm/s的线性扫描速度,0.2 mm的扫描间距逐行对2 mm×5 mm大小的组织切片进行AFADESI-MS扫描需耗时30 min。对含4块胶质瘤组织涂片的样品阵列以0.2 mm/s线性扫描速度采集1.4 min的示意图见图2。由2-HG的提取离子流图(EIC)可见,对单块涂片样品进行单行扫描时2-HG的离子信号强度在区域内较为均匀。涂片处理能够将样品组织代谢物均匀分散,无需对完整的涂片逐行采样即可较全面地获得样品中包含的代谢物信息。因此本实验将组织涂片做成阵列的形式,在目标区域采集数据1~2 min,样品制备和分析总耗时在3~7 min即可采集到代谢物信息,大幅减少了采样环节耗时。由此可见,在敞开式质谱分析代谢标志物的应用中,将涂片方法用作生物组织的样品前处理显示出简单、快速、有效的特点,具有快速检测的应用潜力。
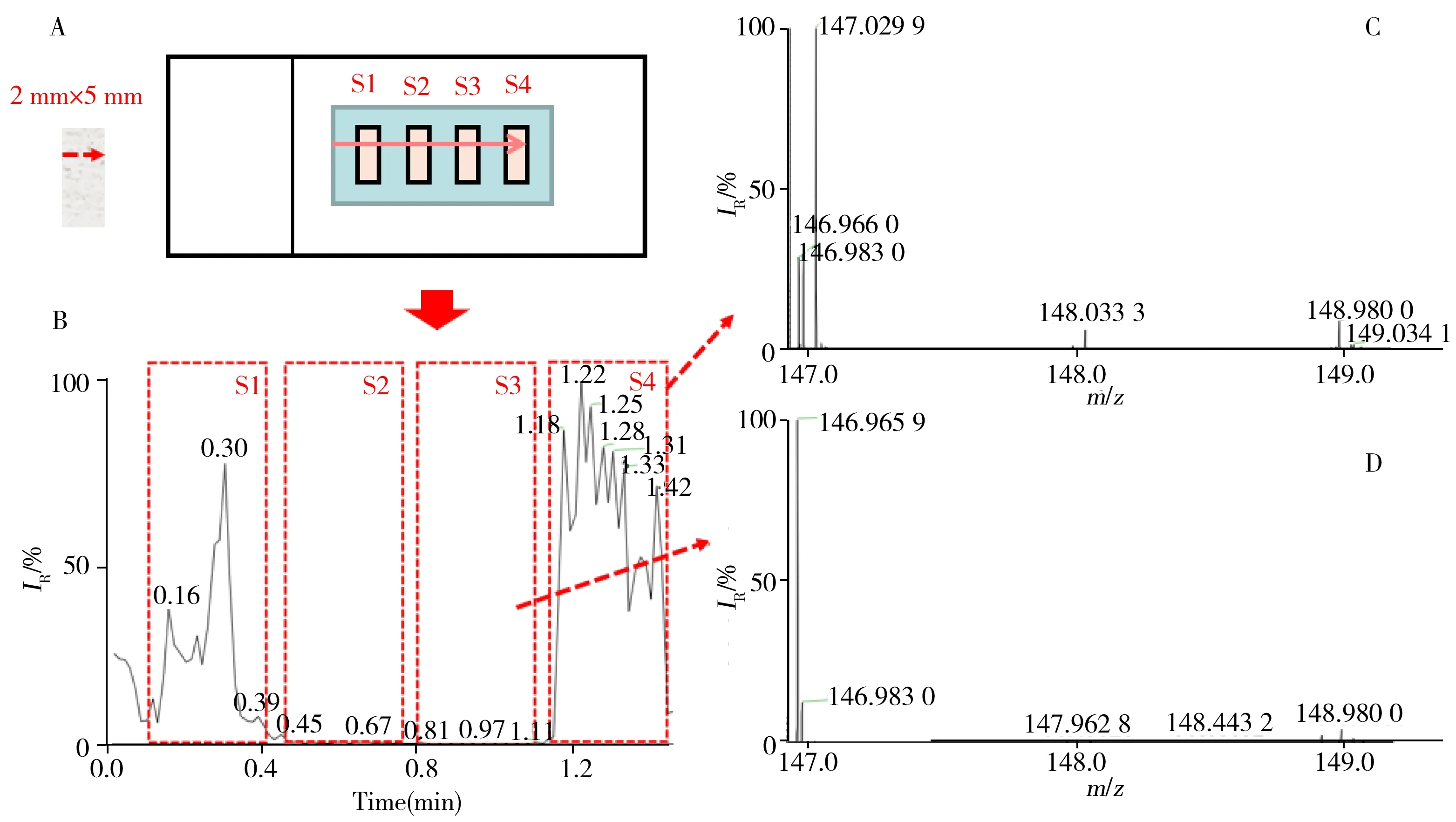
图2 对含4块组织涂片的样品阵列进行扫描采样的示意图(A);AFADESI-MS采集组织涂片阵列上2-HG的EIC图(B);不同样品中m/z 146.5~149.5区间的质谱图(C、D)Fig.2 Schematic for sampling the array containing of 4 glioma tissue smears(A);extracted ion current(EIC) of 2-HG on tissue smear obtained by AFADESI-MS(B);mass spectra of different samples in the mass range of 146.5-149.5(C,D)

图3 AFADESI分析切片与涂片中检测到的离子峰强度与数目的色阶图对比Fig.3 Comparison of intensity and quantity of ions detected by AFADESI in tissue slice and smear
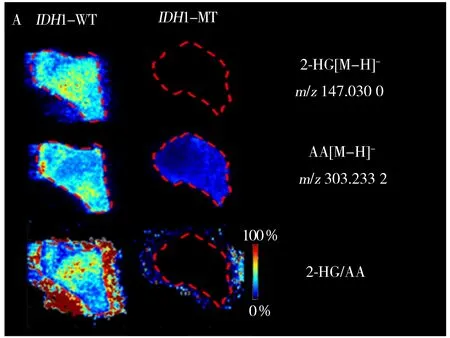
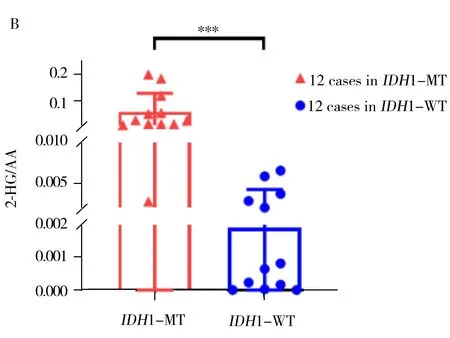
图4 突变型和野生型胶质瘤组织中2-HG和AA的质谱成像图以及2-HG/AA的重建图(A);24例IDH1突变型和野生型样品中2-HG/AA比值分布的箱图与散点图(B)Fig.4 Ion images of 2-HG and arachidonic acid in glioma tissue (A);box plots and scatter plots showing the differences of 2-HG/AA between IDH1-MT and IDH1-WT samples(***:p<0.001)(B)
2.1.3 敞开式质谱分析组织涂片中代谢物的覆盖度考察代谢物覆盖度是分析方法能够适用于多种代谢标志物检测的前提。为考察组织涂片中检出代谢物的覆盖度,采用色阶图分析对胶质瘤同源组织切片与涂片样品中检测到的离子峰数目和相对强度进行比较。将样品中检测到的离子峰按照m/z80~270、m/z270~400、m/z400~650、m/z650~1 000 4个质荷比范围进行划分,离子峰的相对强度越高,其m/z条带颜色越深。如图3所示,组织涂片样品采集到相对强度大于1 000的代谢物离子峰数目略多,有1 034个,而切片上有803个。说明涂片操作的分散作用有助于提高AFADESI采样时从组织中解吸代谢物的效率,更有利于代谢物的检出。同时,在m/z200~270和m/z700~1 000范围内涂片中检测到代谢物离子的相对强度也较切片中更高。考虑到这个质荷比范围内大多是脂肪酸和磷脂类化合物,说明这两类化合物在组织涂片中的质谱信号响应优于切片。此外,利用HMDB数据库检索代谢物,结果提示涂片与切片样品具有类似的代谢组学信息。上述结果表明,以组织涂片替代切片进行代谢物分析能够获得与组织切片分析相当的代谢物信息,这意味着将组织涂片用于代谢标志物的质谱分析具有较好的普适性。
2.2 组织涂片用于代谢物定量分析的方法学考察
进一步对组织涂片用于代谢物定量分析进行了方法学考察。从3组脑组织涂片的AFADESI质谱成像结果中随机提取5*5像素点区域D3-2-HG[M-H]-准分子离子峰(m/z150.048 7)的平均强度,以D3-2-HG的添加含量为横坐标(X,pg/mm2),质谱信号响应强度为纵坐标(Y)绘制标准曲线。采用信噪比(S/N)估算方法的LOD和LOQ值。将S/N等于3.3时的数据点0.05 pg/mm2组织含量作为LOD,将 LOD 代入公式,得到LOQ为 0.17 pg/mm2组织含量。结果表明,D3-2-HG在0.16~48.83 pg/mm2组织含量范围内线性关系良好,回归方程为Y=10 720X+6 515,相关系数(r2)为0.998 1。方法的准确度和精密度结果如表1所示,除D3-2-HG为0.05 pg/mm2组织含量的数据点由于样品含量过低,仪器误差偏大之外,其余各点的准确度及精密度均较好。
2.3 组织涂片敞开式质谱代谢物检测用于IDH基因状态快速判别
2-HG是临床上公认的IDH基因突变胶质瘤组织的代谢标志物,可作为敞开式质谱分析的靶标分子用于胶质瘤组织IDH基因型的判别[21]。考虑到来源于临床不同个体的病理组织差异较大,同时为提高IDH基因状态快速判别应用的可操作性,以胶质瘤组织中较为恒定分布的花生四烯酸(AA,[M-H]-m/z303.233 2)作为参照,以2-HG与AA的离子强度比值为相对定量指标,考察其用于组织涂片样品IDH基因状态快速判别的能力(如图4A)。结果显示,野生型组12例样品和突变型组12例样品中2-HG与AA的比值分布在1~3个数量级之间,存在明显差异(如图4B)。进一步对胶质瘤组织涂片样品进行ROC分析,以评价其用于IDH基因状态判别的诊断能力。以敏感性(Sensitivity)为纵坐标,特异性(1-Specificity)为横坐标绘制24例涂片样品的ROC曲线(图5),组织涂片ROC分析的AUC值为0.972,表明2-HG/AA用于判断IDH基因突变的诊断能力良好,截断值为9.6×10-3,即涂片方法用于判断IDH基因状态为突变时2-HG/AA的最小值为9.6×10-3,可认为胶质瘤组织中存在IDH基因突变。
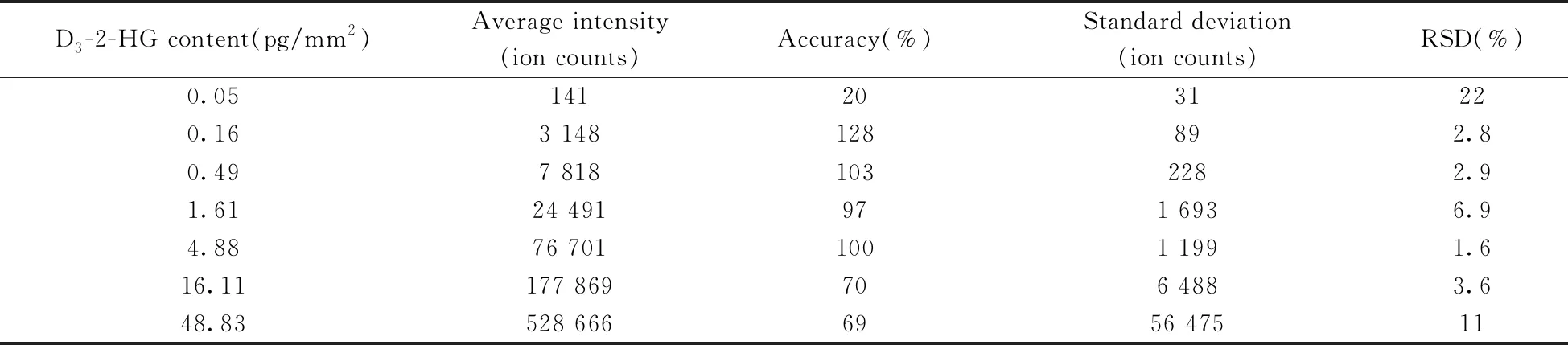
表1 准确度与精密度的方法学考察结果Table 1 Examination for accuracy and precision of methodology
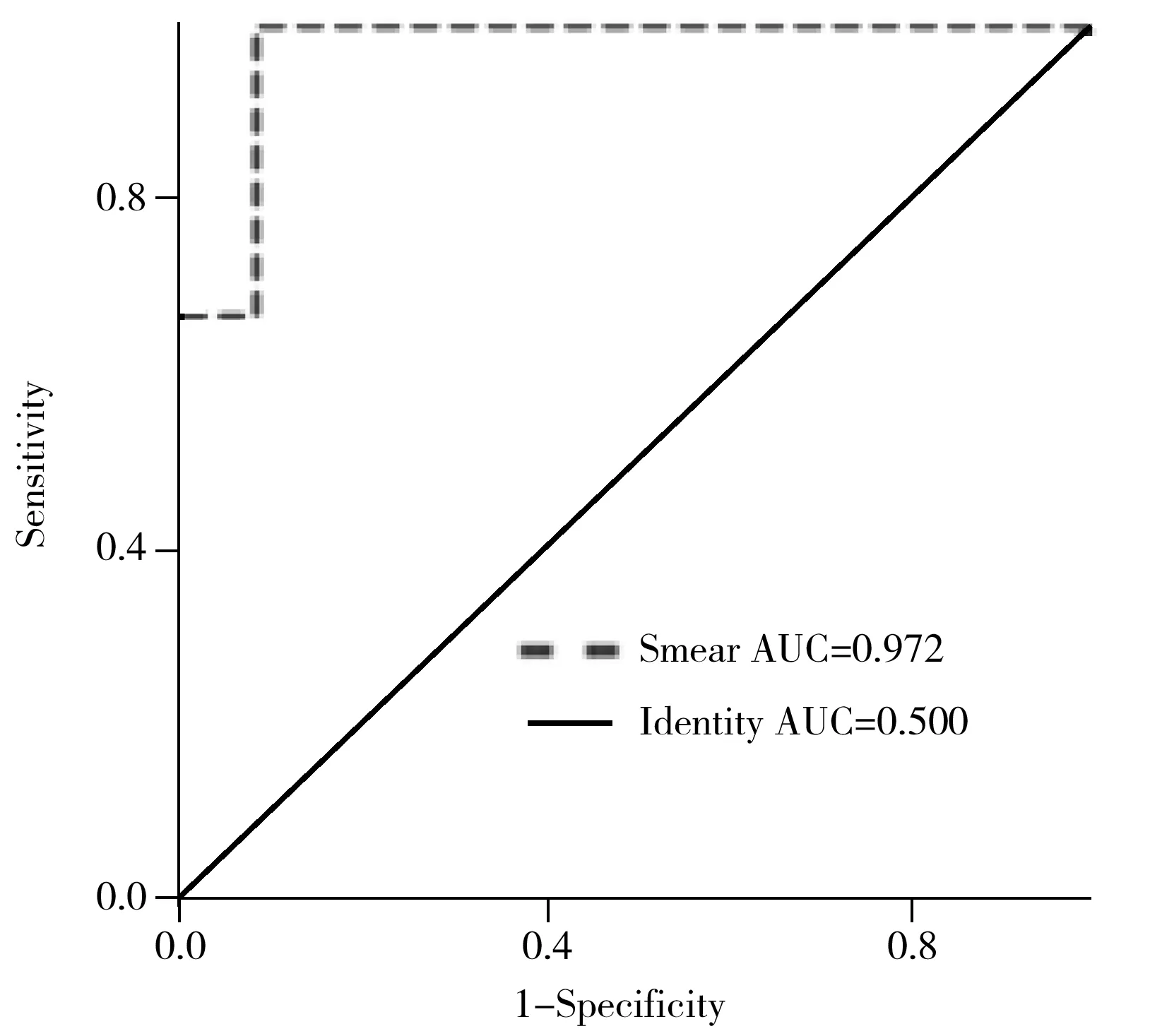
图5 组织涂片样品的ROC曲线Fig.5 ROC evaluation of tissue smears
3 结 论
本文建立了基于空气动力辅助离子化质谱技术的胶质瘤IDH基因状态快速判别分析方法。采用组织涂片作为敞开式质谱定性定量分析病理组织代谢物的预处理方法,具有样品分散性好、操作简单快速、代谢物覆盖度高、定量准确度好的优点。在此基础上,采用2-HG与AA的丰度比值作为胶质瘤IDH基因状态的判别指标,可以有效消除不同批次病理样品间的个体差异,无需建立标准曲线即可获得诊断阈值,进一步提高实际应用的可操作性。空气动力辅助离子化质谱组织涂片分析方法用于胶质瘤组织IDH基因状态的快速判别,有望为优化胶质瘤治疗流程、实现其精准诊疗提供技术支撑。此外,该方法对代谢物检出的高覆盖度也使其具有普适性,可推广至多种代谢标志物用于不同疾病的快速诊断。

