快速蒸发电离质谱技术及其应用研究进展
高海燕,孟宪双,付珺珺,王松莹,马 强*
(1.中国检验检疫科学研究院,北京 100176;2.内蒙古自治区产品质量检验研究院,内蒙古 呼和浩特 010070)
质谱作为一种高选择性和高灵敏度的定性定量分析技术,当前已成为许多学科的重要分析工具[1]。质谱分析依靠各种电离技术将样品分子转化成带电离子,并利用适当电场和磁场实现不同质荷比离子的分离,进而检测离子强度进行定量分析。其中,电离技术作为质谱分析中的前端关键技术,直接关乎样品的电离效率,对质谱仪的性能提升和应用范围具有至关重要的推动作用。目前,常规电离技术主要包括电喷雾电离(Electrospray ionization,ESI)、大气压化学电离(Atmospheric pressure chemical ionization,APCI)、基质辅助激光解吸电离(Matrix-assisted laser desorption/ionization,MALDI)、电子轰击(Electron ionization,EI)和化学电离(Chemical ionization,CI)等,它们均与质谱仪在线耦合,对预处理过的样品在一相对封闭的空间内进行电离。
随着社会经济和相关学科的发展,质谱分析不断面临新的挑战,传统质谱分析方法在应对复杂样品检测时逐渐表现出短板,繁杂而耗时的提取、分离、浓缩、净化等样品前处理过程往往降低和制约着分析效率。近年来,无需复杂样品前处理的原位电离(Ambient ionization,AI)技术成为质谱分析领域的研究热点,AI具有操作简便、分析速度快、机动性强(与便携式质谱联用时)、绿色环保等优势,在组织样本原位分析、复杂样品直接分析及表面分析等方面均取得了重大研究进展,大大拓展了质谱分析的应用领域[2-11]。以2004年Cooks等[12]研发的解吸电喷雾电离(Desorption electrospray ionization,DESI)和2005年Cody等[13]研发的实时直接分析(Direct analysis in real time,DART)电离技术为代表,各种新型原位电离质谱技术如雨后春笋般涌现,如纸喷雾电离(Paper spray ionization,PSI)[14-15]、探针电喷雾电离(Probe electrospray ionization,PESI)[16-17]、介质阻挡放电电离(Dielectric barrier discharge ionization,DBDI)[18-19]、萃取电喷雾电离(Extractive electrospray ionization,EESI)[20-21]、牙签喷雾电离(Wooden tip spray,WTS)[22]、涂层刀片喷雾电离(Coated blade spray,CBS)[23]、解吸声波喷雾电离(Desorption sonic spray ionization,DeSSI)[24]、空气动力辅助电离(Air flow assisted ionization,AFAI)[25]、熔滴电喷雾萃取电离(Fused droplet electrospray ionization,FDESI)[26]、组织喷雾电离(Tissue spray ionization,TSI)[27]等,这些原位电离技术除本身具备的实时、在线、活体分析等特性外,与小型装置的智能耦联将使现场快速分析变得前景广阔。
2009年,Takáts等[28]基于电外科和激光外科手术方式使生物组织快速热蒸发,产生大量组织源性信息的气体分子,从而提出利用快速蒸发电离质谱(Rapid evaporative ionization mass spectrometry,REIMS)技术进行体内、原位组织分析。REIMS技术采用一种创新性手持式采样技术,通过电离切割组织样本释放气溶胶,然后经导管将气溶胶直接吸入质谱仪检测。从样品切割到生成数据仅需几秒,可实现对标志性差异成分的鉴定。它消除了与样品制备相关的诸多限制,可在数秒内为分析人员提供具有样品高度特征性的精确分子轮廓图,可用作鉴定关键属性的“指纹”,反映样品的真实性、物种、质量或表型特征。本文综述了REIMS技术的发展历程、工作流程、电离机制以及近年来在医学、微生物鉴定、食品真伪鉴别、代谢物研究、药用植物成分鉴定等领域的应用研究进展,并对其前景进行了展望。

图1 早期REIMS组织分析实验装置的示意图[28]Fig.1 Schematic diagram of experimental setup of early REIMS for tissue analysis[28]
1 发展历程
组织样本中生物分子的质谱分析通常采用解吸附电离,如二次离子质谱(Secondary ion mass spectrometry,SIMS)[29-35]、MALDI[36-42]和DESI[12,43]。然而,解吸附电离技术对重要的活体组织分析并不能完全胜任。活体组织的快速加热过程使分子蒸发速率与分解速率相当,从而可形成大量气态分子或分子离子[28],因此具备组织成分原位、体内快速蒸发电离的可能性。最初,Holland等[44]提出在传热过程中,凝聚相样品可能形成有机离子,后来通过实验得到了证明[45-47]。因此,对高效热蒸发技术的探索研究直接推动了各种热辅助电离技术的发展,包括热喷雾电离(Thermospray ionization,TSI)[48]等。大气压下的热蒸发有望抑制热分解,并已被证明是组织样本中有机阳离子解吸附最低的热降解条件[49]。基于生物组织快速热蒸发能够产生含有组织成分(如磷脂)的气态分子离子以及电外科和激光手术在剥蚀或解剖组织时会产生具有生物特征烟雾的现象,2009年,Takáts等[28]首次将手术工具与质谱仪结合(图1),对猪肾脏组织进行分析,采用质谱库和主成分分析(Principal component analysis,PCA)开发了一套组织识别系统,为手术中组织的原位分析提供了可能,并将该技术命名为REIMS。在随后的十余年里该技术得到了迅速发展,并于2014年被Waters公司收购实现商业化。商业化的REIMS设备增加了辅助溶剂注射泵和源箱内通电流的高温发热体,有效提高了电离效率和稳定性,进一步提高了数据质量。目前,该设备以“仅供研究”的形式销售,应用范围越来越广,涉及医学组织鉴定、微生物鉴定、食品真伪鉴定、代谢物研究、药用植物成分鉴定等多个领域。
2 整机设备及工作流程
2.1 整机设备
由于组织的热蒸发现象在外科手术(如电外科和激光手术)过程中较为常见,最初的REIMS实验装置以外科手术器械作为离子源与质谱仪远程结合(图2A)。利用改进的外科手术器械作为样品处理探头直接向生物组织施加高频电流或激光照射,使组织快速受热,沿着手术器械的接触面快速蒸发,产生含有正负离子及中性粒子的气溶胶。借助文丘里泵和一根长2米、直径1/8英寸的聚四氟乙烯管(图2B),将气溶胶输送到质谱仪入口。文丘里泵被安装在源箱中,由400 kPa额定压力的氮气驱动,与质谱仪的加热毛细管入口垂直,以减少对大气界面的污染(图2C)。市面上用于排出有毒外科烟雾的装置,由于死体积大和样品被稀释等原因不适合离子的转移,而聚四氟乙烯(PTFE)管可在1~3米距离内传输离子,同时还能保留足够的离子数量用于质谱分析。选择2米聚四氟乙烯管远程分析,可实现较短的传输时间,同时避免实时实验之间的交叉污染。早期的REIMS研究采用高分辨质谱仪分析,通过精确质量测定来识别未知物的质谱特征,使用离子阱质谱仪和四极杆-飞行时间质谱仪进行菌株的盲样识别均可达到97%以上的正确率,而且快速蒸发电离与不同质谱仪结合得到的质谱轮廓也具有较高的重现性[50]。
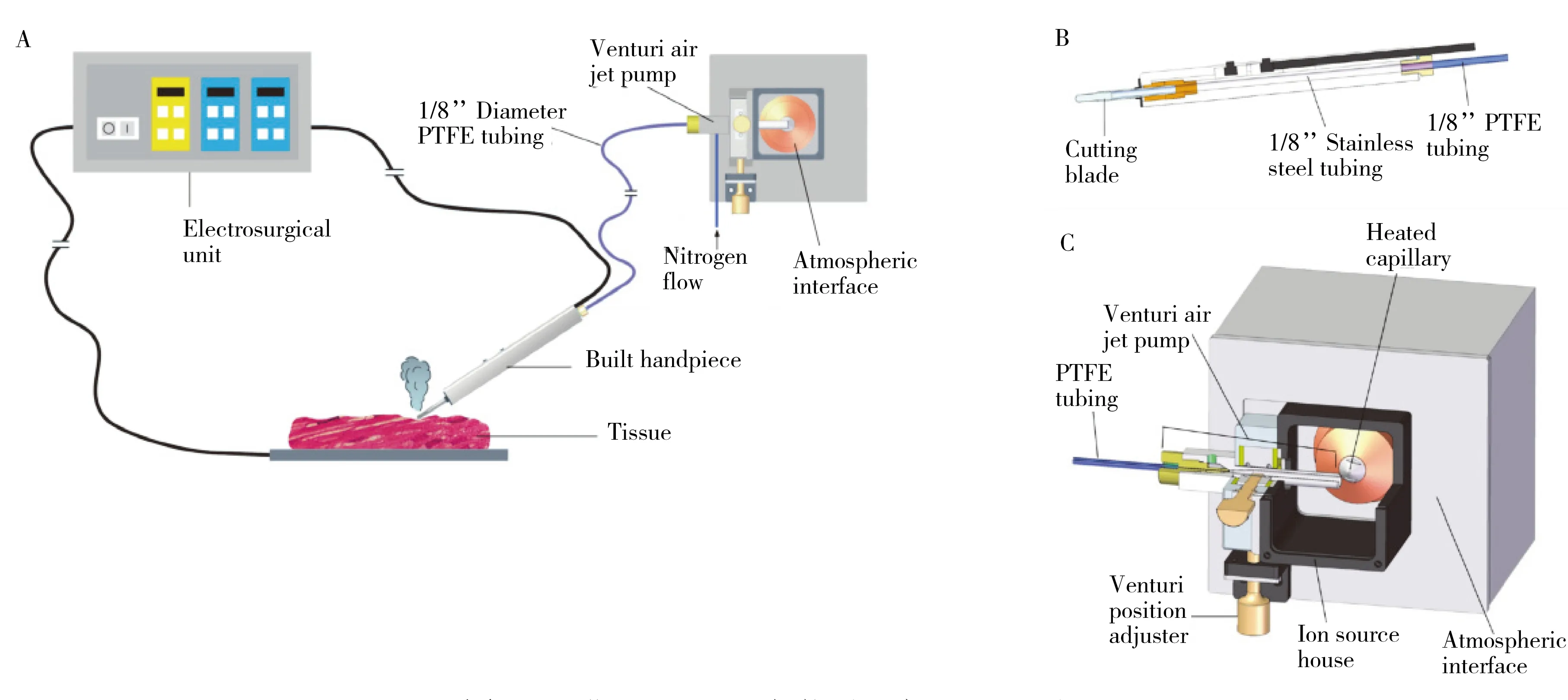
图2 早期REIMS设备装置示意图[51]Fig.2 Schematic diagram of the early REIMS device[51]
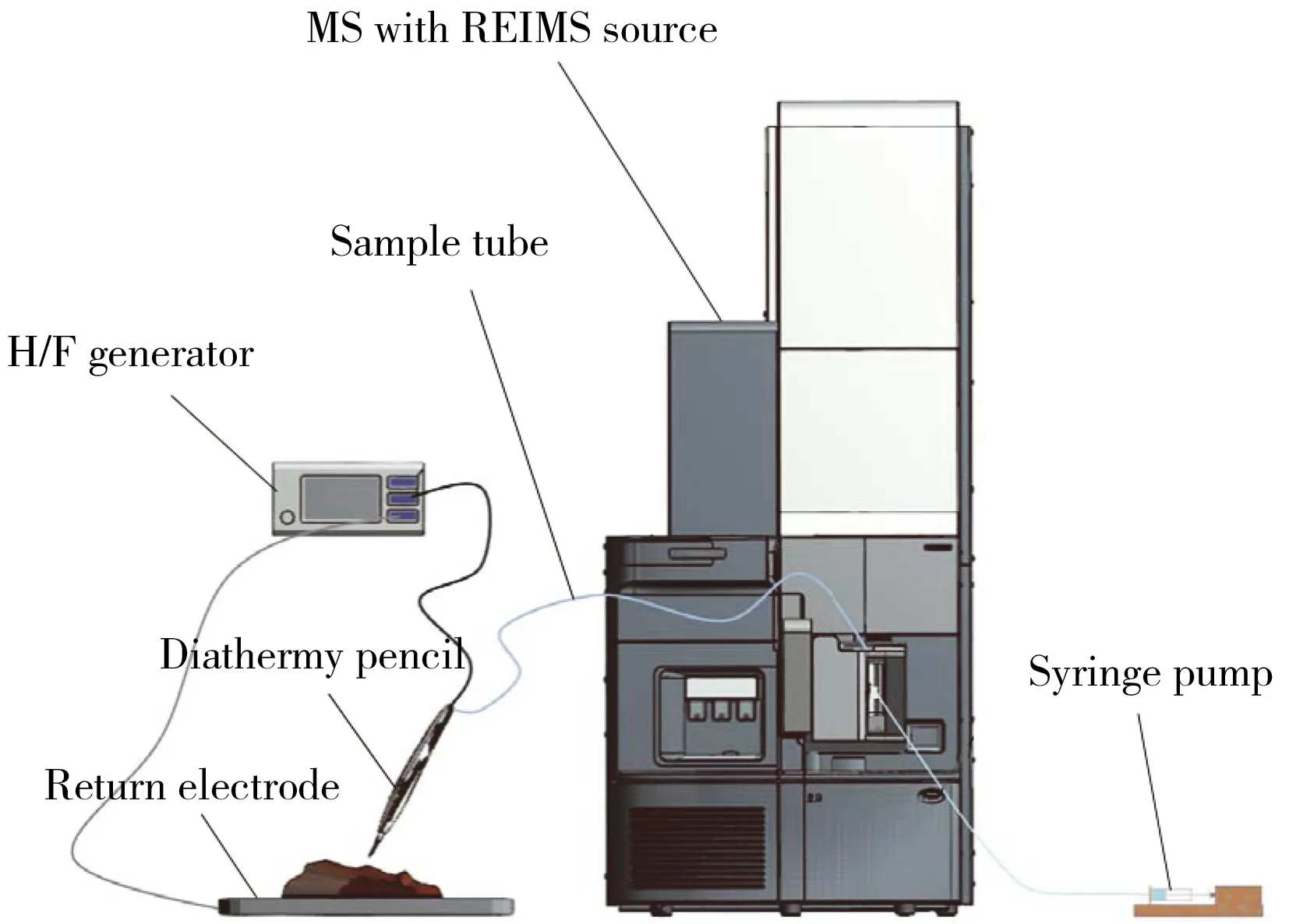
图3 iKnife集成快速蒸发电离质谱装置示意图Fig.3 Schematic diagram of the iKnife-REIMS system
随着REIMS技术的发展,该技术的发明者帝国理工学院Takáts教授和Waters公司合作开发的商业化REIMS设备得到了进一步完善(图3),该装置使用VIO 50C型高频发生器(可通过设置功率调节电流),集成iKnife手持式采样探头,在分析物气溶胶中引入2-丙醇作为辅助溶剂,提高了方法的检测灵敏度。通过去除仪器毛细管入口处的固体沉淀物,减少了质谱仪的污染,同时允许使用内标进行精确的实时质量校正[52]。此外,在质谱仪部分,使用了改进的大气压界面,使液滴与一个恒定电流的高温(~900 ℃)发热体碰撞后进入四极杆-飞行时间质谱仪,整个过程仅需数秒钟,结合统计学软件即可实现样品的实时鉴定分析。
2.2 加热方式
一般而言,快速蒸发电离质谱法涵盖了所有使凝聚相样品快速热诱导分解产生气态离子的方法。从这个角度上来看,加热方法有焦耳加热、接触加热和辐射加热等许多不同的实现方式。
2.2.1 焦耳加热电外科加热技术是一组利用高频电流焦耳加热进行组织剥蚀切割的操作方法。iKnife采用单极或双极透热手持探头(图4)对样品直接施加高频电流(在电极和样品之间能够观察到,不适用于非导电样品)。焦耳加热过程中因生物组织内存在一定的阻抗而引起电能的耗散从而造成了组织的热损伤,其主要的组织蒸发机制包含水分的迅速沸腾、蛋白质的变性/沉淀、细胞膜的崩解和饱含细胞碎片的水滴的形成[53-54]。在使用单极手持探头切割样品时,将整个样品置于返回电极(导电材料)之上,高频电流在一个闭合回路中流动,即从发电设备到单极切割电极,通过样品后到达返回电极,再从返回电极回到发电装置。在切割过程中,电极作用的样品局部为高密度电流,能够使样品快速蒸发,而其他接触到返回电极的样品表面为低密度电流,几乎不受热,因此,单极手持探头的优势主要在于操作简便;双极手持探头多采用一对手持式双电极,多为镊子形状,有两个电极尖端,不需要返回电极。双极探头在切割样品时,电流只在两电极尖端之间的组织区域流动而不流经整个样品,电流分布更均匀,离子生成率较单极探头方式低,在分析少量生物样本时,较单极装置更具优势(图5)。
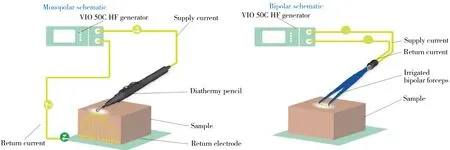
图4 REIMS采样装置示意图Fig.4 Schematic diagram of the sampling device of the REIMS equipment

图6 激光探针-快速蒸发电离质谱设备示意图[58]Fig.6 Schematic diagram of laser-assisted REIMS equipment[58]
2.2.2 辐射加热辐射加热包括均匀的红外激光剥蚀和激光解吸电离。激光手术是激光技术最早的应用之一,早在1960年已有相关报道[55-57]。在REIMS技术的早期研究中,使用激光照射(图6)使生物组织细胞内部分子吸收激光能量[58],实现局部加热,从而产生大量的组织源性气态离子。激光解吸电离可获得与电外科焦耳加热电离方式高度相似的质谱图[51](图7)。
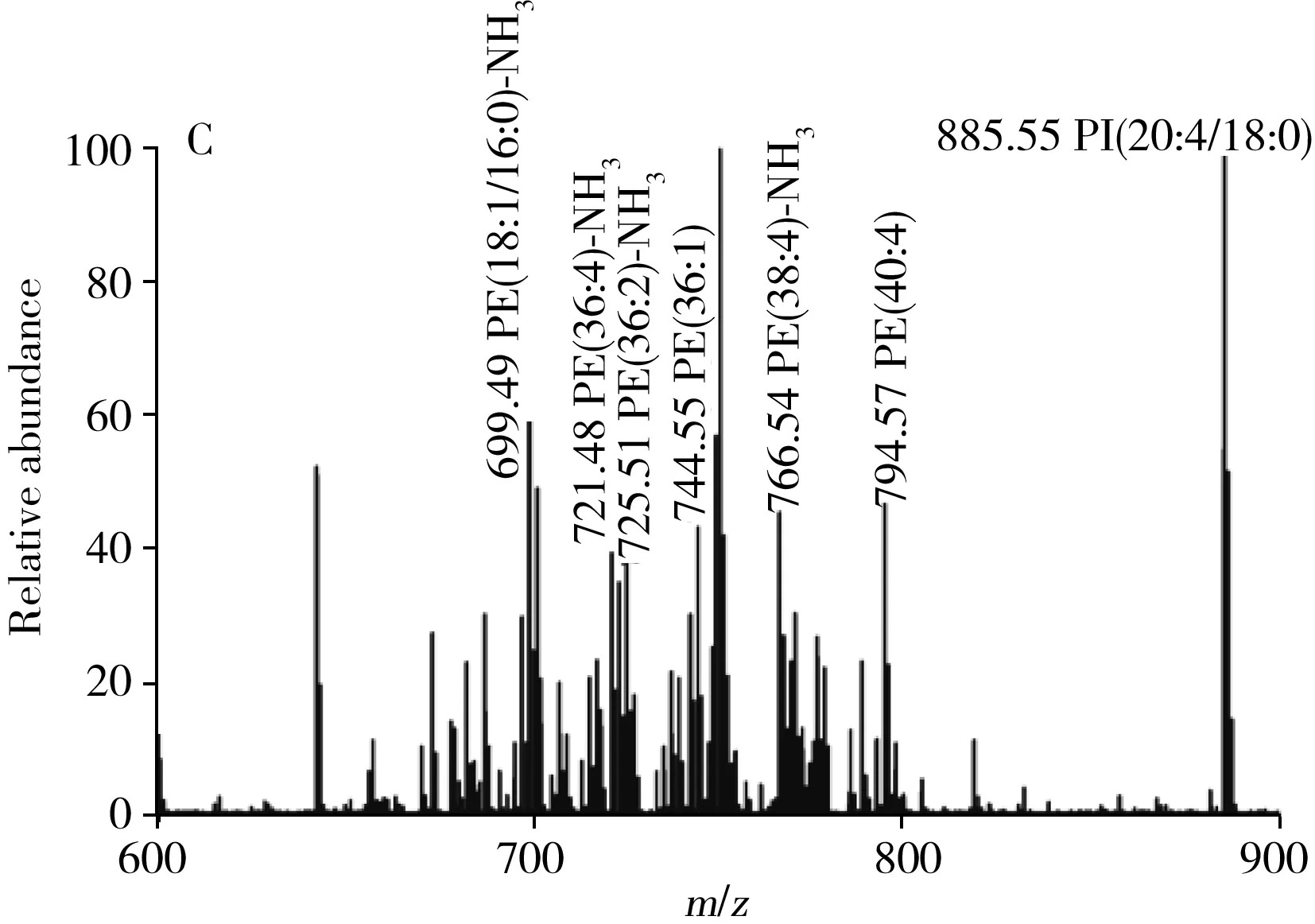
2.2.3 接触加热对于不导电的样品可采用电烙铁设备实现样品的快速蒸发。目前REIMS方法中使用的电烙铁设备通常由控制台、电烙铁、烙铁架构成。取样时,高温的电烙铁探针与样品直接接触,约0.5 s即可产生一股气溶胶,同时将连接质谱仪的聚四氟乙烯管置于电加热探针与样品接触位置上方,使含有丰富化合物信息的气溶胶直接吸入质谱仪进行分析[59-60](图8)。
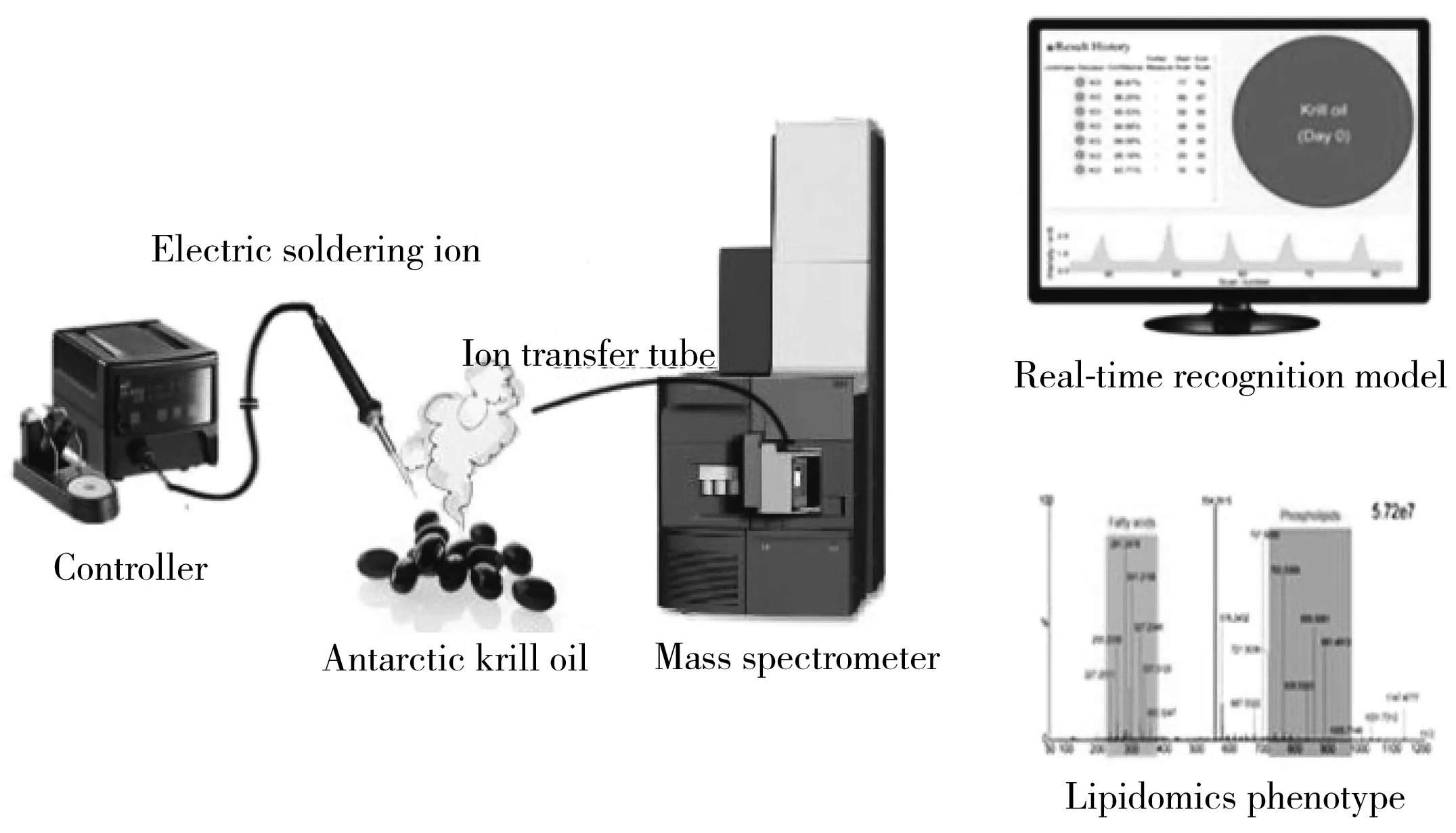
图8 REIMS工作流程示意图[60]Fig.8 Workflow diagram of REIMS[60]
2.3 工作流程
REIMS的一般工作流程为研究人员根据样品性质选择适合的采样装置进行切割,产生的气溶胶被吸入REIMS源,经充分电离后进入质谱仪获得特异性的质谱数据。实验过程中需优化仪器参数,选择最优仪器条件对样品进行数据采集,利用统计学软件分析质谱数据,根据样品属性及特异性指纹谱图数据建立分类模型,再对盲样进行检测获得实时的样品属性鉴定结果(图8)。

图9 不同的加热方式所得质谱图(A)及快速蒸发电离质谱实验源区的示意图(B)和(C)[52]Fig.9 Mass spectrometric characteristics of different heating methods(A) and a simplified illustration of the source region of REIMS experiment(B and C)[52]
3 电离机制
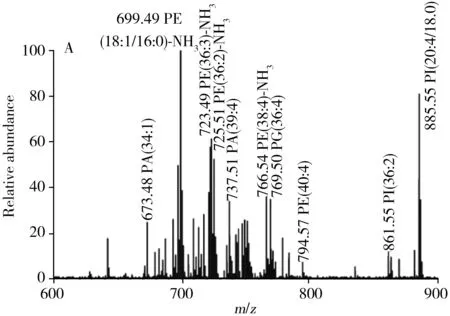
2009年,Takáts等[28]阐述了快速蒸发电离技术的离子形成机制。电外科设备进行组织剥蚀的机理是通过电流对导电组织进行焦耳加热,导致水分的蒸发和电离、蛋白分子的变性、沉淀及膜的溶解,最后由于强烈的空化作用和气泡的爆破使组织碎裂,形成雾化现象。在这种情况下,离子的生成可能遵循两种不同的机制:第一种机制是在电外科切割组织的过程中,中性分子解吸出来后通过与电离的水分子反应进行气相电离,因此大量电离水分子的存在是维持剥蚀过程的必要条件;这种机理与大气压化学电离机理非常相似。另一种机制是热诱导机理,这种机理认为在组织材料的快速热蒸发过程中会生成富含磷脂的液滴。与声波喷雾的气泡实验类似,既能生成中性液滴,也会生成带电液滴。液滴通过蒸发进一步分裂和浓缩,产生带电荷的磷脂团簇,磷脂团簇可进一步解离形成单个磷脂分子离子。同时,由于切割过程中蒸发和热降解同时发生,因此在质谱中能够同时观察到样品中磷脂成分的完整分子离子及其降解产物的离子信息。这种电离机理类似于灯丝关闭模式下的热喷雾电离[48,61]。2010年,Takáts等[51]为进一步阐明离子形成机理,研究了无放电过程中的组织蒸发方法,利用激光剥蚀和接触加热的单纯加热方式,得到了与电外科设备焦耳加热过程相似的质谱图(图9),表明这两种快速蒸发方式与电外科设备切割样品的离子形成过程遵循相似的机理,在电极与组织表面之间所观察到的射频电弧对离子形成的贡献较小,进一步支持了热诱导离子形成机制的假设。
此外,与其它将样品引入质谱仪的方式一样,只有当液滴(或团簇)在离子源区域内被充分蒸发释放出单个分子离子时,才能在质谱中看到分子离子信号。随着快速蒸发电离技术的发展,目前商品化的REIMS采用iKnife或电烙铁等设备切割或接触样品,迅速产生了含有丰富化合物分子或离子信息的气溶胶,并将其引入REIMS源中与雾化的辅助溶剂混合,随后与通电流的高温发热体表面发生碰撞(图9)。该设计使气溶胶中的分析物在有机溶剂中适当溶解,有助于混合物中超分子团簇撞击、去溶剂化、充分释放单个分子离子,同时促进样品气溶胶中性粒子的热电离,进而提高离子产率[52]。
4 应用研究进展
REIMS技术凭借无需任何萃取或净化程序即可快速对不同样品进行表征的优异性能,目前已在许多领域得到了广泛应用,其中部分典型应用实例见表1。

表1 快速蒸发电离质谱技术典型应用实例Table 1 Typical applications of REIMS
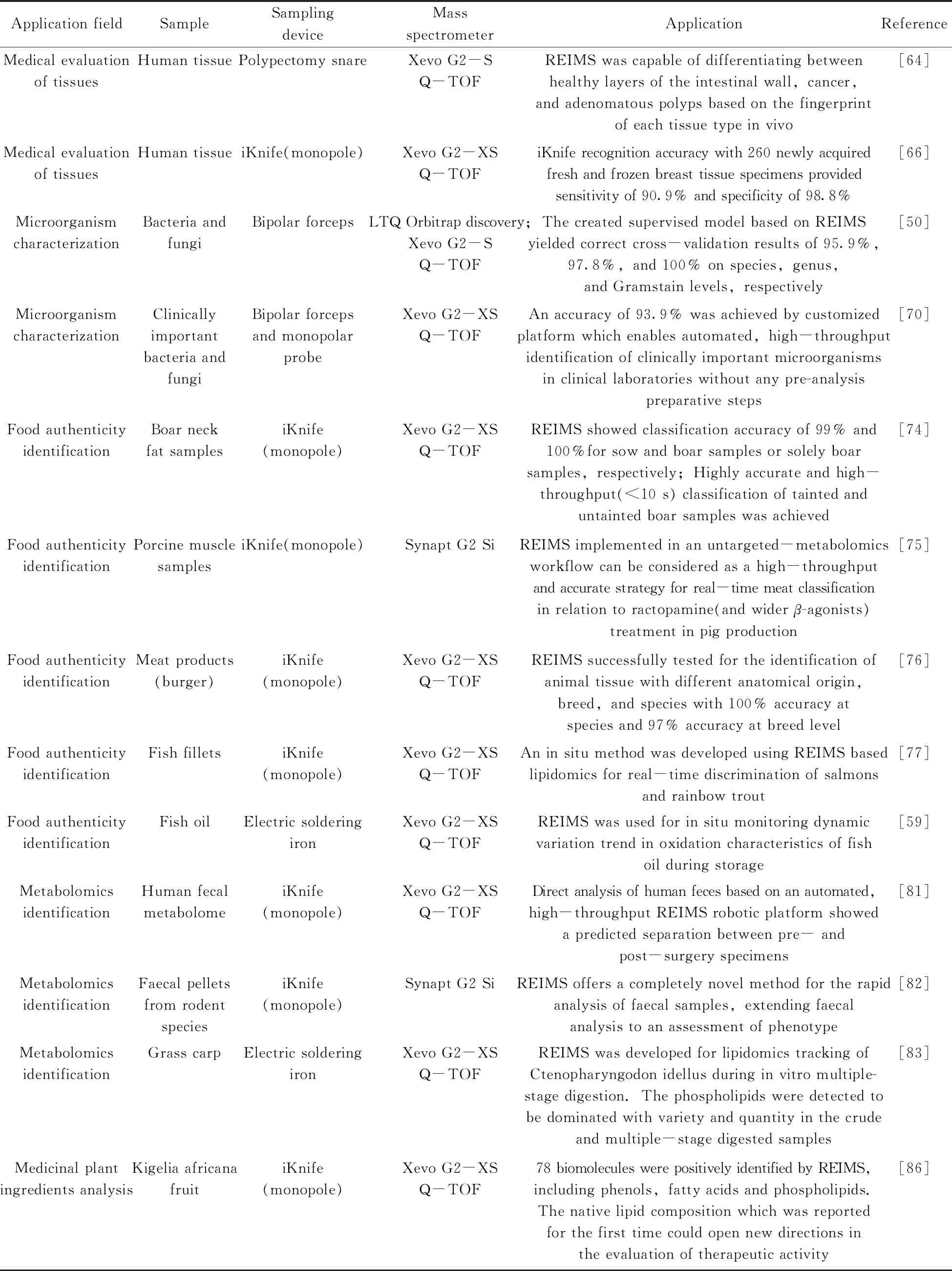
(续表1)
4.1 医学组织鉴定
电外科手术器械和质谱技术的结合为手术中组织的原位化学分析提供了可能,REIMS技术兴起之初就在医学外科领域展现出应用潜力。Takáts等[62]采用电外科设备结合质谱,分析了302名患者的多种组织样本,得到1 624个恶性和1 309个非恶性样本数据。这项技术随后被应用于手术室,与现有的电外科设备相连接,在81次手术中进行数据采集。采用多元统计方法分析质谱数据,精确区分了不同的组织和组织病理类型。术中REIMS的组织鉴定结果与术后组织学诊断符合率达100%;质谱图反映了不同组织学肿瘤类型以及原发性和转移性肿瘤之间的脂质体特征,疑似恶性的组织特征均被检出,可立即做出切除决定,为进一步发展质谱技术指导下的外科手术方法奠定了基础。该方法已成功应用于肿瘤切除术中恶性组织(包括转移瘤)的定位。Takáts等[63-64]利用REIMS与内镜下的息肉切除圈套相结合,在体内测试了这种新的内窥镜结合REIMS技术的分类性能。根据体内每种组织的REIMS指纹图谱,该技术能够准确区分肠壁的健康层、癌症和肿瘤淋巴结。Takáts等[65]采用REIMS技术对癌细胞系进行了快速质谱分析,发现了类间差异和类内差异的程度。随后,对NCI60细胞系组进行REIMS分析,并对所得数据集进行研究,以区分单个细胞系和不同的组织来源类型,最终证明REIMS可检测因支原体感染引起的细胞系脂质含量的变化,是一种极具潜力的细胞系研究方法。John等[66]基于脂质代谢的细微变化,对异质性乳腺组织进行实时iKnife-REIMS分析,理论验证数据显示该方法能够在术中在线收集和分析数据,但仍需进一步的验证研究来确定术中REIMS用于肿瘤边缘评估的准确性。Phelps等[67]对198名患者提供的335份组织样本进行REIMS分析,经交叉验证,卵巢癌组织与正常组织的分类敏感性和特异性可分别达到97.4%和100%,卵巢肿瘤与卵巢癌组织的分类敏感性和特异性分别可达90.5%和89.7%。Mason等[68]使用REIMS对直肠组织中的脂类进行化学分析,根据潜在的脂质生物学差异来区分直肠组织类型,对提高早期直肠癌切除术的疗效以及直肠癌组织切除的质量有一定的作用,有望为外科手术提供有效临床数据。
4.2 微生物鉴定
Takáts等[69]将细菌样本置于射频电流下,直接从完整的细菌细胞中获得REIMS指纹图谱。微生物样本因其非零阻抗而迅速升温,热诱导的细胞分裂导致产生含有代谢物和结构脂质的气溶胶,气溶胶可直接引入质谱仪进行在线化学分析。实验中对单极和双极采样装置的适用性进行了测试。两种装置均能产生完整细菌细胞的指纹图谱。根据9种细菌在不同生长介质上的质谱指纹图谱,建立分类模型,并对9种细菌进行了科、属和种的鉴定。Takáts等[50]利用双极钳子作为取样探针结合REIMS对28株临床相关菌株进行负离子模式分析,并对相关数据进行了多元统计分析。对分类模型进行交叉验证,在物种、属和革兰染色水平上分别获得了95.9%、97.8%和100%的正确率。对在不同培养基上培养的菌株进行盲样鉴定实验,并使用不同仪器平台进行了分析,鉴定正确率为97.8%~100%。对7株不同的大肠杆菌在不同培养条件下进行鉴定,准确率为88%。此外,在不改变实验流程的情况下,该技术可用于5种致病念珠菌的鉴别,准确率为98.8%。以上实验结果均证明了REIMS特异性强,可作为一种有效的微生物鉴定工具。该团队随后开发了一种自动化、高通量的适合临床微生物实验室使用的REIMS平台,通过分析从不同患者样本中收集的25种微生物的375个不同临床分离菌株,测试了该平台对临床重要微生物种类的鉴别能力,其中手持式双极探针和高通量探针的精度分别达到96.3%和93.9%。因此,该技术可在实验室中快速准确鉴定临床重要微生物,而无需任何分析前的准备步骤[70-71]。该团队继续对尖电极和圆形电极进行了优化,开发了圆管形电极,以增加与微生物生物量的接触面,从而最大限度地提高气溶胶产量进而提高物种级别的分类精度。优化后的REIMS电极在两种极性检测模式下物种级别的识别精度均得到了显著提高。Bardin等[72]对来自囊性纤维化患者的45株铜绿假单胞菌进行了代谢组分分析,并与80株非囊性纤维化患者铜绿假单胞菌进行比较。其中磷脂的信号强度最高,检出17种鼠李糖脂和18种群体感应分子,表明REIMS在研究细菌毒性相关代谢物方面具有潜力。
4.3 食品品质分析及真伪鉴别
化学成分筛选对于确保食品安全至关重要,虽然REIMS技术最初是为生物医学应用而开发,但后来也被证明是一种有价值的食品分析工具。Black等[73]将REIMS技术应用于5种基因相似的白鱼,对99份实际样品的鉴定准确性可达98.99%,而且速度极快(约2 s),可与任何其它形式的食品鉴别分析技术相媲美。Verplanken等[74]采用REIMS进行猪颈部脂肪中异味的快速检测。对150例样本进行非靶标筛查,基于采集的REIMS数据所建立的模型对母猪和公猪样本的分类准确率为99%,首次实现了有异味和无异味野猪样品的快速、高精度、高通量分类。Guitton等[75]采用REIMS与非靶向代谢组学结合,基于间接代谢物脂质图谱的改变,对β-激动剂处理的家畜肉样进行了直接分析和识别,分类准确率大于95%,完全符合筛选策略的要求,可准确、快速地测定动物在繁殖过程中接触莱克多巴胺的状况。Balog等[76]使用REIMS装置在不到5 s时间内采集了肉制品(鹿肉、马肉、牛肉)样本的指纹图谱并识别出不同品种和不同物种的动物组织,物种识别准确率为100%,品种识别准确率为97%。后经实验证明,该技术对其它物种的肉类的识别也具有较高的准确性。Song等[77]开发了一种使用iKnife和基于脂质组学的REIMS方法来实时鉴别三文鱼和虹鳟鱼。研究中共鉴定出12种脂肪酸和37种磷脂,利用统计分析建立了原位和实时识别模型,有助于揭示鱼肉种类的特性。随后,采用iKnife-REIMS技术结合脂质组学对金枪鱼品种进行了原位实时鉴定,并采用电烙铁集成REIMS技术对鱼油、南极磷虾油贮藏过程中的氧化特性进行了原位监测[59-60,78],为鱼品种识别及市场上的掺假评价提供了重要依据。Gredell等[79]根据美国农业部对牛肉质量等级、生产背景、品种类型和肌肉嫩度的要求,比较了8种不同的统计算法并生成预测模型,利用REIMS数据对牛肉品质属性进行分类。结果表明,最优统计学计算方法根据分类问题的不同而不同,用一刀切的方法评价REIMS数据预测模型是不合适的。Rigano等[80]利用REIMS技术建立了18种来自墨西拿海峡一块很小区域海洋物种的数据库,每个物种均获得了可靠的鉴定,置信度大于99%。并通过主成分分析和线性判别分析,建立了一个大模型和3个子模型,对每个类(如头足类)、目(如鲈形目)或科(如鲫科)的关键变量进行了准确识别。综上,REIMS技术为食品安全及真假鉴别的快速鉴定提供了一种可靠且相对简单的解决方案。
4.4 代谢物研究
目前,REIMS研究对象大多为生物个体、组织或代谢物,Cameron等[81]建立了一个自动化、高通量的REIMS平台用于人类粪便的直接分析并优化了分析参数。通过对5名健康男性受试者粪便样品的分析,鉴定出胆汁酸和磷脂标志物,并利用优化的REIMS参数对减肥手术患者的粪便样本进行了分析,表明REIMS具有检测临床干预引起的生物变化的分析敏感性。Davidson等[82]基于REIMS分析了5种不同啮齿类动物的粪便颗粒,然后利用质谱数据建立分类模型。结果发现,无论粪便来自于标准实验室饲养的动物还是捕获的野生动物,采用该方法均可以较高的准确率对物种进行分类,为粪便样品的快速分析提供了一种全新方法。Lin等[83]建立了一种快速REIMS方法,人工模拟口腔、胃和肠道消化,在体外追踪草鱼多阶段消化过程中的脂质体。结果表明,在粗消化和多阶段消化样品中以磷脂为主,酶对磷脂的影响因磷脂种类而不同,磷脂的水解速率随着酰基链不饱和程度的增加而增加。该方法在人体胃肠道消化吸收特征的快速脂质组学分析领域显示出巨大的潜力。Wijnant等[84]提出了唾液代谢组学的超高效液相色谱-高分辨质谱(Ultra-high-performance liquid chromatography-high-resolution mass spectrometry,UHPLC-HRMS)分析方法。在青少年超重的临床背景下,该方法能够定义唾液中生物学相关代谢物谱(鉴定出129种代谢物,其中45种被认为与肥胖有关)和指纹谱(检出6 500种代谢物),具有发现生物标志物和阐明途径的潜力。唾液可作为医疗领域中一种有价值的研究基质。该研究提出的唾液代谢组学激光辅助-快速蒸发电离质谱(Laser-assisted rapid evaporative ionization mass spectrometry,LA-REIMS)概念,与UHPLC-HRMS代谢物的覆盖范围相当,且LA-REIMS可根据体重状况实现分化。因此,该研究为唾液代谢组学提供了一个有效的UHPLC-HRMS和LA-REIMS的互补平台,为深入进行唾液代谢机理研究和快速鉴别指纹提供了技术参考。
4.5 药用植物成分鉴定
市面上约60%的抗肿瘤和抗感染药物来自天然产物[85]。Arena等[86]采用REIMS结合iKnife技术,未经任何萃取和净化过程即获得了非洲吊灯树果的代谢图谱,从而将该技术应用于植物化学成分研究。通过利用四极杆-飞行时间质谱与iKnife结合的优势,对这种植物物种进行了全面分析,结果鉴定出酚类、脂肪酸类、磷脂类等78种生物分子。过去这种水果因其类似药物的特性引起人们的特别关注,例如,可用于治疗不育、糖尿病及炎症、抗肿瘤、抗真菌和细菌感染等,这些特性均与酚类化合物相关。其中天然脂质成分为首次报道,为活性化合物的检测提供了新方向。
5 总结及展望
REIMS技术作为一种新型原位电离技术最初主要被用于医学组织的原位、实时、快速鉴定。近年来,随着REIMS装置“电离技术”的精细化设计与商品化,该技术逐渐广泛应用于微生物分析、食品真伪鉴定、代谢物鉴定、药用植物成分鉴定等领域,大大拓展了REIMS技术的应用范围。相信随着REIMS采样装置的多样化和精细化以及多元统计学分析软件的配套,该技术有望为更多领域研究提供新的解决方案。目前关于REIMS技术的文献报道中多为定性检测,在定量或半定量检测方面鲜见报道,如何采用REIMS技术进行精准定量分析也是未来重点研究的方向之一。

