亚微米电喷雾喷针在非变性质谱分析中的研究进展
张 宇,汤 扬,徐 伟
(北京理工大学 生命学院,北京 100081)
自1989年问世后,电喷雾离子化(ESI)技术便与质谱联用并广泛应用于蛋白质及其复合物的鉴定和解析[1]。随着质谱技术的不断发展,非变性质谱作为一项新兴技术应运而生。非变性质谱的研究重点是蛋白质复合物的结构、相互作用和动力学,其为结构生物学研究也提供了另一种可能。在非变性质谱分析前,通常需使用透析[2]、渗滤[3]或离子色谱[4]等方法从溶液中去除非挥发性盐,以提高质谱分析的灵敏度。然而,非挥发性高盐溶液是维持许多蛋白质结构和功能必不可少的条件,在生理环境条件下解析蛋白结构是大势所趋。目前一般是将蛋白质溶于乙酸铵等缓冲体系中开展分析。最新的研究证实,与传统的Theta喷针相比,亚微米喷针不仅能够实现溶液的快速混合,还具有纳升电喷雾电离(nanoESI)的其他特性,其中降低蛋白质的盐离子加合现象对蛋白质解析具有很大的优势[5-6]。本文结合前期的研究工作,总结了亚微米电喷雾喷针的特性,详细阐述其在蛋白质非变性质谱分析和寡核苷酸分析等领域的应用,并对该技术的未来发展趋势进行展望。
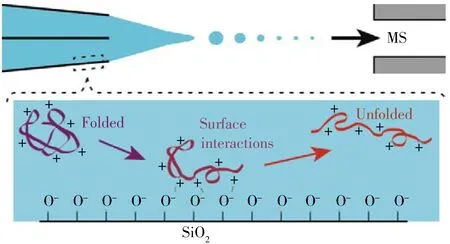
图1 亚微米喷针表面-蛋白相互作用诱导蛋白展开的示意图[8]Fig.1 Schematic graph of surface-induced protein unfolding in submicron electrospray emitters[8]
1 亚微米电喷雾喷针的特性
1.1 蛋白质电荷分布的改变
电荷态的分布情况是质谱解析蛋白结构的重要依据,近年研究表明蛋白离子电荷态的分布与其在溶液中呈现的结构具有强烈的依赖性[7]。nanoESI喷针的材质是硼硅酸盐玻璃,其表面在水溶液中带负电荷。带正电荷的蛋白质与带负电荷的玻璃表面之间的库仑力可能会诱导蛋白质结构的不稳定(图1)。相较于传统尺寸的电喷雾尖端,亚微米尖端具有更高的比表面积,库仑力作用也更为明显,进而可诱导蛋白质结构的展开和电荷态分布的变化。Williams等[8]对比了尖端外径在250 nm~1.5 μm之间的nanoESI喷针形成的蛋白离子的带电状态,对于在溶液中呈正电荷的蛋白质,使用较小尺寸的尖端可以诱导其加权平均电荷态向高电荷态转移,而带负电荷的蛋白质则无此现象。肌红蛋白在尺寸为305 nm的喷针尖端下产生较高的电荷态,并伴随有珠蛋白的谱图出现(归因于血红素的丢失),这双向验证了较小尖端具有诱导蛋白质结构变化进而改变电荷态分布的特性。
相较于常规电喷雾喷针,亚微米喷针在电喷雾过程中产生的初始液滴较小,其液滴寿命也随之变短。Mirza等[9]研究发现,蛋白质从大气压转移至质谱仪真空腔内的过程中,对电喷雾液滴施加高温很难诱导蛋白质电荷态的变化;但较高温度的金属传输管会诱导蛋白形成更高的电荷态。因此,缩短液滴寿命,使气态离子在质谱仪的大气界面处形成,在一定程度上可以预防蛋白结构的展开和高电荷态的形成。亚微米喷针从表面带电性质和液滴寿命两个方面影响蛋白质电荷态的分布,带负电荷的喷针表面可诱导带正电荷蛋白质结构的展开,短暂的喷雾液滴寿命可防止蛋白高电荷态的形成,故而经涂层处理的亚微米喷针可用于解析蛋白质的天然构象。
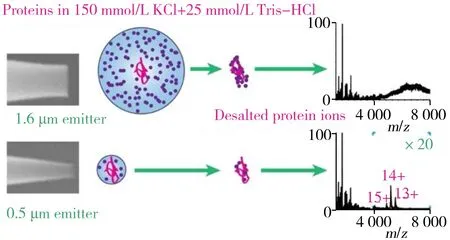
图2 亚微米喷针在电喷雾电离中的离子脱盐效应[12]Fig.2 Ion desalting in electrospray ionization with submicron emitters[12]
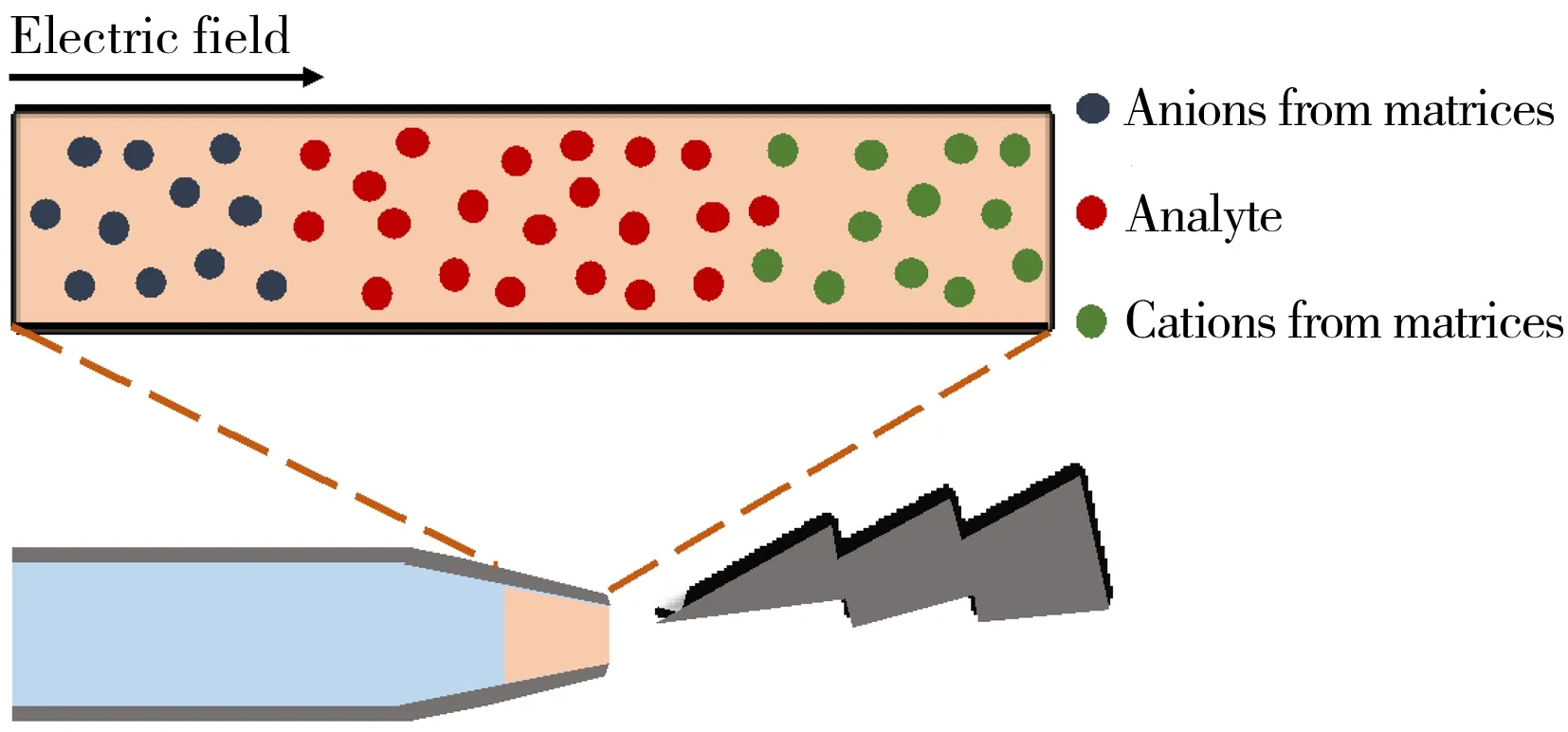
图3 分步电压纳米电喷雾方法分离分析物与基质的示意图[13]Fig.3 Schematic graph of step-voltage nanoelectrospray for the separation of matrices and analyte[13]
1.2 脱盐效应
特定的盐离子通过调节蛋白质之间的相互作用以及蛋白质与配体和辅助因子的结合来影响蛋白质的结构和功能[10-11]。然而,盐离子的加合会严重降低非变性质谱的性能,增强化学噪声并引起离子抑制,从而降低灵敏度。与传统尺寸尖端形成的具有1个以上蛋白质的较大液滴相比,亚微米喷针形成较小的初始液滴中含有的蛋白质数目不多于1个,其较低的盐与蛋白质比率会降低去溶剂化的蛋白质离子的盐加合现象,从而提高非变性质谱分析的准确度[12]。Williams等[12]进一步研究发现,亚微米喷针具有使蛋白质离子脱盐的特性,实验使用0.5 μm的尖端较好地解析了150 mmol/L KCl和25 mmol/L Tris-HCl(pH 7.0)缓冲溶液中的蛋白质和蛋白质复合物离子。相较于尖端直径大于1 μm的电喷雾喷针,亚微米喷针形成的蛋白质和蛋白质复合物离子的信噪比和分离度得到显著提高(图2)。
此外,电喷雾喷针尖端的电场强度随着尖端尺寸的减小而增加,因此亚微米喷针尖端处的电场强度更高。研究证明,喷针尖端的强电场作用可以降低盐离子的加合,进而提高信噪比。Wei等[13]开发了分步电压纳米电喷雾方法以消除基质对微量样品分析造成的干扰。在尖端处的强电场作用下,基质中的阳离子和阴离子以相反的方向快速迁移,形成前导带和拖尾带;而目标蛋白质由于低迁移率保留在中带区,从而实现了分析物与盐基质的分离(图3)。因此,亚微米喷针可从两方面降低盐离子的加合作用:产生低盐含量的初始液滴和于尖端处形成高电场强度。亚微米喷针的离子脱盐特性使其可直接从各种常用的高浓度非挥发性盐的缓冲液中进行蛋白质和蛋白质复合物的分析,省去了脱盐等样品预处理步骤。
1.3 蛋白信号的时间依赖性
相较于传统的喷针,亚微米喷针具有较小的扩散距离和极低的流速,这使得大多数的蛋白质能与其表面相互作用。当溶液流过喷针尖端时,溶液中的某些蛋白质全部吸附在尖端表面,直至尖端的吸附位点被全部占满且Zeta电位显著降低才会出现蛋白信号。因此,不同蛋白质的信号出现具有时间依赖性,这完全由蛋白质本身的性质决定。
Williams等[14]以4种常见蛋白质(泛素、溶菌酶、细胞色素c和还原性溶菌酶)为研究对象,发现蛋白质与喷针表面的作用强度与蛋白信号出现的时间顺序具有一定的相关性(图4)。喷针表面与不同蛋白质之间的结合亲和力不仅取决于蛋白质的净电荷和大小,还取决于带电氨基酸残基的暴露度。因此,在分析蛋白混合溶液时,目标信号的出现时间会根据蛋白质本身的性质不同而产生差异。这也表明在实验中使用此类小尖端时必须考虑表面效应,或者应考虑在喷针表面进行涂层处理以防止吸附。
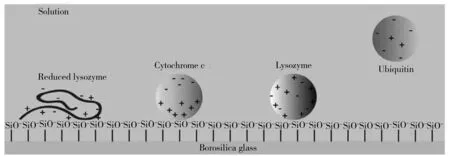
图4 还原性溶菌酶、溶菌酶、细胞色素c和泛素的蛋白质构象与电荷分布示意图[14]Fig.4 A schematic illustration of protein conformation and the distribution of charges of reduced lysozyme,lysozyme,cytochrome c and ubiquitin[14]
1.4 气态离子形成位置的改变
液滴寿命影响电喷雾电离中离子的形成位置,许多研究表明,去溶剂化的离子在质谱仪的大气界面处或内部形成[9,15-16]。液滴寿命取决于溶液的流速,其可通过改变喷针尖端直径或施加的电压强度来调节。Williams等[17]研究发现,使用亚微米级尖端(317 nm)产生的液滴寿命约1 μs,短暂的存活时间导致液滴无法进入离子源入口,因此其气态离子在质谱仪外部形成,故在乙酸铵或碳酸氢铵的缓冲体系下仅能观察到处于低电荷态的β-乳球蛋白离子。相反,由微米喷针形成的寿命≥10 μs的较大液滴可进入质谱仪,故其气态离子在质谱仪的内部形成。这表明在非变性质谱分析中使用亚微米喷针具有重大优势,它既消除了离子源温度对形成气态离子的影响,也消除了微米喷针形成的较大液滴中存在多个蛋白质分子时可能会发生的二聚化或聚集效应。
2 亚微米电喷雾喷针在质谱分析中的应用
2.1 模拟细胞环境下蛋白质的非变性质谱分析
在生物化学中,含有非挥发性盐的缓冲溶液常用于模拟细胞外和细胞内环境,其离子强度为150~200 mmol/L[18]。许多蛋白质和蛋白质复合物结构和功能的维持依赖非挥发性盐溶液,利用亚微米喷针的脱盐效应可在模拟细胞外和细胞内环境条件下解析蛋白质。Williams等[12]用制备蛋白质样品常用的缓冲溶液(150 mmol/L KCl和25 mmol/L Tris-HCl) 模拟细胞内环境,分别使用尖端尺寸为0.5 μm和1.6 μm的喷针进行蛋白质分析,使用1.6 μm喷针得到的谱图几乎全是盐簇离子峰,相比之下,尖端尺寸为0.5 μm的喷针则可直接解析高盐缓冲溶液中蛋白质和蛋白质复合物的电荷态分布(图2)。此外,Williams等[19]利用磷酸盐缓冲溶液(PBS)模拟细胞的外环境,使用亚微米喷针解析得到的蛋白质电荷态分布与在乙酸铵条件下使用微米喷针得到的结果极为相似,证实了亚微米喷针具有显著的离子脱盐优势。亚微米ESI尖端可直接从各种含非挥发性盐的缓冲溶液中分析蛋白质和蛋白质复合物,无需任何额外的样品前期准备工作,例如将缓冲溶液替换成铵盐溶液。该方法有望应用于无需样品制备或净化的条件下直接通过质谱监测细胞外液。
2.2 解析膜蛋白的电荷态分布
膜蛋白是目前最重要的药物靶标蛋白[20-21],全面解析膜蛋白结构和功能是新药研发的基础。由于膜蛋白的疏水性,它们一般通过封装在非离子或两性离子表面活性剂胶束中进行溶解,然后利用非变性质谱进行分析[22]。但这些表面活性剂会导致质谱峰加宽,并降低膜蛋白离子的信噪比[23]。Williams等[24]利用尖端尺寸为0.5 μm的亚微米喷针从150 mmol/L NaCl、25 mmol/L Tris-HCl和1.1%辛基葡萄糖苷溶液中解析膜蛋白离子的电荷态分布。离子表面活性剂通常比非离子表面活性剂能更有效地溶解膜蛋白,研究发现,亚微米ESI喷针尖端可同时用于非离子和离子表面活性剂溶液中膜蛋白的非变性质谱分析。与传统的nanoESI喷针相比,亚微米喷针尖端显著降低了高m/z区域的NaCl和表面活性剂簇离子的相对丰度,降低了化学噪声,从而为生物学家利用非变性质谱研究膜蛋白的结构、功能和动力学提供了可能。
2.3 实现寡核苷酸的质谱分析
碱性阳离子在决定核酸的结构和功能方面起着至关重要的作用[25]。它通过中和核酸骨架上磷酸基团的负电荷,降低相对链之间的静电排斥力,从而实现核酸的稳定折叠[26]。此外,二价阳离子(例如Mg2+)可与远端磷酸盐之间形成盐桥,以建立塑造整体拓扑结构的远程接触[27]。电喷雾电离质谱(Electrospray ionization mass spectrometry,ESI-MS)已成功用于评估靶核酸的结构[28]、稳定性[29]和结合特性[30-31]。然而,寡核苷酸的电喷雾质谱分析受非挥发性金属阳离子的干扰,金属离子的加合会导致信号抑制和分辨率下降。Hu等[6]首先提出纳米喷针(尺寸<1 μm,通常约为100 nm)可以大大减少肽或蛋白质的非特异性金属离子加合现象,并可以提高ESI-MS的基质耐受性。Williams和Fabris等[32]研究发现,在浓度高达10 mmol/L的Na+/Mg2+条件下分析19 mer寡核苷酸,与使用微米喷针相比,亚微米喷针的信噪比显著提高,且加合物和盐簇离子大大减少。这说明亚微米喷针的脱盐效应不仅适用于解析蛋白质,也可用于负离子模式下分析寡核苷酸样品。此外,使用亚微米喷针消除了Mg2+与游离分析物的非特异性加合对实验结果造成的干扰,为估算在溶液中形成特异性配合物所需金属离子的数量提供了可能。
2.4 测量配体-蛋白质的结合亲和力
蛋白质与配体之间的相互作用对于维持细胞的正常功能至关重要[33-34]。在非变性质谱分析中,高离子强度的非挥发性盐通常被用于稳定配体-蛋白质的结构,并可高灵敏度直接测量配体-蛋白质的相对结合亲和力[35-37]。ESI-MS是一种具有超高灵敏度的快速检测小分子与蛋白质之间相互作用的有效方法,使用亚微米电喷雾喷针替换传统喷针可以实现对蛋白质样品的有效脱盐。Nguyen等[38]研究发现,亚微米喷针可在高浓度非挥发性盐和常见生化缓冲液的存在下测量小分子与蛋白质的结合亲和力。亚微米喷针的脱盐效应提高了质谱分辨率,可在单个谱图中同时获得至少6个配体与单个蛋白质靶标的结合亲和力,且这些蛋白质-配体的相对质量差异仅为0.06%。这表明亚微米喷针能够显著减少盐和非挥发性分子与蛋白质复合物的加合现象,从而更准确地测量配体与蛋白质的结合常数。此外,传统生化分析方法难以研究的多种不同配体与单个蛋白质靶标之间的协同作用也可通过非变性质谱进行定量分析。
3 展 望
亚微米喷针在蛋白质脱盐和非变性质谱解析等方面具有明显的优势,已成功用于生理环境条件下膜蛋白和寡核苷酸解析等领域。亚微米喷针拓宽了非变性质谱分析的应用范围,未来研究将会在蛋白质复合物、核酸和蛋白质-核酸复合物等生物大分子结构解析中进一步评估亚微米喷针的性能。然而,在研究中必须考虑到ESI喷针尖端尺寸对溶液中蛋白质构象的影响以及蛋白吸附效应。通过对喷针表面进行处理有助于消除喷针对蛋白质的吸附效应。
最新研究发现,微米级的nanoESI源存在纳米孔效应,所测分析物的几何形状可作为质谱信息的补充。尖端孔径为1.5 μm的喷针既可作为nanoESI源将样品离子化,也可作为纳米孔检测微生物的形状[39]。相较于传统的nanoESI源,亚微米喷针的尖端尺寸更小,其纳米孔效应为生物大分子(如蛋白质、蛋白质复合物和核酸)的三维结构解析提供了可能。随着亚微米喷针性能的不断提升和优化,其在蛋白质复合物等生物样品分析中的应用研究有望进一步深入和拓展。

