染色质解旋酶DNA结合蛋白对舌鳞状细胞癌CAL27细胞侵袭和转移影响的研究
胡凯莉 范欣 胡温庭 李洪利 唐清华 孙学辉
1.潍坊医学院口腔医学院,潍坊261053;2.潍坊医学院附属医院口腔科,潍坊261000;3.潍坊医学院附属医院口腔颌面外科,潍坊261000;4.潍坊医学院医学研究实验中心,潍坊261053
舌鳞状细胞癌是口腔鳞状细胞癌最常见的类型[1],其发展速度较快,相较于其他类型口腔鳞状细胞癌更具有侵袭性[2],舌鳞状细胞癌可引起语言功能障碍、妨碍咀嚼、吞咽困难等口腔症状[3]。而且舌部血运丰富,活动频繁,这些特殊的解剖结构使得癌症转移率高于其他类型的口腔鳞状细胞癌[4]。
据报道[5],早期患者预后良好,但是如果发生隐匿性转移,患者死于疾病的风险将增加5 倍,5年生存率由85.5%下降至48.5%。Wang 等[6]的研究表明,口腔鳞状细胞癌的复发率为32.7%,只有31.8%的复发患者可以存活5 年,而在没有复发的患者中,79.9%可以存活5 年。因此明确舌鳞状细胞癌的侵袭转移机制,可为临床上抑制舌鳞状细胞癌的侵袭转移提供新的靶点和实验依据。
肝癌细胞中分离出来的染色质解旋酶DNA 结合蛋白(chromodomain helicase/ATPase DNA binding protein 1-like gene,CHD1L),属于氟化亚锡2家族的亚家族[7]。该家族蛋白主要参与细胞核活动,调节转录,维持染色体完整性和DNA 修复[8]。CHD1L 在肝癌、食管鳞状细胞癌和小细胞肺癌中表达异常,并且与肿瘤进展和预后具有显著相关性[9-11]。本课题组前期实验[12]证明,CHD1L 在乳腺癌发生发展中具有促进作用,但是CHD1L 在舌鳞状细胞癌的表达及作用机制尚未明确阐述,因此本研究旨在探索CHD1L 在舌鳞状细胞癌侵袭和转移的作用,有望为临床抑制舌鳞状细胞癌侵袭转移提供新的思路。
1 材料和方法
1.1 材料
Lipofectamine 2000 脂质体转染试剂、Beyo-ClickTMEdU 细胞增殖试剂盒(上海市碧云天生物技术有限公司);β 肌动蛋白单克隆抗体、兔抗人CHD1L、上皮钙黏着蛋白和波形蛋白单克隆抗体(Abcam 公司,英国);人正常皮肤细胞HaCaT 由潍坊医学院医学研究实验中心保存,人舌鳞状细胞癌CAL27 细胞由上海市口腔颌面部肿瘤组织样本及生物信息数据库专业技术服务平台赠送。
1.2 方法
1.2.1 运用数据库检索CHD1L 在头颈鳞状细胞癌中的表达和与头颈鳞状细胞癌患者预后的关系 舌鳞状细胞癌是头颈鳞状细胞癌主要亚型之一[13],因数据库未对头颈鳞状细胞癌详细分组,因此拟通过检索CHD1L 在头颈鳞状细胞癌的表达来评估CHD1L 在舌鳞状细胞癌的表达。Ualcan 数据库数据源于TCGA 数据库,是一个包括31 种癌症、数千个肿瘤样本的基因数据。以“CHD1L”和“Head and Neck squamous cell carcinoma(HNSC)”为关键词在Ualcan 数据库(http://ualcan.path.uab.edu/analysis.html)检索CHD1L 在HNSC 组织和正常组织的表达以及按淋巴结转移数量分组后各组中的相对表达情况。通过GEPIA 数据库(http://gepia.cancer-pku.cn/index.html)中检索头颈鳞状细胞癌患者CHD1L的表达与患者生存的关系。
1.2.2 细胞培养 人舌鳞状细胞癌细胞CAL27和人正常皮肤细胞HaCaT 用含10%胎牛血清的高糖型Dulbecco 改良的Eagle 培养基(Dulbecco's modified eagle medium,DMEM),于37 ℃、5%CO2培养箱中培养。CHD1L 质粒转染方法参照文献[14],将CHD1L 敲除质粒和敲除对照质粒分别转染进入人舌鳞状细胞癌细胞CAL27。将转染后细胞命名如下:1)SiCHD1L/CAL27 组:转入CHD1L 敲除质粒;2)Scr/CAL27 组:转入CHD1L 敲除对照质粒。
1.2.3 蛋白质印迹检测 为检测人正常皮肤细胞HaCaT、人舌鳞状细胞癌细胞CAL27以及Scr/CAL-27 组细胞和SiCHD1L/CAL27 组细胞中CHD1L 的表达情况,使用裂解液将各组细胞裂解,提取总蛋白。上样,进行十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE),随后参照蛋白标记切取蛋白β 肌动蛋白、CHD1L、上皮钙黏着蛋白和波形蛋白对应的条带,转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上。封闭,清洗,敷对应的一抗,4 ℃过夜。再次清洗后敷二抗,曝光。一抗抗体配制比例分别为CHD1L(1∶1 000);上皮钙黏着蛋白(1∶1 000);波形蛋白(1∶1 000);β肌动蛋白(1∶1 000)。
1.2.4 EdU 增殖实验 为了分析CHD1L 对舌鳞癌细胞CAL27增殖能力的影响,使用带有Alexa Fluor 594的BeyoClickTMEdU细胞增殖试剂盒进行EdU染色。首先用磷酸缓冲盐溶液(phosphate buffered saline,PBS)轻轻冲洗细胞,然后加入新鲜的常规培养基,再加10 μL EdU 工作液与培养液混匀。将细胞在37 ℃、5%CO2下孵育2 h。温育后,再次用PBS 清洗细胞以除去培养基和游离的EdU探针。然后室温下于4%多聚甲醛中固定15 min,PBS 清洗3 次。室温下用含0.3% Triton X-100 的PBS孵育15 min。PBS清洗1~2次,加入200 μL 的点击反应缓冲液、CuSO4、Azide 594 和点击反应添加剂溶解液的混合物,孵育30 min,同时避光保存。PBS 清洗玻片,30 ℃避光条件下Hoechst 33342 染色10 min,吸出染色剂,PBS 再次洗涤后,激光共聚焦显微镜拍照。每组实验重复3次。1.2.5 伤口愈合实验 为检测CHD1L 对人舌鳞癌细胞CAL27 迁移能力的影响,实验将Scr/CAL27和SiCHD1L/CAL27 细胞悬液分别接种至六孔板中,并在完全培养基中生长至80%左右,用10 μL的枪头沿直尺在六孔板中央划条直线,PBS 洗涤几次,含1%胎牛血清的培养液继续培养。在光学显微镜下拍摄照片,记录愈合过程。
1.3 统计学分析
所有实验数据均用SPSS 20.0 统计学软件进行处理,各组样本间采用独立样本t检验,认为P<0.05差异具有统计学意义。
2 结果
2.1 数据库检测结果
通过Ualcan 网站分析TCGA 数据库中CHD1L在头颈鳞状细胞癌组织和正常上皮组织的差异表达情况,结果与正常上皮组织相比,CHD1L 在头颈鳞状细胞癌组织中表达升高(P<0.000 1,图1A),且淋巴结转移数量>9 个的头颈鳞状细胞癌患者的CHD1L 的表达量高于淋巴结转移数量≤3个的患者(P<0.05,图1B),结果表明:CHD1L 在头颈鳞状细胞癌中起着癌基因的作用,并且与淋巴结转移有关。GEPIA 数据库的分析结果表明:高表达组的总生存率明显低于低CHD1L 表达组(P=0.017,图1C)。由此可见,CHD1L 在头颈鳞状细胞癌发生发展中起着重要作用而且与患者预后相关。
2.2 蛋白质印迹检测CHD1L的表达结果
蛋白质印迹检测结果显示:人舌鳞状细胞癌细胞CAL27中CHD1L的表达量明显比在人正常皮肤细胞HaCaT 中的表达量高(P<0.05,图2 左),CHD1L 在SiCHD1L/CAL27 组细胞中的表达明显低于Scr/CAL27组细胞中的表达(P<0.05,图2右)。
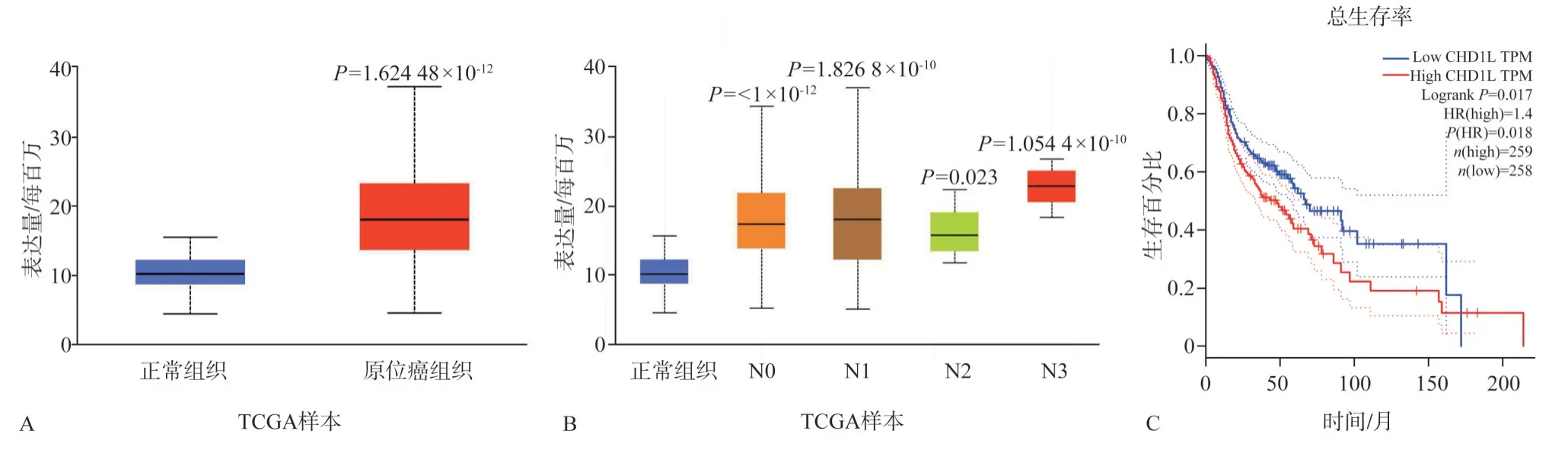
图1 CHD1L在头颈鳞状细胞癌组织中的表达及与患者生存分析Fig 1 Expression of CHD1L in squamous cell carcinoma of the head and neck and its survival analysis
2.3 EdU增殖实验结果
在激光共聚焦显微镜观察下,EdU 阳性细胞表现为红色,Hoechst 33342 染色细胞核呈蓝色。EdU 增殖实验检测的结果显示:SiCHD1L/CAL27组EdU 阳性的细胞百分比明显低于Scr/CAL27 组,这表明在CHD1L敲除后,舌鳞状细胞癌CAL27细胞的增殖能力明显受到了一定的抑制(P<0.05,图3)。
2.4 伤口愈合实验结果
通过对比同一视野下0 h 和24 h 的细胞照片发现,CHD1L 低表达使人舌鳞状细胞癌细胞CAL27的迁移能力明显减弱(P<0.05,图4),这提示,CHD1L 在人舌鳞状细胞癌细胞CAL27 的迁移中发挥了促癌作用。
2.5 蛋白质印迹检测EMT相关蛋白的表达结果
蛋白质印迹检测结果显示:SiCHD1L/CAL27细胞的上皮钙黏着蛋白表达量明显高于Scr/CAL27细胞,而波形蛋白表达量低于Scr/CAL27细胞(P<0.05,图5)。这表明,CHD1L 通过促进人舌鳞状细胞癌细胞CAL27 的EMT 进而使肿瘤细胞获得侵袭性。
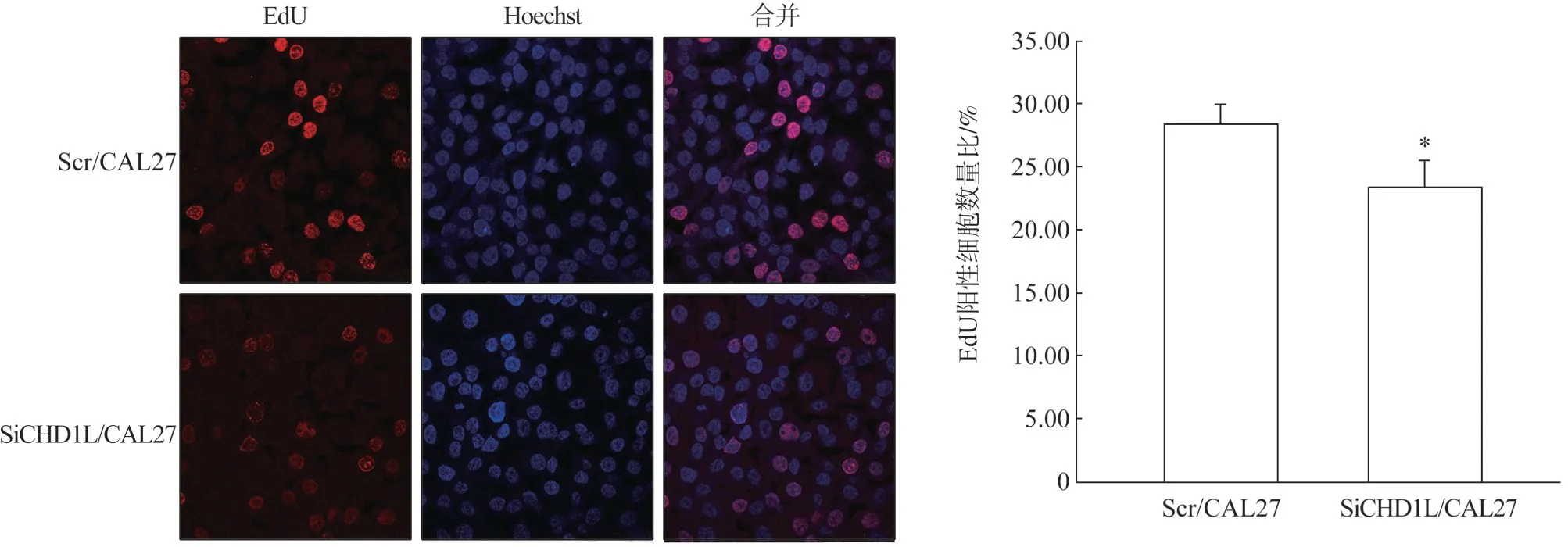
图3 CHD1L对Scr/CAL27和SiCHD1L/CAL27增殖能力的影响Fig 3 Effect of CHD1L on the proliferation ability of Scr/CAL27 and SiCHD1L/CAL27 cells

图4 CHD1L对Scr/CAL27和SiCHD1L/CAL27迁移能力的影响Fig 4 Effect of CHD1L on the migration ability of Scr/CAL27 and SiCHD1L/CAL27 cells
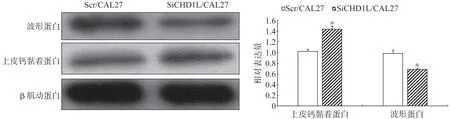
图5 EMT相关蛋白在Scr/CAL27和SiCHD1L/CAL27的表达情况Fig 5 Expression of EMT related proteins in Scr/CAL27 and SiCHD1L/CAL27 cells
3 讨论
舌鳞状细胞癌是口腔颌面部高发肿瘤之一,约50%左右患者可以生存5 年,但是TNM-Ⅳ期患者仅15%的患者可生存5 年[15]。据报道[16-17],侵袭性及高转移是肿瘤致死的主要原因,所以明确舌鳞状细胞癌的侵袭和转移机制有助于临床舌鳞状细胞癌的诊治。本课题组前期研究发现,CHD1L对乳腺癌进展具有明显促进作用,为了解CHD1L对舌鳞状细胞癌发生发展的影响,本实验首先通过生物信息学技术,明确了CHD1L 在头颈鳞状细胞癌的表达情况及其对患者预后的影响。通过分析TCGA 数据库信息发现,CHD1L 在头颈鳞状细胞癌中的表达比在正常上皮组织内高,且CHD1L的表达与淋巴结转移有关,该结果表明CHD1L 可能对头颈鳞状细胞癌的侵袭转移有促进作用。通过分析GEPIA 数据信息显示,CHD1L 的高表达可引起患者不良预后。
为了解CHD1L 在人舌鳞状细胞癌细胞CAL27中的表达情况,进一步进行了蛋白质印迹实验,发现CHD1L在人舌鳞状细胞癌细胞CAL27中表达比在人正常皮肤细胞HaCaT 中表达量高,这与生物信息学结果的趋势相符。为进一步了解CHD1L对人舌鳞状细胞癌细胞CAL27 侵袭转移的影响,实验运用常规的RNA 干扰方法,敲除了人舌鳞状细胞癌细胞CAL27 中CHD1L 的表达,检测了CHD1L 对人舌鳞状细胞癌细胞CAL27 增殖和迁移能力的影响,结果显示CHD1L 表达降低后,人舌鳞状细胞癌细胞CAL27 的增殖能力和迁移能力明显降低,这表明CHD1L 可以增加舌鳞状细胞癌细胞的增殖和迁移能力。
EMT 使细胞之间失去细胞接触,进而获得迁移能力,控制癌症的侵袭和转移[18]。Lyons等[19]通过将不同荧光标记的EMT 细胞和非EMT 细胞混合,进行小鼠皮下注射,发现原发肿瘤的侵袭特点仅与源自EMT 细胞的肿瘤侵袭性一致,且EMT细胞协助了非EMT 细胞侵入血管。波形蛋白、锌指转录因子2 和上皮钙黏着蛋白等蛋白既是EMT激活因子又是EMT 特征性标志物,常通过检测这些标志物的变化来反映EMT 过程[16]。有研究[20]证实,相较于癌前病变和正常上皮来说,皮肤鳞状细胞癌细胞膜上的上皮钙黏着蛋白表达量明显上调。此外还有研究[21]显示,波形蛋白和β-连环蛋白等蛋白在转移性皮肤鳞状细胞癌内表达上调,而上皮钙黏着蛋白下调。Wang等[22]发现,舌鳞状细胞癌中存在EMT,并且对舌鳞状细胞癌细胞的侵袭转移具有促进作用。CHD1L 最早被发现于肝癌细胞,与肿瘤的进展和患者预后具有明显相关性[23-24]。本课题组前期实验[12]表明,微小RNA-504靶向调控CHD1L 的表达,进而能够抑制乳腺癌细胞的侵袭。Chen等[23]通过动物实验则发现,CHD1L 通过增加细胞运动并通过鸟嘌呤核苷酸交换因子基因介导的Cdc42,激活诱导丝状伪足形成和EMT,来促进肿瘤细胞的迁移、侵袭和转移,并且他们还在人肝癌组织侵袭性前端发现了CHD1L 表达量的增加。本实验结果显示,敲低CHD1L 表达后,人舌鳞状细胞癌细胞CAL27 的EMT 相关蛋白上皮钙黏着蛋白表达量增高和波形蛋白表达量降低,这表明CHD1L 可以促进舌鳞状细胞癌细胞的EMT。
综上所述,本研究结果表明CHD1L 在舌鳞状细胞癌细胞中特异性高表达,并且能够促进舌鳞状细胞癌细胞EMT,进而提高肿瘤细胞的增殖、迁移和侵袭能力。因此,CHD1L 在影响舌鳞状细胞癌侵袭转移方面起着重要的促进作用。此研究有望为临床抑制舌鳞状细胞癌的增殖、侵袭转移提供新的思路。
利益冲突声明:作者声明本文无利益冲突。

