SNHG6:一种新的肿瘤标志物和治疗靶点
吕音霄 综述 王晓飞,朱晔涵 审校
苏州大学附属第一医院呼吸与危重症科,江苏 苏州 215000
全球范围内,癌症一直保持着高发病率和高死亡率,并且预计在未来几十年内还会维持现状甚至增加[1]。据估计,2/3癌症导致的死亡发生在低收入和中等收入国家,这给国家和患者家庭都带来了巨大的经济负担[2]。但发达国家癌症的存在同样不容小视,根据美国癌症协会(ACS)、疾病控制和预防中心(CDC)、国家癌症研究所(NCI)和北美中央癌症登记协会(NAACCR)的最新数据,美国2019年预计新增癌症病例1 762 450例,癌症死亡人数为606 880人,且癌症发病年轻化趋势逐渐明显[3]。为了对抗癌症,对其发生发展机制及治疗策略的研究投入不遗余力,但癌症患者的预后和生存质量仍不尽如人意,晚期肿瘤患者更是如此[4]。近年来,在长链非编码RNA(lncRNA)与癌症分子机制的相关研究方面取得了进展,对于提出新的治疗策略可能具有指导性意义[5]。
众所周知,能够编码蛋白质的RNA片段只占总的RNA 片段的极少数,而不具备蛋白质编码潜力的RNA 序列被称为非编码RNA(ncRNA)[6]。它们曾经被认为是无用的“转录废物”,但如今越来越多的证据表明它们可能从多个方面在人体各类病理生理活动中起调控作用,包括染色质重塑、转录后修饰和信号转导[7]。长链非编码RNA(long non-coding RNA,lncRNA)是ncRNA 家族的重要成员,它是长度大于200个核苷酸的非编码RNA的总称[8]。研究表明,lncRNA在剂量补偿效应、表观遗传调控、细胞周期调控和细胞分化调控等生命活动中发挥着重要作用,而它在癌症分子机制中的作用近年来更是成为了研究热点[9]。
核仁小分子RNA 宿主基因6(SNHG6)是lncRNA中的一种,它被检测到在多种肿瘤组织中表达上调,这意味着它可能参与了肿瘤的发生和进展,有潜在的调控作用[10]。本文就SNHG6 与多种肿瘤的关系及其可能的发生机制进行了综述。
1 lncRNA及与肿瘤的关系
LncRNA 是长度超过200 个核苷酸的ncRNA,过去它们曾被认为无足轻重,但近些年来越来越多的研究表明lncRNA与人体疾病的发生发展有密切的关联,尤其是与肿瘤的增殖分化、侵袭转移的相关细胞过程有关[11]。例如,HOTAIR是一个著名的lncRNA,研究发现它在结直肠癌、前列腺癌等多种肿瘤组织中表达上调,被认为参与了肿瘤细胞增殖、转移的进程[12-13]。另一种常见的lncRNA 浆细胞瘤可变异位基因1(PVT1)在前列腺癌组织中过表达,而PVT1基因敲除可显著抑制前列腺癌细胞的体内外生长,这提示PVT1在前列腺癌中具有致癌作用,可作为前列腺癌诊断的潜在生物标志物[14]。此外,LAN等[15]报道,核仁小分子RNA宿主基因12 (SNHG12)直接作用于miR-199a/b-5p 从而调节MLK3的表达,MLK3全名MAP3k混合谱系酶3,在过去十年中它被证明在多种肿瘤中与促进细胞增殖、促进细胞迁移、侵袭和转移密切相关,而SNHG12 通过对它的调节在促进肝癌的发生和转移中发挥重要作用[16]。可见多种不同的lncRNA 在不同类型肿瘤中发挥着作用。
2 SNHG6的特性
SNHG6,全名核仁小分子RNA 宿主基因6,位于染色体的8q13.1 区域[17]。研究发现它在多种肿瘤组织中表达上调,可能通过多种途径参与肿瘤的发生和发展,成为近年的研究热点[18]。最近,PANDOLFI 等[19]提 出,具 有microRNA 结合 位 点的RNA 片段可通过相互竞争而与miRNA 结合从而调节其表达水平,这些RNA 片段被称作内源性竞争性RNA(ceRNAs)。microRNAs 可以通过与靶基因的3'UTR 区结合来调控基因的表达,从而导致其靶向mRNA 的降解,参与多种细胞功能[20],而与ceRNA结合后,miRNA 连同下游靶基因的表达都将受到影响[21]。CeRNA 参与了包括膀胱癌、肺癌、结直肠癌和肝癌在内的多种肿瘤的发病,因此积极探索ceRNA 的作用可以帮助人们更好地理解肿瘤的发病机制[22]。 SNHG6 就是一种典型的ceRNA。SNHG6 可以通过和多种miRNA 结合,调控其表达水平来参与肿瘤的发生(图1)。
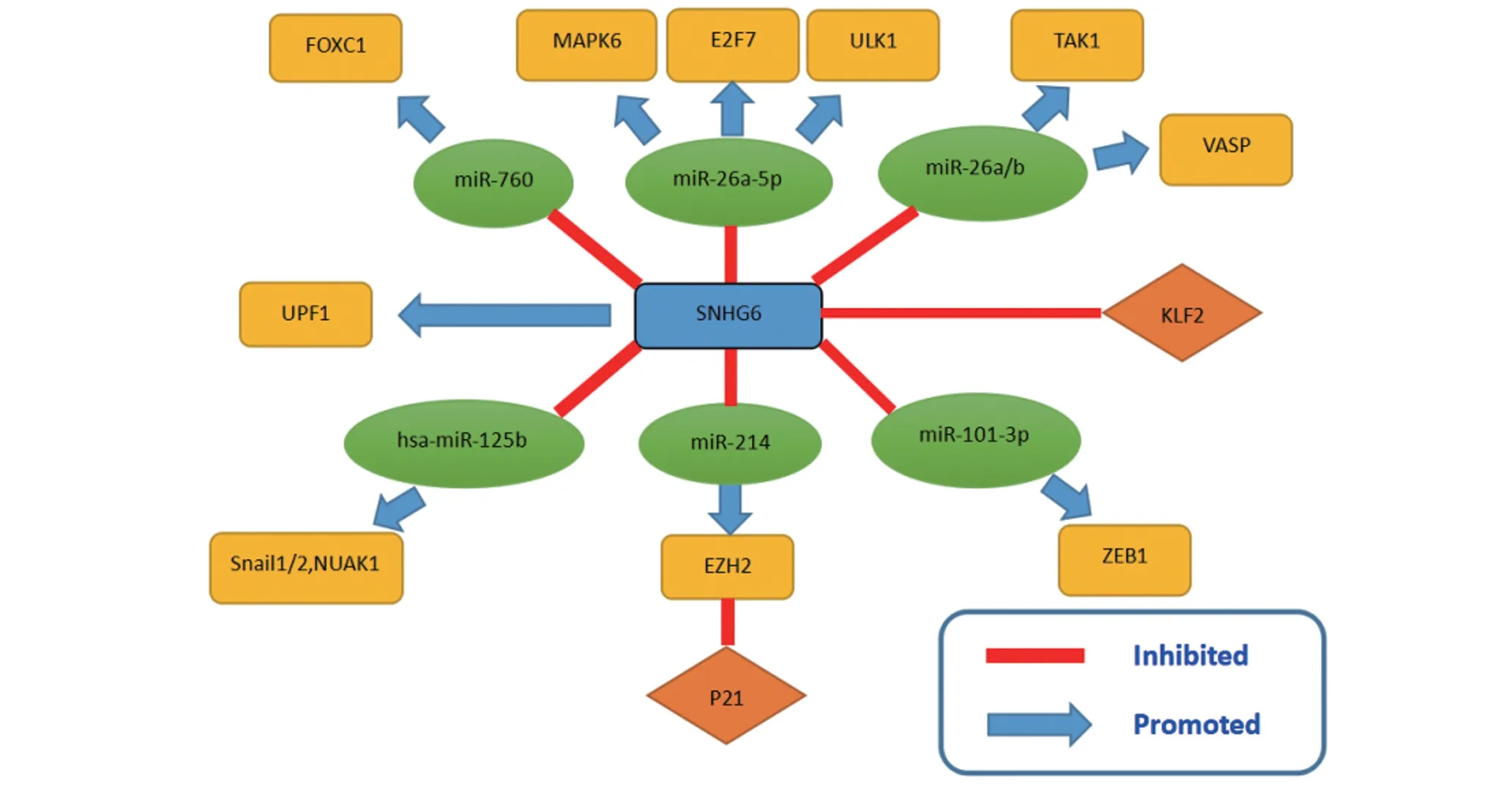
图1 SNHG6和多种mRNA结合并影响不同的通路
3 SNHG6 对人类多种肿瘤的调控作用及分子机制
3.1 乳腺癌 乳腺癌是妇女最常见的恶性肿瘤之一,近年来其发病率和死亡率持续升高[23]。在我国,乳腺癌发病率在40岁时开始明显升高,在45~49岁达到高峰[24]。此前VASTRAD 等[25]发现,miR-26a-5p 是乳腺癌相关性的成纤维细胞起始和进展的重要miRNA,而丝裂原活化蛋白激酶6 (MAPK6)是miR-26a-5p 的靶基因,它是MAPK 家族的非典型成员,与乳腺癌、胃癌和肝癌等的转移密切相关[26]。近期,在此基础上,SNHG6被发现在BC细胞中为高表达[27],体内外试验证实SNHG6基因敲除对BC细胞增殖、迁移和侵袭均有明显的抑制作用;SNHG6 可通过miR-26a-5p 正调控MAPK6 的表达,SNHG6 通过与miR-26a-5p 结合减弱其对BC 增殖、侵袭和转移的抑制作用,而促进MAPK6的表达则导致病情的发展;体内试验进一步证实,SNHG6 基因敲除可通过上调miR-26a-5p 来降低MAPK 6 的表达,从而抑制BC 的进展。血管扩张剂刺激的磷蛋白(Vasp)是一种广泛存在于不同组织和细胞中的肌动蛋白相关骨架蛋白[28]。先前的研究表明,vasp是调节多种肿瘤细胞迁移的关键靶蛋白:vasp 的高表达与胃腺癌、肺腺癌的低分化呈正相关[29]。LI等[30]在对乳腺癌发病的分子机制的研究中发现SNHG6 和Vasp 都能直接与mi-26a 结合,这提示SNHG 6 可能是miR-26a 的ceRNA,从而促进Vasp 的表达,导致乳腺癌细胞的活化增殖、迁移和侵袭。本研究揭示了SNHG 6/miR-26a/VASP 轴在乳腺癌发生发展中发挥的重要作用,为探讨乳腺癌新的发病机制提供了参考。
3.2 肺癌 尽管近年来由于治疗技术的不断完善,肺癌的发病率和死亡率有所降低[31],但它仍然每年导致大量死亡病例,预计2016年肺癌死亡人数约占癌症死亡总人数的27%[32]。为了帮助患者改善预后,科研工作者们不懈地研究肺癌发生的分子机制和新的治疗靶点。LIANG 等[11]发现SNHG6 在人肺腺癌组织中的表达要高于正常肺组织,且与患者TNM分期、肿瘤体积等呈正相关;研究进一步发现,SNHG6 可以通过促进肿瘤细胞周期进程,促进肿瘤细胞增殖、迁移和侵袭以及上皮间充质转换(EMT)而起作用。动物实验表明,SNHG6 基因敲除对体内异种移植物形成有明显的抑制作用。更重要的发现是,SNHG6 通过与miR-26a-5p 结合而发挥ceRNA 的作用,增强肿瘤前转录因子E2F7 的表达。E2F7 是一种重要的转录因子,参与多种恶性肿瘤细胞周期的调控,与肿瘤的生长和转移均有关[33]。在SNHG6 的作用下,miR-26a-5p 对肿瘤的抑制作用被削弱,同时E2F7 过表达促进肿瘤的增殖、侵袭和转移。通过上述SNHG6/miR-26a-5p/E2F7 轴的机制,提示SNHG6 或可作为肺腺癌治疗的潜在靶点。
3.3 肝细胞癌 肝细胞癌是最常见的原发性肝癌,被列为全球第六常见肿瘤和第三主要癌症死亡原因[34]。近日在分析了大量肝细胞癌样本后发现,SNHG6 在肝细胞癌(HCC)组织和细胞中表达高于正常组织[10]。CHANG 等[35]对SNHG6 促进HCC 发展的分子机制进行了研究,发现miR-101-3p 水平在肝癌组织中明显降低,而正是由于SNHG6充当着ceRNA,通过竞争性结合miR-101-3p 来降低其表达,达到调控ZEB1 表达的目的。ZEB1 即锌指E 盒结合蛋白1,是ZEB 家族的一员,ZEB1 在肝癌组织中有较高的表达,它可以诱导EMT,并促进肿瘤的进展和转移扩散[36]。因此可认为SNHG6/miR-101-3p/ZEB1 轴与HCC 的发生发展相关。CHANG 等[35]还发现SNHG6与ATP 依赖的RNA 解旋酶上移码蛋白1(UPF1)直接结合,UPF1不仅是RNA降解途径中的关键分子,也是细胞周期S期DNA复制的关键分子[37],SNHG6可通过与其结合影响肝癌的发生发展。进一步的研究还发现,在SNHG6的多种分型中,SNHG6-003与肿瘤进展有关,与预后呈负相关,它可以减弱miR-26a/b 对TAK1的抑制作用,从而增加TAK1及其下游效应的表达。TAK1 即内皮转化生长因子β活化激酶1,是一种丝氨酸/苏氨酸激酶[38],介导NF-κB和JNK/p38等可诱导转录因子的激活,TAK1在多种肿瘤中表达上调,并与肿瘤的进展及对化疗的耐药性有关,而SNHG6 增强了TAK1的特性,促进了HCC的进展[39]。
3.4 膀胱癌 膀胱癌大多数病例发生在60 岁以上的人身上,导致膀胱癌的主要危险因素是年龄,但吸烟和接触某些工业化学品也会增加风险[40]。近年来尽管在外科手术和放疗化疗的治疗下膀胱癌预后得到了很大的改善,但一些晚期膀胱癌患者的生存率仍然不理想[41]。因此,有必要进一步研究膀胱癌的发病机制,探索新的治疗策略。近年来研究发现在膀胱癌组织中SNHG6 也过表达,而SNHG6 的异常表达也可诱导上皮间充质转换(EMT),促进膀胱癌细胞的迁移和侵袭。SNHG6 的过表达能明显抑制hsa-miR-125b的表达,hsa-miR-125b为肿瘤抑制因子[42],在包括膀胱癌在内的多个上皮性肿瘤中表达下调,它能通过调节下游Snail1/2 和NUAK1 等靶基因的表达抑制多种肿瘤的增殖、迁移和侵袭。敲除SNHG6 基因后可观察到膀胱癌细胞中hsa-miR-125b的表达有恢复,肿瘤的增殖和侵袭速度则放缓[43]。
3.5 骨肉瘤 骨肉瘤是人体骨组织最常见的原发性恶性肿瘤,其预后几十年来都没有改善[44],故对骨肉瘤发生发展的分子机制探索具有重要的临床意义。ZHENG 等[45]通过qRT-PCR 检测发现,SNHG6 在骨肉瘤组织中表达明显高于正常细胞;Kaplan-Meier分析发现SNHG6 高表达与骨肉瘤预后不良有关。SNHG6基因敲除可通过抑制细胞周期、诱导细胞凋亡来抑制骨肉瘤细胞增殖;与细胞周期相关的基因p21和KLF2 在骨肉瘤细胞组织中表达与SNHG6 呈负相关。p21是细胞周期蛋白依赖性激酶(CDK)抑制剂,对细胞周期进程具有抑制作用,KLF2 为锌指转录因子家族成员[46],p21和KLF2均被证实在多种疾病包括肿瘤的基因表达中具有抑制作用。在骨肉瘤组织中SNHG6 抑制了p21 和KLF2 的表达,从而削弱它们对肿瘤细胞周期的抑制作用,促进了骨肉瘤细胞的增殖和转移[47]。ZHU 等[48]也发现SNHG6 还可以竞争性地结合miR-26a-5p,从而调节ULK1,并通过靶向Caspase-3 和ATF3 诱导细胞凋亡和自噬。Caspase-3是细胞凋亡过程中最主要的终末剪切酶,ATF3即活化转录因子3,在乳腺癌等多种肿瘤组织和细胞中被检测到表达增强[49]。简而言之,SNHG-6 通过调控miR-26a-5p/ULK1/Caspase-3,ATF3 轴在骨肉瘤细胞中发挥癌基因的作用[50]。上述结果对于研究骨肉瘤的分子机制和新的治疗策略是有积极意义的。
3.6 胃癌 胃癌(Gastric cancer,GC)是世界上最常见的恶性肿瘤之一,对发病年龄的分析表明,青年人胃癌的发病率正在逐渐上升,这可能与青年人不良的饮食生活习惯有关[51]。在人胃癌组织和血清中的SNHG6 表达是上调的;在裸鼠模型中发现SNHG6 基因敲除试验组的肿瘤体积和重量明显低于未处理的对照组,提示SNHG6 基因敲除可抑制GC 细胞增殖。肿瘤相关因子p21 在SNHG 6 基因敲除的GC 细胞中的表达水平是明显升高的,而在正常GC 细胞中,SNHG6 的高表达则可降低p21 的表达,提高EZH2 表达。EZH2 即Zeste 基因增强子同源物基因2,近年来越来越多的研究表明EZH2通过调节多种抑癌基因的表达促进肿瘤的发生[52],因此SNHG6 与EZH2 的正相关促进胃癌增殖。此外,SNHG6还能通过JNK通路来调控p21 的表达。JNK 通路的抑制几乎完全阻止了SNHG6 基因敲除后诱导的p21 表达的增加,阻断了p21 对GC 细胞的抑制作用,但不影响EZH2 表达水平的改变。即SNHG6 通过激活JNK 通路和调节EZH2表达这两种不相关的机制同时对肿瘤相关因子p21的表达进行调控,从而促进GC的进展,这对于开拓新的GC治疗策略是有积极意义的[53]。
3.7 胶质瘤 研究表明只有不到10%的胶质母细胞瘤患者在确诊后能存活5年以上[54]。关于胶质瘤发病的分子机制研究从未停止过。在胶质瘤组织或细胞中的SNHG6 表达水平高于正常的脑组织或细胞,并且随着胶质瘤的恶性程度增加而增加,SNHG6过表达与胶质瘤患者的预后不良是相关的。因SNHG6含有miR-101-3p的结合位点,推测SNHG6可能通过调节miR-101-3p 的表达促进胶质瘤发展,为此,MENG 等在保持miR-101-3p 稳定表达的前提下在胶质瘤细胞中将SNHG6 敲除,观察到E-钙黏蛋白表达增加了,波形蛋白表达则降低了,SNHG6 基因敲除诱导的细胞凋亡增加,胶质瘤细胞增殖和迁移显著减少,恶性程度也随之降低,证实了SNHG6基因敲除可增加胶质瘤细胞miR-101-3p 的表达,SNHG6 的过表达抑制了miR-101-3p 的表达从而促进胶质瘤的恶化[55]。在SNHG6 基因敲除后,采用Western blot 方法可检测到p21 表达明显增加,SNHG6/p21 轴参与胃癌发展的分子机制,而在胶质瘤中,它们可能同样也扮演着重要角色[56]。
3.8 结直肠癌 结直肠癌(CRC)是世界上最常见的恶性肿瘤之一,其发病率和死亡率在过去的几十年中一直居高不下,相比较发达国家来说,发展中国家CRC 的发病率更是逐年上升[57]。ZHU 等[58]发现SNHG6 在结直肠癌组织和细胞中表达均高于正常细胞,且与预后不良有关。miR-760是可以和SNHG6结合的非编码RNA,研究发现miR-760 在CRC 组织中表达下调,沉默SNHG6可以恢复miR-760的表达水平及其对肿瘤组织的抑制作用。FOXC1 是叉头框转录因子家族的成员之一,其在各种癌症起调控作用。MiR-760 与FOXC1 之间存在负相关关系,提示SNHG6 可 能 通 过 抑 制miR-760 上 调FOXC1,但FOXC1 在CRC 中的具体作用机制仍不清楚。可见,SNHG6的致癌作用是由于它能够作为ceRNA直接抑制miR-760,并随后激活并增强了FOXC1 的表达[59]。SNHG6 也可通过向p21 启动子招募EZH2 来抑制p21转录,如上所述EZH2是p21的转录抑制子,SNHG6通过将EZH2引入到CRC细胞的p21启动子中,抑制p21的转录,提示EZH2 在CRC 的发生发展中也起重要作用[60]。而最新的研究表明,SNHG6 可与miR-26a/b 和miR-214 相互作用,来调节其共同靶目标EZH2,其具体机制仍有待进一步研究阐明[61]。
3.9 舌癌 舌癌长期以来都困扰着医疗工作者,虽然现在外科手术已经成为舌癌主要的治疗方式,但患者的吞咽功能仍然受到了极大的影响,明显地降低了生活质量[62]。ZHAO等[63]采用实时定量PCR检测舌癌组织和正常舌组织后发现,SNHG6在舌癌组织中的表达水平显著提高,而这种高水平表达与年龄、性别无关,与组织分化程度、临床分期及淋巴结转移相关。在舌癌细胞中对SNHG6 进行基因敲除后,可明显抑制肿瘤细胞的增殖分化,并诱导其凋亡。因此,ZHAO 等[63]总结性地认为SNHG6 在舌癌组织中的表达明显增加,而SNHG6 表达的干扰可抑制舌癌组织细胞的增殖和进展。
3.10 肾细胞癌 肾细胞癌是肾脏最常见的恶性肿瘤,它最常见的组织学类型是腺癌和乳头状癌[64]。最近研究发现,在肾细胞癌组织中SNHG6 表达升高,而它的升高与肿瘤进展及淋巴结转移均显著相关,SNHG6 的表达还可以独立地预测RCC 患者的预后[65]。但SNHG6在RCC中的具体作用机制仍有待进一步探索。
3.11 前列腺癌 前列腺癌(PCa)是全世界男性中常见的恶性肿瘤之一,75~79岁男性的发病率达751人/10 万人[66]。YAN 等[67]通过对癌症基因组图谱(TCGA)和基因表达数据库(GEO)分析发现,相对于正常前列腺组织,SNHG6 在PCa 样品中的表达上调,SNHG6 在PCa 组织中的高表达与患者较短的生存时间显著相关。然而SNHG6 在PCa 中的作用机制仍不明确,有待进一步的研究。
4 展望
较多研究数据支持SNHG6 是一种新型癌基因,它充当着ceRNA,与具有抑癌作用的miRNA 竞争性结合,增强miRNA 下游靶基因的表达,从而达到促进癌细胞增殖、迁移的作用。但对于不同肿瘤,SNHG6促进肿瘤发生发展的分子机制存有异同,值得进一步深入研究,有望成为候选肿瘤治疗新靶点。

