不同粒径可吸入颗粒物全身暴露对老年小鼠认知功能的影响及其机制研究
方侃,胡怀明,姜华军,艾志兵,周圆
湖北医药学院附属太和医院药学部1、神经内科2,湖北 十堰 442000
阿尔茨海默病(Alzheimer's disease,AD)是一种起病隐匿、以认知功能进行性衰减为主要表现的中枢神经退行性疾病,已成为全球性的公共卫生问题。其发病机制尚不清楚,亦无特效的治疗药物。但可以肯定的是AD 最主要的危险因素是老龄化和衰老,而环境因素对AD 发生发展及患病后治疗效果的影响越来越成为关注焦点。可吸入颗粒物(PM)[1-3]又称悬浮粒子,指在气体介质中沉降速度可以忽略的小固体粒子、液体粒子及其悬浮体系。按其空气动力学直径PM 分为4 类:总悬浮颗粒物(≤100 μm,TSP)、粗颗粒物(≤10 μm,PM10)、细颗粒物(≤2.5 μm,PM2.5)、超细颗粒物(≤0.1 μm,UFPs)。国家《空气质量准则》限定PM2.5年均值≤35 μg/m3、日均值≤75 μg/m3。当PM2.5、UFPs进入人体过多时,不仅对呼吸系统、心血管系统等器官产生急性毒性作用,而且破坏血脑屏障(BBB)进入大脑,引发神经损害和退行性病变。并且,这些颗粒物对老年人的易感性更强,在老年人体内沉积率更高,更容易过度激活老年机体的炎症反应和氧化应激系统[4-6]。少数研究提示,PM2.5和UFPs暴露与AD的发生有一定的相关性,且PM的生物学效应受到其粒径的影响[1-3,7]。为此,本研究模拟PM进入人体的正常途径,探讨不同粒径PM 全身暴露对老年小鼠认知功能的影响及其作用机制,为揭示AD 的发病机制和防治方法提供实验数据。
1 材料与方法
1.1 主要试剂与仪器 肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)检测试剂盒(南京建成);含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)活性检测试剂盒(碧云天生物);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)及丙二醛(MDA)、乙酰胆碱(ACh)、胆碱乙酰转移酶(ChAT)酶联免疫吸附测定(ELISA)试剂盒(武汉博士德);核转录因子κB(NF-κB)ELISA 试剂盒(蓝基生物)。DLPI-30 型低压冲击仪+颗粒物采样器(芬兰DEKATI);HOPE-MED 8050 型动态气溶胶染毒暴露系统(天津合普);Nicomp 380 N3000 Basic 纳米激光粒度仪(奥法美嘉);MT-200 水迷宫行为学跟踪系统(成都泰盟)。
1.2 实验动物及其分组 健康昆明小鼠100 只,雄性,16 个月龄,体质量50~55 g,SPF 级,购于湖北医药学院实验动物中心[SYXK(鄂)2016-0031]。在实验前小鼠适应性喂养2 周,饲养环境:SPF 级,光暗交替(12 h/12 h),室内温度(22±2)℃,相对湿度(50~60)%,自由饮食。按数表法将小鼠随机分为正常对照组、生理盐水组、PM10染毒组、PM2.5染毒组、UFPs染毒组,每组20 只。本实验依照国家动物保护相关法规规定实施,并获得医院伦理委员会批准(批号:1811011)。
1.3 PM采样及其染毒液的制备
1.3.1 PM采样采样地点 十堰市人民南路32号十堰市太和医院感染性疾病治疗中心楼顶;采样点数量:1个;采样高度:距离地面20 m;采样时间:2018年12月25日至2019年6月25日。使用DLPI-30型低压冲击仪+颗粒物采样器。此仪器可以对空气中粒径大小(16 nm~10 μm)不同的颗粒物进行分级(13 级)收集。该13 级切割粒径(μm)与本实验PM10、PM2.5、UFPs 的对应关系厘定为,PM10:4.02、6.63、10.02;PM2.5:0.157、0.264、0.385、0.618、0.955、1.61、2.41;UFPs:0.028 5、0.056 3、0.094 6。
1.3.2 染毒液制备 采样后,将滤膜剪成(1 cm×1 cm)左右的小块,放入50 mL 的PVC 离心管中,加20 mL生理盐水浸泡,超声震荡30 min,重复4次;用6层纱布过滤振荡液,之后对滤液冷冻真空干燥,称重后4℃冷藏备用。暴露时,用无菌生理盐水将PM10、PM2.5、UFPs粉末分别配制成0 mg/mL、0.146 mg/mL、0.292 mg/mL、0.584 mg/mL 的悬液,并使用纳米激光粒度仪检测悬液颗粒物大小。染毒前超声分散。
1.4 不同粒径PM 全身暴露染毒 国家《空气质量准则》限定PM2.5 日均值≤75 μg/m3。本实验取其20 倍浓度为标准(1 500 μg/m3),即小鼠每天平均吸入PM 1.46 mg/kg,采用动态气溶胶染毒暴露系统对PM10、PM2.5、UFPs 染毒组小鼠实施全身暴露染毒。方法:将PM10、PM2.5、UFPs悬液按组分别加入标准配气发生器,温度恒定在(22±2)℃,使用PM质量浓度实时监测仪,动态监测暴露舱内的PM浓度,调节进气/载气的流量,控制舱内PM浓度稳定在(1 500±10)μg/m3,每天吸入12 h,连续4 周。生理盐水组小鼠雾化吸入等剂量生理盐水,正常对照组不做任何处理。
1.5 检测指标及其方法
1.5.1 Morris 水迷宫实验 连续吸入染毒4 周后,行水迷宫训练和测试。①获得性实验:随机从东/西/南/北4 个起始位置之一,将小鼠头朝池壁放入水中,记录小鼠找到水下平台的时间(s),即潜伏期(IP);若IP 超过60 s,以60 s 计,并引导小鼠至平台,让其在平台上停留10 s。4 次/d,两次间隔15 min,连续训练5 d。②探查实验:在获得性实验结束的第2 天,将平台移除,从原平台对侧象限将小鼠放入水中,记录小鼠在60 s内进入原平台象限的次数(ENT)及在该象限探查的时间(PT)。
1.5.2 标本制备 行为学测试完毕,断头取脑,分离出大脑皮质和海马体,电子天平称重,按10 mL/g添加冷生理盐水,用玻璃匀浆器分别制成大脑匀浆;将匀浆液置于离心机(转速10 000 r/min,4℃)中离心10 min,收集上清液,分装于EP 管并分别标记,置于-80℃冰箱冷冻待测。
1.5.3 大 脑 匀 浆TNF-α、IL-6、IL-1 β 含 量 及Caspase-3 活性检测 从冰箱中取出一部分大脑匀浆上清液,平衡温度后,按照各试剂盒(比色法)说明步骤进行操作;最后用分光光度计检测各管吸光度,分别计算出TNF-α、IL-6、IL-1β含量及Caspase-3活性。
1.5.4 大脑匀浆SOD、GSH-Px活性、MDA和Ach含量与ChAT活性及NF-κB含量测定 从冰箱中取出另一部分大脑匀浆上清液,按各试剂盒(ELISA)说明,测定上清液中SOD、GSH-Px 活性、MDA 含量和Ach含量与ChAT 活性及NF-κ B 含量。酶标仪型号:Multiskan MK3美国热电全自动酶标仪。
1.6 统计学方法 双盲录入实验数据,建立实验结果数据库;采用SPSS25.0 软件进行统计分析;计量资料以均数±标准差()描述,五组间数据比较使用方差分析,进一步两两比较采用LSD 法;检验水准均为α=0.05。以P<0.05表示差异有统计学意义。
2 结果
2.1 五组小鼠Morris 水迷宫测试结果比较 与正常对照组比较,生理盐水组、PM10 染毒组小鼠IP、ENT、PT 变化不明显,差异无统计学意义(P>0.05),而PM2.5 染毒组IP 明显延长、ENT 明显减少、PT 明显缩短,差异有统计学意义(P<0.05);与PM2.5 染毒组比较,UFPs 染毒组小鼠IP 明显延长、ENT 明显减少、PT明显缩短,差异有统计学意义(P<0.05),见表1。
表1 五组小鼠Morris水迷宫测试结果比较(

表1 五组小鼠Morris水迷宫测试结果比较(
注:与正常对照组比较,aP<0.05;与PM2.5染毒组比较,bP<0.05。
只数20 20 20 20 20 PT(s)26.58±2.09 25.96±2.92 24.87±3.72 22.48±2.63a 20.21±3.04b 3.824<0.05组别正常对照组生理盐水组PM10染毒组PM2.5染毒组UFPs染毒组F值P值IP(s)12.36±1.24 11.87±2.48 12.52±3.06 16.34±4.24a 19.82±3.48b 4.253<0.05 ENT(次)5.37±0.43 5.50±0.84 5.19±0.77 4.26±1.38a 3.32±0.95b 3.437<0.05
2.2 五组小鼠大脑匀浆TNF-α、IL-6、IL-1β及NF-κB 表达水平比较 与正常对照组比较,生理盐水组、PM10 染毒组小鼠大脑皮质和海马组织TNF-α、IL-6、IL-1β、NF-κB 表达水平变化不明显,差异无统计学意义(P>0.05),而PM2.5 染毒组小鼠TNF-α、IL-6、IL-1β、NF-κB 表达水平明显提高,差异有统计学意义(P<0.05);与PM2.5染毒组比较,UFPs染毒组小鼠TNF-α、IL-6、IL-1β、NF-κB 表达水平亦明显提高,差异有统计学意义(P<0.05),见表2。
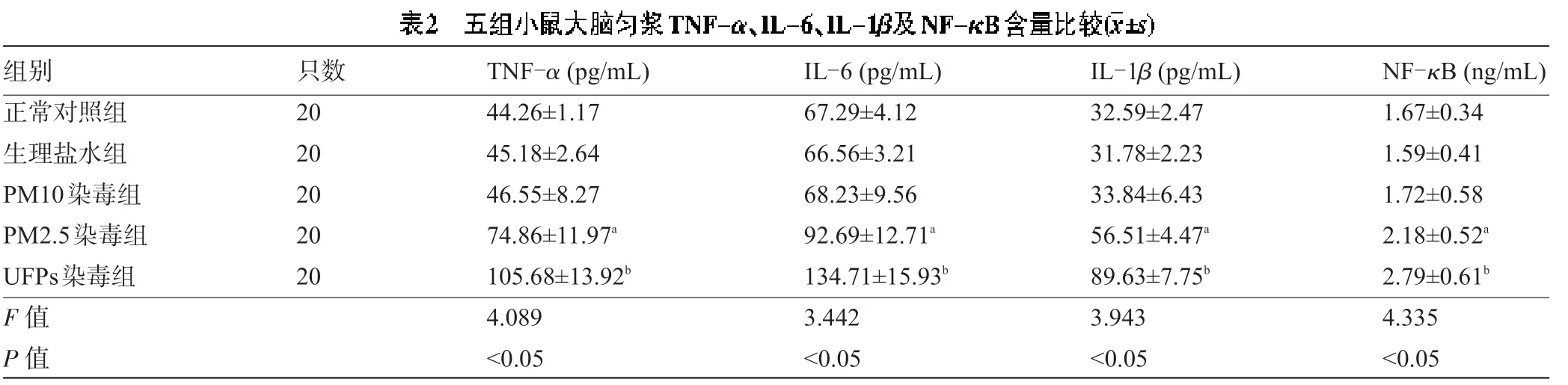
注:与正常对照组比较,aP<0.05;与PM2.5染毒组比较,bP<0.05。
2.3 五组小鼠大脑匀浆SOD、GSH-Px 活性及MDA 含量比较 与正常对照组比较,生理盐水组、PM10染毒组小鼠大脑皮质和海马组织SOD、GSH-Px活性及MDA含量变化不明显,差异无统计学意义(P>0.05),而PM2.5染毒组小鼠SOD、GSH-Px活性明显降低、MDA 含量明显提高,差异有统计学意义(P<00.05);与PM2.5 染毒组比较,UFPs 染毒组小鼠SOD、GSH-Px 活性明显降低、MDA 含量明显提高,差异有统计学意义(P<0.05),见表3。
表3 五组小鼠大脑匀浆SOD、GSH-Px活性及MDA含量比较()

表3 五组小鼠大脑匀浆SOD、GSH-Px活性及MDA含量比较()
注:与正常对照组比较,aP<0.05;与PM2.5染毒组比较,bP<0.05。
MDA(ng/mL)17.93±1.57 18.53±2.33 19.66±3.88 24.55±2.24a 32.26±3.65b 3.215<0.05组别正常对照组生理盐水组PM10染毒组PM2.5染毒组UFPs染毒组F值P 值只数20 20 20 20 20 SOD(IU/mL)2.23±0.19 2.17±0.23 2.11±0.26 1.68±0.54a 1.23±0.67b 3.078<0.05 GSH-Px(IU/mL)37.87±2.86 38.45±3.17 36.72±4.25 28.56±2.71a 22.56±3.87b 3.679<0.05
2.4 五组小鼠大脑匀浆Ach含量与ChAT活性及Caspase-3 活性比较 与正常对照组比较,生理盐水组、PM10 染毒组小鼠大脑皮质和海马组织Ach 含量与ChAT活性及Caspase-3活性变化不明显,差异无统计学意义(P>0.05),而PM2.5 染毒组小鼠Ach 含量和ChAT活性明显降低,Caspase-3活性明显提高,差异有统计学意义(P<0.05);与PM2.5染毒组比较,UFPs染毒组小鼠Ach含量和ChAT活性明显降低,Caspase-3活性明显提高,差异有统计学意义(P<0.05),见表4。
表4 五组小鼠大脑匀浆Ach 含量与ChAT 活性及Caspase-3 活性比较()

表4 五组小鼠大脑匀浆Ach 含量与ChAT 活性及Caspase-3 活性比较()
注:与正常对照组比较,aP<0.05;与PM2.5染毒组比较,bP<0.05。
Caspase-3(kU/g)357.54±22.65 355.63±27.19 360.54±30.53 412.67±33.29a 461.51±23.68b 3.348<0.05组别正常对照组生理盐水组PM10染毒组PM2.5染毒组UFPs染毒组F值P值只数20 20 20 20 20 Ach(μg/mL)204.29±13.53 205.13±15.26 201.95±18.52 183.96±10.64a 170.58±14.23b 4.025<0.05 ChAT(U/g)90.13±7.25 89.64±6.49 88.24±5.43 64.77±4.33a 52.07±3.62b 3.549<0.05
3 讨论
本研究结果显示,与正常对照组比较,PM2.5、UFPs染毒组IP明显延长、ENT明显减少、PT明显缩短,即PM2.5、UFPs全身暴露可以导致老年小鼠认知功能障碍,以后者为甚。这与王昊等[1]、孔玲等[8]、AILSHIRE等[9]综述分析结果一致。刘旭东[2]、卞晶晶[10]研究表明,随着PM2.5 染毒浓度的提高,大鼠出现认知能力下降并逐渐加重。王蛟男[11]、AARÓN 等[12]流行病学调查亦证实,环境PM2.5 暴露与老年人认知功能障碍高度关联。
与正常对照组比较,PM2.5、UFPs 染毒组大脑皮质和海马组织TNF-α、IL-6、IL-1β、NF-κB 等炎症反应指标的表达水平明显提高;与李春艳[13]研究结果一致。苏瑞军等[14]研究,从鼻滴入20 μL 6 mg/mL PM2.5溶液,1 次/2 d,连续30 d,可减轻小鼠脑重量,上调脑炎症因子的表达。冯德达[15]研究中经气管滴注PM细颗粒物(37.5 mg/kg)染毒,隔天1次,共3次,大鼠大脑皮质、海马TNF-α、IL-6、IL-1β、NF-κB表达水平明显提高。
与正常对照组比较,PM2.5、UFPs染毒组大脑皮质和海马组织SOD、GSH-Px活性明显降低、MDA含量明显提高。张克婷等[16]研究中,PM1.0染毒7 d后,诱发大鼠脑皮层氧化应激反应,SOD、GSH-Px表达明显下调、MDA表达明显上调,支持本研究结果。张海涯[17]研究中,妊娠期和哺乳期PM2.5 暴露,6 h/d,大鼠出生60 d后海马组织SOD、GSH-Px活性和MDA含量明显变化及学习记忆能力明显下降。
与正常对照组比较,PM2.5、UFPs染毒组大脑皮质和海马组织Ach含量、ChAT活性明显降低、Caspase-3活性明显提高;与CHENG等[18]研究结果一致。刘旭东[3]研究表明,尾静脉分别注射6.25 mg/(kg·d)、12.5 mg/(kg·d)单壁碳纳米管后,细胞凋亡因子Caspase-3 活性明显提高。ChAT功能是将乙酰辅酶A转移到胆碱上形成Ach;Ach 是大脑内的一种重要神经递质,参与认知、记忆及注意力等过程。脑组织的氧化应激和炎症反应,直接损伤神经元,或Caspase-3活化引发神经元凋亡,均可导致胆碱能神经损伤及Ach 含量、ChAT 活性降低[19],从而引起小鼠认知功能障碍。
本研究结果进一步显示,PM10、PM2.5、UFPs 对老年小鼠同等浓度、同等剂量、同等时间暴露后,对小鼠行为学、大脑炎症反应、氧化应激、胆碱能神经损伤及细胞凋亡等各项指标的影响呈现明显差异,差异均有统计学意义(P<0.05);即PM10、PM2.5、UFPs的生物学效应不同,UFPs最强,PM2.5次之,PM10最弱;人体吸气时,PM 随空气进入呼吸系统,PM 粒径越小就越容易进入深部,沉积率也越高,损伤也就越严重。
本实验小鼠吸入PM10 (2.5 μm<PM10≤10 μm)后,其大脑损伤不明显,认知功能亦无明显下降。可能的原因是,PM10可进入并沉积在鼻、咽、喉及气管,尤其在气管,随着分泌物移动、纤毛摆动及咳嗽反射,沉积的PM10 可排出体外。PM2.5 (0.1 μm<PM2.5≤2.5 μm)可到达终末细支气管和肺泡,大部分沉积在肺内,主要损伤该器官。有研究报道,PM2.5与特定蛋白(ApoE、转铁蛋白)结合,可以穿过完整的BBB 进入大脑,激活小胶质细胞或抑制抗氧化物质,引发炎症反应和氧化应激,损伤大脑[20-21]。另外,PM2.5 通常富集Al、Pb、Ni、Mn等成分,具有明显的神经毒性。
然而,UFPs(≤0.1 μm)的粒径尺度已经达到纳米级,其理化性质发生了很大的变化,显示出强烈的表面效应、尺寸效应、体积效应及隧道效应,从而呈现不同的特性。因此,一方面,UFPs 可以穿透呼吸膜或气血屏障,并随血液循环到脑部,直接跨过BBB 进入中枢神经系统;另一方面,UFPs 可以通过嗅球途径进入大脑。研究发现,嗅觉信息可以通过内嗅皮层输入到海马,即嗅觉信息→嗅觉受体→嗅球→初级嗅皮质(前嗅核、嗅结节、梨状皮质)→内嗅皮层→穿通纤维→海马,从而有效激发海马神经元[1,22-24]。而UFPs 也可以避开BBB经过这一途径输送到海马,再通过海马进入大脑。如镉、银、氧化铁、氧化锰、二氧化钛等金属颗粒物及元素碳颗粒,可通过这一途径在大脑蓄积。在输送UFPs的过程中,沿路神经元和神经纤维受损,突触丢失,引发嗅觉功能障碍;而嗅觉功能障碍可进一步影响嗅觉信息到海马的传递,使内嗅皮层和海马发生萎缩,进而导致记忆力下降。
综上所述,UFPs通过血脑屏障和嗅觉神经传导两个途径大量进入大脑,诱发严重的炎症反应、氧化应激及细胞凋亡,引起大脑皮质和海马神经元广泛损伤和认知功能明显障碍;而PM2.5只通过穿透BBB一条途径进入大脑,且此途径通过量低于UFPs;故UFPs的神经毒性和生物学效应比PM2.5更强。

