胰腺少见囊肿四例的临床特征分析并文献复习
龚婷婷 王婷 王伟
1上海交通大学医学院附属瑞金医院消化内科;2上海交通大学医学院附属瑞金医院病理科;3上海交通大学医学院附属瑞金医院普外科、胰腺疾病诊疗中心
【提要】 胰腺少见囊肿发生率低,影像诊断困难,与其他常见的胰腺囊性肿瘤,尤其是与具有潜在恶性的胰腺囊性病灶鉴别困难,常常造成不必要的手术干预。本文报道脉管瘤、纤毛前肠囊肿、副脾囊肿、淋巴上皮囊肿4种少见的胰腺囊肿类型,介绍其临床特征、放射影像和超声胃镜影像的表现,并进行文献复习。
随着影像技术的不断进步,胰腺囊肿被越来越多地发现,其发生率为2.4%~13.5%,且随着年龄的增长有升高的趋势[1]。胰腺囊肿可分为肿瘤性和非肿瘤性。以往大多数胰腺囊肿被认为是假性囊肿,然而近年来随着影像技术的发展,发现大多数胰腺囊肿是肿瘤性的[2]。胰腺肿瘤性囊肿主要包括浆液性囊腺瘤(serous cystadenomas, SCNs)、黏液性囊腺瘤(mucinous cystadenomas, MCNs)、导管内乳头状黏液腺瘤(intraductal papillary mucinous neoplasms, IPMNs)和实性假乳头状瘤(solid pseudopapillary tumors, SPTs)。典型的胰腺囊性病灶通过临床表现,结合影像学检查(CT、MR、EUS和EUS-FNA等)进行综合判断,都能获得较高的准确性,从而为患者制定合适的治疗方案。然而临床工作中会遇到一些少见的胰腺囊肿类型,通过影像及临床表现很难获得准确的术前诊断,最终被误诊为胰腺恶性或潜在恶性的囊性肿瘤进行手术干预。本研究介绍4种少见胰腺囊肿的临床及影像学表现,并进行文献复习,以提高对此类病变的认知。
回顾性分析2018年1月1日至2019年12月31日间上海瑞金医院内镜中心行胰腺EUS检查并经手术及病理确诊的139例胰腺囊肿患者的临床资料,其中135例(97.12%)为常见的假性囊肿、SCN、MCN、IPMN等,4例为少见的胰腺囊肿类型,分别为胰腺脉管瘤、胰腺纤毛前肠囊肿、胰腺副脾囊肿、胰腺淋巴上皮囊肿。
4例患者均无胰腺炎病史,病灶均为单发,与胰管均不相通。
病例1 患者女性,51岁。因“阵发性上腹部隐痛2月”就诊。CT平扫示胰体偏上部见一类圆形囊性低密度灶,最大截面约3.2 cm×2.6 cm,壁薄,边界尚清(图1A),增强后可见分隔渐进性轻度强化,主胰管未扩张(图1B),考虑为胰体部SCN,其他待排。 EUS见胰腺体部一无回声病灶,边界清晰,单房,囊腔一侧可见少量纤细高回声分隔影,囊壁薄,未见壁结节及实性成分,与胰管不相通(图1C),考虑为MCN。肿瘤标志物CEA、CA19-9均正常。择期行“胰体尾切除术”。切除标本大体为灰白囊性肿物,大小2.2 cm×1.6 cm×1.2 cm,切面呈囊性,囊内含清亮液体,囊壁1~2 mm。镜下见肿瘤由大小不一的囊腔或管腔构成,腔内见红色淡染物;囊壁及管壁厚薄不一,内衬单层扁平细胞,细胞排列稀疏(红色箭头,图1D)。内衬细胞血管内皮标志物CD34呈阳性表达(黑色箭头,图1E)。诊断为胰腺脉管瘤(pancreatic hemolymphangioma)。

图1 CT平扫(1A)及增强扫描(1B)图,EUS征象(1C), 病理组织学改变(1D,HE染色 ×40)及免疫组织化学染色图(1E)
病例2 患者女性,50岁。于外院体检行腹部B超时发现胰头囊性占位,进一步行胰腺MR增强考虑为IPMN,故来我院就诊。CT增强扫描示动脉期及门脉期见胰头部一大小约3.0 cm×2.1 cm的分叶状囊性灶,囊壁薄,腔内未见强化分隔或附壁结节,囊液密度偏高,CT值约36 HU(图2A、2B),提示胰头部囊性灶。EUS见胰腺头部一无回声病灶,边界清晰,单房,囊腔一侧可见部分低回声絮状物,与胰管不相通(图2C),病灶性质未定。CEA、CA19-9均正常。择期行“胰十二指肠根治术”。切除标本大体为灰白囊性肿物,大小1.8 cm×1.5 cm×1.5 cm。镜下见胰腺内囊肿,囊壁为平滑肌组织,囊壁旁局灶见少量黏液腺,囊壁内衬复层纤毛柱状上皮(红色箭头,图2D)。诊断为胰腺纤毛前肠囊肿(ciliated foregut cyst of pancreas)。

图2 CT增强动脉期(2A)及门脉期(2B),EUS征象(2C)及病理组织学改变(2D,HE染色 ×10)
病例3 患者男性,29岁。因“阵发性上腹痛2月”就诊。MR增强T2WI见胰尾部直径约1.1 cm的圆形囊性病灶,囊壁略厚、呈等低信号,腔内未见分隔或附壁结节(图3A);增强动脉期见病灶囊壁进行性强化,信号等或略高于周围胰腺实质(粗箭头,图3B);扩散加权成像(diffusion weighted imaging, DWI)见病灶囊壁呈稍高信号(图3C);表观扩散系数(apparent diffusion coefficient, ADC)图信号减低(细箭头,图3D)。EUS见胰尾紧邻脾门一囊实性病灶,约1.2 cm×1.2 cm,内部实性成分回声偏高,中央可见无回声区(图3E)。CEA、CA19-9均正常。择期行“胰体尾+脾脏切除术”,切除标本大体切面呈囊性,囊腔直径1.5 cm,囊壁光滑。镜下见胰腺内脾脏组织(黑色箭头),有脾被膜及脾小梁结构,并见动脉周围淋巴鞘结构(图3F)。诊断为胰腺内异位副脾伴上皮性囊肿(epidermoid cyst of intrapancreatic accessory spleen,ECIAS)。

图3 MRI的T2WI(3A)、T1WI(3B)、DWI(3C)及ADC图(3D),EUS征象(3E)及病理组织学改变(3F,HE染色×10)
病例4 患者男性,67岁。于外院体检行腹部CT发现胰尾占位来我院进一步就诊。CT平扫见胰腺尾部不规则形态病灶,增强扫描可见多发分隔及斑片、条索状强化(图4A)。MR见胰尾前侧一团块状占位影,T2WI呈等稍低信号内伴斑片状低信号(图4B)。考虑胰腺尾部占位,STP、神经内分泌瘤待排,胰周多发淋巴结显示。EUS见胰腺尾部一混杂回声病灶,无回声区不明显,以中等偏低回声及高回声为主,部分高回声后方伴声影(图4C),考虑SPT可能。CA19-9、CEA均正常。择期行“胰体尾+脾脏切除术”。切除标本大体切面呈囊实性,大小4.5 cm×4.0 cm×3.0 cm,内含豆渣样物。病理组织学检查见胰腺内一囊肿,囊壁见大量淋巴细胞及淋巴滤泡(黑色箭头,图4D),壁内衬上皮无异型(红色箭头,图4D)。免疫组织化学染色示囊壁内衬上皮细胞表达腺上皮标志物CK7(红色箭头,图4E)、鳞状上皮标志物P40(图4F),CK19(+),CK5/6(+),AE1/AE3(+),p63(+),CA19-9(+),MUC-1(+),Ki67(约5%+),CDX-2(-),CK20(-),MUC-2(-)。诊断为胰腺淋巴上皮囊肿(pancreatic lymphoepithelial cyst)。
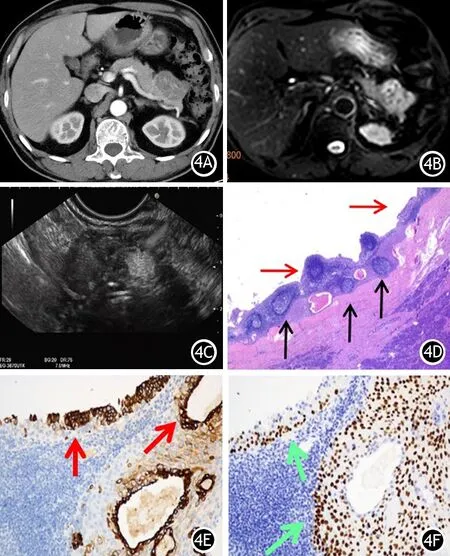
图4 CT增强扫描(4A)、MR图(4B),EUS征象(4C)及病理组织学改变(4D,HE染色×10)和免疫组化染色(4E、4F)
讨论脉管瘤是血管瘤和淋巴管瘤的合称,起源于间胚叶组织的一类少见的良性囊性肿瘤,好发于头颈部,罕见于胰腺。首例胰腺脉管瘤由Couinaud等于1966年报道,其占胰腺肿瘤比例不足0.1%,多见于女性,各年龄阶段均可发生,肿瘤多位于胰头部[3-4]。发病原因多数认为是先天性脉管系统发育异常,胚胎塑形不良的脉管组织与静脉淋巴管闭塞导致肿瘤形成[4]。临床表现早期可无任何症状,当肿块较大时可出现压迫症状,如上腹部疼痛不适、恶心呕吐等。实验室检查指标包括CEA及CA19-9等多在正常范围。脉管瘤影像表现为圆形或不规则囊性或囊实性肿块,边界清晰,内见分隔。CT及MR增强可见其内分隔、囊壁、囊内实性成分常呈显著强化或渐进性强化[5-6]。然而影像学表现不能较好地将胰腺脉管瘤区别于其他胰腺囊性肿瘤,最终诊断需要手术病理明确。脉管瘤组织学上含血管和淋巴成分,D2-40、CD34和CD31阳性表达对脉管瘤的诊断有较高的敏感性[7]。D2-40通常在淋巴上皮表达,CD34和CD31通常在血管上皮表达,尤其是CD34稳定地表达在肿瘤毛细血管及血管上皮。本组第1例患者CT与EUS均见胰体部有一内部少量分隔的囊性病灶,无实性成分及结节,病灶与胰管不相通,需考虑SCN或MCN的可能。病灶囊壁薄,CT增强可见分隔渐进性强化,更加倾向于SCN,但典型的SCN一般呈微囊型。因术前影像诊断不统一,考虑患者有腹痛症状,最终行手术切除,免疫组织化学提示血管内皮标志物CD34(+),病理诊断为胰腺脉管瘤。
纤毛前肠囊肿是一种囊壁内衬纤毛柱状上皮的先天性异常。前肠囊肿通常出现在纵隔,占纵隔占位的20%,很罕见发生在胰腺和肝胆区域[8]。前肠囊肿起源于胚胎发育的第3~7周,因胚胎原始前肠的出芽异常而发生的,可以分为支气管源型、肠源型、未分化型[9]。如果病灶与支气管树相通可以发生感染引起症状或单纯由于压迫引起症状。虽然这些囊性病灶几乎都是良性的,但仍有少量出现腺癌和鳞状细胞癌的散发病例报道[10]。实验室检查包括CEA及CA19-9等多在正常范围。CT增强表现为囊壁强化的单囊,囊腔内充满液体,有或无软组织[9]。先天性的前肠囊肿囊壁内衬假复层纤毛柱状上皮,也可包含黏液腺体或软骨,囊腔包含的内容物从清澈的浆液性液体到乳白色或棕色的黏液,富含脂类和蛋白质的黏液,通过EUS-FNA穿刺获得的囊液中黏蛋白阳性则容易与胰腺黏液性的囊腺瘤相混淆[10]。本组第2例患者为中年女性,病灶位于胰腺头部,无明显临床症状,实验室检查无异常,增强CT见胰头部一囊液密度较高的单囊病灶,提示病灶内部液体较黏稠,囊壁可见轻度强化,考虑IPMN可能,但EUS动态观察未见病灶与主胰管相通,周围胰管不扩张,不完全支持IPMN的诊断。最终行手术切除,病理诊断为胰腺纤毛前肠囊肿。
副脾是一种脾脏常见的先天变异,与脾脏结构相似,功能相通。副脾发生率为10%~30%,80%位于脾门附近,17%位于胰尾,称胰腺内副脾。胰腺内副脾伴上皮性囊肿极为罕见,发生率为1.7%,发病部位均位于胰尾,男性发病率略高于女性[11]。副脾囊肿与脾囊肿起源相同,均属于真性囊肿。大多数患者为偶然发现,通常病灶较小,不会引起明显的临床症状,且无恶变倾向,一般只需随访而不必行手术治疗。部分患者血CA19-9、CEA可升高,影像学表现为囊实性或囊性肿瘤,多为单发,有包膜或包膜不完整[11-12]。异位副脾内囊性成分呈T1WI 低信号、T2WI高信号,增强扫描无强化。通过将残留异位副脾组织与同层面脾脏信号比较,确认副脾组织是确诊ECIAS的关键,但当副脾组织较少时,难以与脾脏进行宏观比较,导致诊断困难。Motosugi等[13]通过超顺磁氧化铁对比剂MR成像证实ECIAS的囊壁与正常脾脏呈等信号表现,提出诊断ECIAS的新方法,但仍依赖较多的副脾组织。ECIAS典型的组织学特征是正常脾脏组织包绕的多房性或单房性囊肿,囊壁内衬复层鳞状上皮,部分角化,无皮脂腺等皮肤附属器[14]。本组第3例患者病灶的EUS表现不典型,MR可见位于胰腺尾部的单房小囊肿,囊壁稍厚,囊壁增强后有进行性强化,需考虑寡囊型的SCN、MCN、囊性变的神经内分泌肿瘤、单纯性囊肿等。患者最终选择手术切除,病理诊断为胰腺内异位副脾伴上皮性囊肿。
胰腺淋巴上皮囊肿属于真性囊肿,由鳞状上皮排列并被成熟的淋巴组织包围,是一种极为罕见的良性胰腺囊性疾病,约占所有胰腺囊肿的0.5%[15]。其发病机制和组织来源尚未确定。好发于中老年男性,约46%患者无症状,55%的患者CA19-9水平可升高[16]。影像学表现为胰腺内或突出于胰腺外的单发囊性或囊实性肿块[16]。CT平扫多呈稍低密度,略高于液性密度(囊内富含角蛋白),可见分隔,囊壁可有斑点状钙化,增强后囊壁及分隔轻度强化[17]。MR表现为T1WI低信号、T2WI 高信号、边界清楚的囊实性混合肿物影。大体标本容易从胰腺剥离,邻近胰腺组织基本正常,切面为单房或多房有分隔,囊内常含有类似干酪样或豆渣样物质,也可为清亮的液体。镜下可见囊肿壁内衬有成熟复层鳞状上皮,表面呈不全角化,囊内充满角质物,无细胞异型及核分裂象,上皮衬里周围有大量非肿瘤性淋巴组织,其中有淋巴滤泡形成,有时可见生发中心[18]。本组第4例患者为老年男性,病灶位于胰腺尾部,体检发现,无明显临床症状,实验室检查无异常。CT、MR及EUS均可见囊腔内有液性成分和实性成分混杂存在,包膜较完整,增强后实性成分和包膜有强化,这些均提示SPT的可能性大,但SPT一般好发于年轻女性,囊变区与实性成分之间分界清晰,与本病例有不符之处。最终行手术切除,病理诊断为胰腺淋巴上皮囊肿。
利益冲突所有作者均声明不存在利益冲突

