诱饵受体3及肿瘤坏死因子配体相关分子1A在CD4和CD8双阴性T细胞治疗裸鼠胰腺癌种植瘤中的作用
陈炯 胡丕波 邬高华 周海波
1安徽医科大学附属省立医院普外科,合肥 230001;2中国科学技术大学附属第一医院(安徽省立医院)普外科,合肥 230001
近年来免疫疗法成为癌症治疗手段中最有前景的方法之一,其中过继免疫疗法被认为可改善肿瘤治疗效果。过继免疫疗法是通过体外大量扩增患者自身免疫细胞,然后回输到体内,辅助人体原有的免疫系统,达到治疗癌症的效果[1-3]。双阴性T细胞(double negative T cell,DNT细胞)是指CD3+CD4-CD8-T细胞,在人类自身免疫反应、移植排斥反应以及炎症反应中均起到重要作用[4]。有研究发现DNT细胞同样具有抗肿瘤作用[5]。诱饵受体3(decoy receptor 3, DcR3)是肿瘤坏死因子受体超家族成员,表达于多种免疫细胞,例如NK细胞、CD8+T细胞,可以与靶细胞表面的肿瘤坏死因子配体相关分子1A(tumor necrosis factor ligand-related molecule 1A, TL1A)结合,辅助免疫细胞诱导靶细胞凋亡[6]。本研究构建胰腺癌裸鼠皮下种植瘤模型,静脉输注体外扩增的DNT细胞,观察DNT细胞对胰腺癌种植瘤的治疗效果,探讨DcR3和TL1A在其中所起的作用。
材料与方法
胰腺癌细胞株SW1990购自中科院上海细胞库,复苏后采用含10%胎牛血清的RPMI1640培养液(美国Hyclone公司)培养于37℃、5%CO2培养箱中,2~3 d更换培养基,适时传代。18只雄性BALB/c裸鼠购自上海史来克实验动物公司,4~5周龄,体重20~22 g。所有裸鼠均饲养于无菌环境中。
按照抗体吸附法[7,8]分离提纯DNT细胞。取健康志愿者外周血15 ml,加入CD4、CD8去除液各750 μl,室温静置20 min,将血液缓慢加入装有15 ml淋巴细胞分离液(天津灏洋公司)的离心管中,保持液面界面,室温下1 200 r/min离心20 min(离心半径4 cm)。吸取中间白色云雾层细胞,两次洗涤后以200 r/min离心5 min(离心半径4 cm),用RPMI1640培养液重悬细胞,将1×105/ml细胞加入到OKT3(美国 eBioscience公司)包被的6孔板中,依次加入2.5 μl IL-2和IL-4(美国 eBioscience 公司)后,置于37℃ 、5% CO2培养箱中培养,2~3 d更换培养液,适时传代。12~13 d可收获足量细胞,按课题组前期实验方法[9]用流式细胞仪测定DNT细胞纯度。
取对数生长期SW1990细胞,制成单细胞悬液(1.5×107/ml),接种于裸鼠右侧腋皮下(100 μl/只),待肿瘤最大径达0.5 cm时,将裸鼠随机分为对照组、吉西他滨治疗组和DNT细胞治疗组,每组6只。对照组不做处理,吉西他滨治疗组经鼠尾静脉注射吉西他滨(50 mg/kg),DNT细胞治疗组经鼠尾静脉注射DNT细胞悬液(1×108个细胞/ml,100 μl/只)。每天观察小鼠状况。饲养至第50天时颈椎脱位法处死裸鼠,取下种植瘤,测量体积和重量。肿瘤体积[V(cm)3]=1/2×长径(cm)×短径(cm) ×短径(cm)。
取部分瘤组织剪碎,充分研磨,采用RIPA裂解液抽提细胞总蛋白,BCA法对蛋白浓度进行定量,调整浓度后常规行蛋白质免疫印迹法检测DcR3和TL1A蛋白表达,以β-actin作为内参。DcR3、TL1A抗体购于英国Abcam公司,工作浓度均为1∶500。最后ECL发光,X线片曝光、显影、定影。采用凝胶图像软件分析系统扫描,以目的条带与内参条带的灰度值比作为蛋白相对表达量。
将瘤组织充分剪碎研磨,加入1 ml Trizol(美国Thermo公司),按照试剂盒说明书提取瘤组织总RNA,根据逆转录试剂盒说明书操作合成cDNA。然后以cDNA为模板进行扩增,以GAPDH为内参,实验重复3次。DcR3引物正向序列为5′-CAGACGTGCAACGACCTGAC-3′,反向序列为5′-TGGGACCTGCATCCTCAC-3′;TL1A引物正向序列为5′-CGGGGAGACGACCAAACAAG-3′,反向序列为5′-AAGGAGAACGTGGCCCCAAGGTA-3′;GAPDH引物正向序列为5′-CAAGGCTGTGGGCAAGGT-3′,反向序列为5′-GGAAGGCCATGCCAGTGA-3′。扩增参数为95℃预变性3 min,95℃变性10 s、60℃退火20 s、72℃延伸40 s,循环40次。采用公式2-△△ct计算DcR3和TL1A mRNA的表达量。
取石蜡包埋的瘤体组织,切片,脱蜡水化,按照TUNEL凋亡检测试剂盒(上海碧云天公司)说明书操作。滴加经过免疫染色洗涤液稀释后的蛋白酶K(20 ng/ml)作用20 min,滴加免疫染色固定液固定30 min,滴加免疫染色强力通透液室温静置5 min。滴加TUNEL检测液50 μl,37℃恒温箱中静置60 min,用抗荧光淬灭封片液封片后荧光显微镜下观察,通过凋亡细胞半定量分析计算凋亡率。
结 果
DNT细胞从外周血中分离培养,细胞数量为1×105/ml,经过添加IL-2、IL4的培养液培养13 d左右,细胞数量达到5×106/ml,DNT细胞纯度>90%。
DNT细胞治疗组种植瘤体积和重量分别为(670.28±124.54)mm3、(225.60±10.76)mg;吉西他滨治疗组分别为(604.60±179.16)mm3、(222.68±8.73)mg;对照组分别为(1738.80±391.39)mm3、(265.07±10.76)mg(图1)。DNT细胞治疗组和吉西他滨治疗组的种植瘤体积、重量均小于对照组,差异有统计学意义(t值分别为6.37、7.17,6.45、7.49,P值均<0.01),而DNT细胞治疗组和吉西他滨治疗组之间的种植瘤体积、重量的差异均无统计学意义(t值分别为0.74、0.60,P值分别为0.48、0.56)。

图1 对照组(1)、DNT细胞治疗组(2)和吉西他滨治疗组(3)种植瘤标本
DNT细胞治疗组、吉西他滨治疗组、对照组DcR3蛋白表达量分别为0.56±0.02、0.57±0.03、0.39±0.04,DNT细胞治疗组和吉西他滨治疗组均高于对照组,差异均有统计学意义(t值分别为8.99、8.80,P值均<0.001),而DNT细胞治疗组和吉西他滨治疗组间的差异无统计学意义(t=0.49,P=0.64)。DNT细胞治疗组、吉西他滨治疗组、对照组TL1A蛋白表达量分别为0.41±0.03、0.40±0.05、0.81±0.05,DNT细胞治疗组和吉西他滨治疗组均显著低于对照组,差异均有统计学意义(t值分别为18.04、14.82,P值均<0.001),而DNT细胞治疗组和吉西他滨治疗组间的差异无统计学意义(t=0.46,P=0.65,图2)。
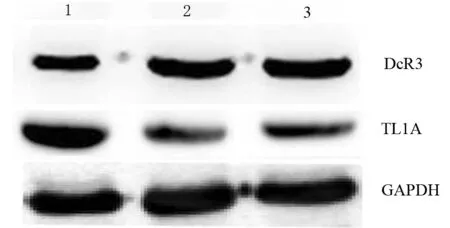
图2 对照组(1)、DNT细胞治疗组(2)、吉西他滨治疗组(3)种植瘤组织DcR3、TL1A蛋白表达
DNT细胞治疗组、吉西他滨治疗组、对照组DcR3 mRNA的表达量分别为3.74±0.19、3.40±0.39、0.92±0.05,DNT细胞治疗组及吉西他滨治疗组均高于对照组,差异有统计学意义(t值分别为34.94、15.40,P值均<0.001),而DNT细胞治疗组和吉西他滨治疗组间的差异无统计学意义(t=1.95,P=0.08)。DNT细胞治疗组、吉西他滨治疗组和对照组TL1A mRNA表达量分别为0.83±0.11、0.79±0.08、1.70±0.36,DNT细胞治疗组及吉西他滨治疗组均显著低于对照组,差异均有统计学意义(t值分别为5.69、6.08,P值均<0.001),而DNT细胞治疗组和吉西他滨治疗组间的差异无统计学意义(t=0.73,P=0.48)。
DNT细胞治疗组、吉西他滨治疗组和对照组的细胞凋亡率分别为(53.2±11.2)%、(56.2±8.6)%、(10.3±3.2)%,DNT细胞治疗组和吉西他滨治疗组的细胞凋亡率显著高于对照组,差异均有统计学意义(t值分别为9.00、12.28,P值均<0.001,图3),而DNT细胞治疗组和吉西他滨治疗组间细胞凋亡率差异无统计学意义(t=0.52,P=0.61)。

图3 对照组(3A、3B)、DNT细胞治疗组(3C、3D)、吉西他滨治疗组(3E、3F)细胞凋亡的明场图(3A、3C、3E)及荧光(3B、3D、3F)对比图(TUNEL,×100)
讨 论
免疫治疗是近年来逐渐走进人们视野的一种新型的治疗方法,癌症的过继免疫治疗更是引起了全世界研究者的广泛关注,参与过继免疫治疗的各种人体免疫细胞被深入研究,其中调节性T细胞群在肿瘤免疫应答的调节中起到了关键作用。本课题组所研究的DNT细胞最初被发现也正是因为其参与了免疫应答的过程。人体中大多数T细胞都呈CD4和CD8阳性表达,两种表面分子均呈阴性表达的T细胞仅占总细胞数的1%~5%。CD8阳性T细胞、NK T细胞以及γδ T细胞的抗肿瘤作用已经被广泛研究[10-12],然而关于DNT细胞在抗肿瘤中应用的报道较少,尤其是在实体肿瘤中的研究。本课题组采用目前最先进的抗体吸附法在体外扩增DNT细胞,并将其注射入胰腺癌细胞种植瘤裸鼠体内,结果发现DNT细胞可以显著延缓胰腺癌种植瘤的生长,且DNT细胞治疗组种植瘤细胞凋亡率较对照组明显增高。更有意义的是,DNT细胞对胰腺癌种植瘤的治疗效果与作为阳性对照组的临床常用化疗药吉西他滨的差异并无统计学意义,提示将DNT细胞免疫治疗胰腺癌用于临床具有一定的可能性。
DNT细胞的抗肿瘤作用虽然被越来越多的学者关注,但是其具体机制尚不清楚。DcR3是肿瘤坏死因子受体(tumor necrosis factor receptor, TNFR)超家族成员,它最初是在癌细胞中被发现。与大多数TNFR成员不同,DcR3缺乏跨膜结构域,且可在血清和细胞培养液中检测到[13]。其配体TL1A同样也是TNF超家族成员,由174个氨基酸构成,主要高表达于内皮细胞[14]。有研究报道DcR3-TL1A是一种新的免疫信号通路,它在炎症性肠病、关节炎等疾病中发挥重要的作用[15]。本研究发现DcR3蛋白和mRNA在DNT细胞治疗组的表达明显高于对照组,而TL1A蛋白和mRNA的表达与DcR3表达情况相反,因此DNT细胞可能是通过上调胰腺癌细胞DcR3表达和下调TL1A表达来产生治疗作用的。有研究指出TLIA蛋白可以提高T细胞免疫活性,从而进一步增强与靶细胞的免疫反应[16]。Chen等[17]也发现经过人工上调DcR3蛋白表达后,T细胞对胰腺癌的免疫治疗作用明显增加。本研究的结论与他们一致。另外,本研究发现DNT细胞对DcR3和TL1A调节能力与化疗药吉西他滨相似,两者是否均通过介导DcR3-TL1A途径抑制胰腺肿瘤生长有待进一步证实。
综上所述,本研究证明了DNT细胞在体内对裸鼠胰腺癌种植瘤生长有明显的抑制作用,其效果与临床常用化疗药吉西他滨相似,DcR3-TL1A可能参与了DNT细胞的抑癌作用机制,这为DNT细胞过继免疫治疗胰腺癌的临床应用提供了一定的实验及理论基础。
利益冲突所有作者均声明不存在利益冲突

