酪丁酸梭菌发酵产丁酸研究进展
衡文,叶光斌,邹伟
(四川轻化工大学 生物工程学院,四川 宜宾 644005)
丁酸(butyric acid)又名酪酸,是含4个碳原子的饱和一元羧酸,具有挥发性。丁酸应用十分广泛:在化工领域可作为原料用于热塑性材料合成[1];在食品领域可作为风味成分增强食物风味[2-4];在饲料行业可作为新型饲料添加剂,提高牲畜的免疫力水平和营养价值,减少抗生素的使用[5];在医药领域可作为辅助用药对肠道具有修护作用[6-7]。2016年全球丁酸年产量已超过8×104t[8],且呈逐年上升的态势。目前,丁酸主要的生产方法可分为化学合成法和微生物发酵法。其中,微生物发酵法相较于化学合成法在环境保护、资源再利用等方面更具优势,更符合可持续发展战略,受到国内外学者普遍关注。厌氧条件下,丁酸是酪丁酸梭菌(Clostridiumtyrobutyricum)、丁酸梭菌(C.butyricum)、杨木梭菌(C.populeti)等菌株主要代谢产物[9-11]。其中,C.tyrobutyricum因丁酸产量大、产率高、纯度高、稳定性好等优势,被认为是发酵生产丁酸最具商业化潜力的菌株[12-13]。
1 C. tyrobutyricum基本生物学特征
酪丁酸梭菌(Clostridiumtyrobutyricum)隶属于芽孢杆菌科(Bacillaceae)、梭菌属(Clostridium),是具有丁酸生产能力的有机化能异养型专性厌氧菌。菌体中间隆起,其直径约为0.3~2.0 μm×1.5~2.0 μm,端圆,单个或成对出现,菌体呈短链,偶见长丝状菌体,周身鞭毛,能运动,革兰氏染色呈阳性。平板上菌落表面呈圆形,稍突,边缘完整,呈煎蛋状,灰色半透明,表面有光泽,直径约在1~3 mm。由于菌体中常有圆形或卵圆形的巨大芽孢,对高温、高盐、强酸等恶劣环境的耐受性强,在pH 4.5~7.0,35~37 ℃的条件下均能很好地生长[14]。C.tyrobutyricum因发酵乳酸破坏奶酪制品风味而为人所熟知,常分离于动物消化系统、土壤、废水、青贮饲料、乳制品污染环境样品中。
2 C. tyrobutyricum丁酸发酵途径解析
C.tyrobutyricum的主要代谢产物为丁酸和丁醇,常伴有副产物乙酸,也能产生少量乳酸和乙醇[15]。结合文献和数据库信息重构C.tyrobutyricum利用不同底物(葡萄糖、木糖、甘油、甘露糖)合成丁酸及其相关副产物的代谢途径,见图1。
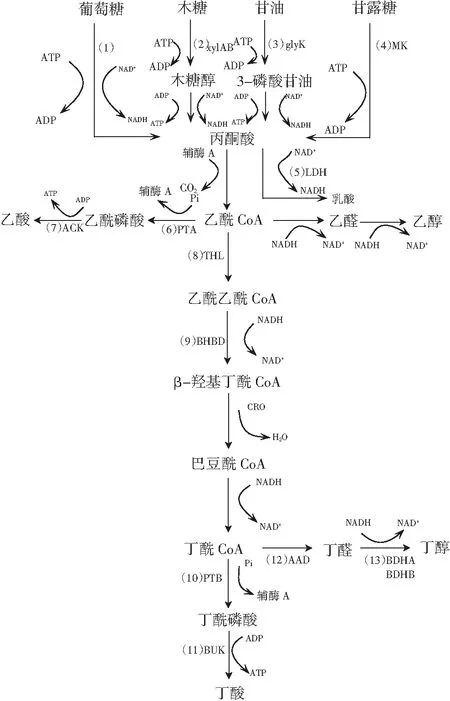
图1 C. tyrobutyricum发酵产丁酸代谢途径Fig.1 The metabolic pathway of producing butyric acid by C. tyrobutyricum注:(1)EMP途径;(2)xylAB:木糖异构酶、木糖激酶;(3)glyK:甘油激酶;(4)MK:甘露糖激酶;(5)LDH:乳酸脱氢酶;(6)PTA:磷酸甘油酯酶;(7)乙酸激酶;(8)THL:硫解酶;(9)BHBD:β-羟丁基辅酶A;(10)PTB:磷酸转乙酰辅酶;(11)BUK:丁酰激酶;(12)AAD:醇/醛脱氢酶;(13)BDHA/BDHB:丁醇脱氢酶。
以葡萄糖作为底物时[16],当葡萄糖进入代谢途径,通过EMP途径将葡萄糖分解生成丙酮酸、NADH和ATP。生成的丙酮酸一部分在乳酸脱氢酶的作用下生成乳酸、NADH;另一部分丙酮酸在丙酮酸脱氢酶的作用下生成中间产物乙酰CoA。乙酰CoA又分别参与乙酸、乙醇及丁酸代谢通路:在乙酸代谢通路中,乙酰CoA在磷酸转乙酰酶的作用下生成乙酰磷酸,再进一步在乙酸激酶的催化下生成乙酸;在乙醇支路中,乙酰CoA在丙酮酸脱氢酶催化下生成乙醛,再在醇脱氢酶的作用下生成乙醇。丁酸合成途径首先乙酰CoA在硫解酶的作用下生成乙酰乙酰CoA,再在β-羟基丁酰CoA脱氢酶的作用下继续生成β-氢羟基丁酰CoA,此时巴豆酸酶发挥作用将β-羟基丁酰CoA转化为巴豆酰CoA,后在丁酰CoA脱氢酶的作用下进一步生成关键前体物质丁酰CoA,前体物质在磷酸丁酰转移酶、丁酰激酶的催化下最终形成丁酸。以木糖作为底物时[17],木糖底物经戊糖-磷酸途径分解为果糖-6-磷酸和甘油醛-3-磷酸,然后经过一系列酶的磷酸化、外膜化形成丙酮酸木糖[18]。以甘油作为底物时[19],甘油在甘油激酶的催化下生成α-甘磷酸甘油,再通过脱氢变为磷酸二羟丙酮,再经糖降解转化为丙酮酸。以甘露糖为底物时[20],在甘露糖激酶的作用下生成6-P-甘露糖,再经异构酶、激酶催化生成丙酮酸。不论是木糖、甘油还是甘露糖,都是通过一系列反应生成中间产物丙酮酸,后续代谢途径与葡萄糖代谢途径一致,故不赘述。
3 C. tyrobutyricum利用生物质原料发酵产丁酸
化学合成带来的环境污染以及不可再生的自然资源消耗殆尽等问题不断凸显,迫使人们不得不寻找绿色经济可再生的原料代替化石燃料生产丁酸。生物质资源作为地球上储量最丰富的可再生性资源,全球每年通过光合作用生成的生物质资源可以达到 2000亿吨,所蕴含的能量是全球能量需求的数十倍[21]。其中以木质纤维素形式储存的能量能够占到 60%以上,是地球上最为丰富的有机资源[22],是代替化石燃料生产丁酸的绝佳原料。
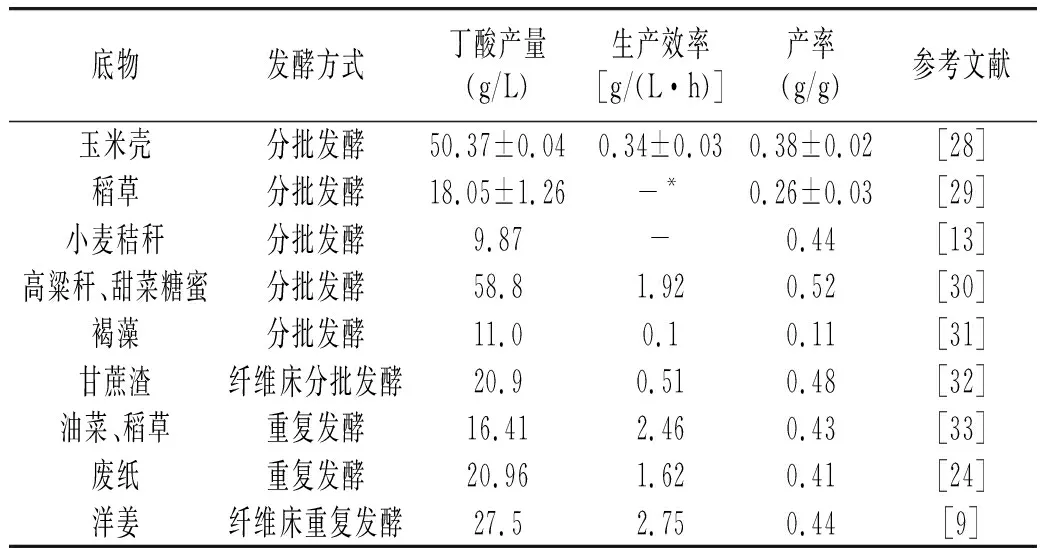
表1 C. tyrobutyricum利用不同生物质发酵产丁酸研究Table 1 Study on production of butyric acid by fermentation of C. tyrobutyricum with different biomass
由表1可知,C.tyrobutyricum在不同发酵方式下对生物质原料均具备较好的利用能力。自由细胞发酵时,由于传质能力的递减及产物浓度的反馈抑制作用,C.tyrobutyricum发酵生产丁酸的能力未得到充分展现。利用固定化细胞进行发酵生产能够一定程度上解决生产能力低下的问题[23-24]。生物质原料虽然来源广、成本低,但其复杂的细胞结构增加了生物转化的难度,水解液中酚类化合物对C.tyrobutyricum会造成毒害,这些问题在不同程度影响了C.tyrobutyricum产丁酸的发展。研究发现,利用稀硫酸[25]、γ-戊内酯/1-甲基咪唑二甲基亚磷酸复合体系[26]进行预处理能够一定程度上破坏生物质复杂结构,目的产物产量分别增加了42.62%、46.8%。另外,采用混合生物质发酵,能一定程度上降低水解液的毒害作用从而提高丁酸产量[27]。这些方法不仅对于C.tyrobutyricum发酵生物质有效,同时也为其他具有生物质发酵能力菌株的研究提供了参考思路。
4 遗传工程改造C. tyrobutyricum发酵产丁酸
目前,C.tyrobutyricum发酵产丁酸主要受三类因素限制:底物摄取率低;菌株对丁酸、酚类物质耐受程度低;丁酸代谢途径复杂,代谢流分支较多。研究显示:依靠遗传工程技术,对菌株进行定向改造能够有效打破这些限制,提高丁酸产量。
4.1 提高底物吸收效率
以葡萄糖介导的碳分解代谢物抑制效应(carbon catabolite repression, CCR)是造成C.tyrobutyricum木糖分解率低下的主要原因。过量表达木糖质子——同工酶(xylT)、木糖异构酶(xylA)和木糖激酶(xylB)3个基因,通过分批发酵,产物产量由3.2 g/L提升至12.0 g/L,能有效打破CCR的限制。若在发酵液中加入紫罗碱(viologen BV),人工电子载体加快电子的传递,Ct-pTBA的突变体经自由细胞分批发酵,最终产量可达46.4 g/L,产率为0.43 g/g,产率为0.87 g/(L·h)。实验还发现,该突变体在各种未脱毒木质纤维素生物质水解物中具备优异的葡萄糖和木糖协同利用能力,通过自由细胞分批发酵丁酸终产量达29.7~42.6 g/L的较高浓度[34]。此外,克隆α-隆葡糖苷酶中的agluⅠ和agluⅡ导入C.tyrobutyricum细胞内,可使其获得分解麦芽糖、淀粉的能力[35]。克隆蔗糖代谢途径的scrA,scrB,scrK基因,可使C.tyrobutyricum获得蔗糖分解的能力[36]。此类研究拓展了C.tyrobutyricum可利用底物的范围。
4.2 提高菌株耐受性
C.tyrobutyricum对环境中丁酸及酚类物质浓度的耐受能力与Ⅰ类热休克蛋白基因相关性较高,过表达groESL基因能有效提高C.tyrobutyricum对丁酸的耐受能力,而过表达dnaK则会降低其耐受能力。利用过表达groESL基因的菌株进行固定化细胞补料分批发酵丁酸最终产量可达52.2 g/L,较之前提高了15.2%[37]。天然基因groESL的过表达还能提高菌株对水解物中酚类物质的耐受性,丁酸产量较野生型增加了26.5%,达到29.6 g/L[38]。除Ⅰ类热休克蛋白外,过表达短链脱氢酶/还原酶(short-chain dehydrogenase/reductase,SDR)也能增强菌株对呋喃衍生物和酚类化合物的耐受性,当SDR与groESL基因共表达时,丁酸产量还能得到进一步提升[39]。
4.3 调控丁酸代谢流
在丁酸代谢途径中,磷酸甘油酯酶(phosphoransacetylase,pta)、乙酸激酶(butyrate kinase,ak)、磷酸转乙酰辅酶(phosphotransbutyrylase,ptb)和丁酸激酶(butyrate kinase,bk)基因起着重要的作用。其中,pta和ak酶将乙酰CoA转化为乙酸,ptb和bk酶催化丁基CoA生成丁酸。从代谢途径进行分析,抑制乙酸支路代谢的进行,能促进代谢流更多流向丁酸发酵途径,见图1。
Zhu Y等[40]通过灭活pta基因将丁酸浓度提高了60.8%(野生型:20.2 g/L,突变型:32.5 g/L),pta、ak活性分别降低了60%、80%;进一步采用基因敲除技术敲除ak基因,在新型纤维床生物反应器(fibrous bed bioreactor,FBB)体系中,细胞固定化发酵的最终丁酸浓度达到50.1 g/L较高水平[41]。Ptb基因在丁酸形成中十分重要,根据代谢通路图可合理推测敲除ptb基因,丁酸生成将会降低。然而,Zhang Y等[42]研究发现敲除C.tyrobutyricum中的ptb基因,丁酸产量并无明显变化。这可能是细胞中其他同工酶代替磷酸转乙酰酶发挥了作用。此外,过表达EMP途径中的6-磷酸果糖激酶(pfkA)和丙酮酸激酶(pykA)也可一定程度上促进丁酸的累积[43]。研究发现,不管以何种方式去除乙酸、丁酸途径中的关键基因,并不能完全阻断对应代谢产物的生成。这表明必须掌握完整的C.tyrobutyricum代谢网络内通量分布,进行系统全面的分析。目前已有13株C.tyrobutyricum完成全基因组测序[44]。借助于这些基因组信息可以构建C.tyrobutyricum基因组规模的代谢网络模型,结合相关约束性算法,可以更理性地指导C.tyrobutyricum代谢工程改造工作[45]。
5 生物反应器改良
C.tyrobutyricum通过自由细胞发酵生产丁酸存在产量低、浓度低、产率低等不足[46]。传统的生物反应器周期长、设备利用率低、发酵中后期产率低等缺陷也不能满足工业化产丁酸的目的。纤维床生物反应器(fibrous bed bioreactor,FBB)能够将细胞固定在纤维基质中,并被广泛应用各种底物发酵生产丁酸,生产效率和产率得到显著提高[47]。利用FBB法,C.tyrobutyricum经补料分批发酵,丁酸产量达86.9 g/L,为现有报道最高值[48]。王金等[49]创新性地采用四柱FBB,与单柱发酵相比,四柱FBB提高了发酵效率,丁酸产量提高7.19%,产量提高136.7%,补料分批发酵丁酸最终浓度达到61.4 g/L。Huang J等针对丁酸发酵生产的需要,研制了一种新型的内盘状基体,该基体由不锈钢丝组成,织物覆盖在盘状基体上,优化各项因素后丁酸产率最优值可达0.47 g/g。Luo H等[50]构建了内纤维床反应器(internal fibrous bed bioreactor,IFBB),通过补料分批发酵,丁酸的产量和生产效率分别达到45.38 g/L、0.630 g/(L·h)。在FBB的生产过程中,降低质量梯度需要通过多次循环泵来实现,不仅增加了总投资,pH值也没有得到及时的控制。而IFBB克服了FBB的不足,以更简单的施工程序、更好的传质混合和更低的价格实现丁酸增产的目的,在工业化应用上具有一定优势。
6 展望
目前,提高C.tyrobutyricum丁酸产量的途径主要通过提高底物利用率、增强菌体耐受性以及促进丁酸代谢流3个方面进行。其中,江凌等人经补料分批发酵得到丁酸产量最高值86.9 g/L。尽管国内外对C.tyrobutyricum产丁酸已有较为深入的研究,但其代谢与调控机理仍并未得到全面解析。因此,提高C.tyrobutyricum丁酸产量的主要研究方向将以利用遗传工程技术,借助生物信息学手段,对遗传信息进行全面解析为目的,从而实现系统科学地指导丁酸发酵。同时,生物反应器的不断改进和优化也是实现其规模化、产业化生产的关键。随着未来研究过程中对C.tyrobutyricum遗传信息的进一步揭示以及蛋白质组学、代谢组学等技术的发展与成熟,C.tyrobutyricum的生理代谢机制将被逐渐明确,其用于工业化发酵生产丁酸也指日可待。

