吲哚美辛对大鼠跟腱创伤后异位骨化的影响及机制
谢成龙,齐新文,安荣泽,尤彬,谭伟源,叶燕彬
1 黔西南州人民医院,贵州兴义562400;2 遵义医科大学第五附属(珠海)医院;3 德阳市第二人民医院;4 惠东县人民医院
异位骨化(HO)是指在正常情况下不具有骨化性质的组织中出现具有成熟板层骨结构的骨组织,多发于髋臼骨折、肘及膝肩关节骨折脱位损伤后[1]。临床以肘部及髋部HO 较为常见。HO 是人工髋关节置换后最常见并发症[2],可导致关节活动度下降、关节僵硬、畸形、周围神经卡压和压力性溃疡等[3-4],影响患者正常工作及生活。但HO 的发病机制尚未完全明确[5-6]。骨硬化蛋白(SO)是由SOST 基因编码的一种分泌型糖蛋白[7-8],对成骨细胞分化、矿化及骨密度、骨强度均具有抑制作用。由此可以推测,SO 在HO 形成中起一定作用,但相关研究较少。吲哚美辛作为非甾体消炎药(NSAIDS)的代表药物,是目前公认的预防人工髋关节置换和髋臼骨折术后HO 的最有效药物[9]。鉴于此,2017 年 1 月—2018 年1 月,本研究通过建立大鼠跟腱损伤模型,探讨吲哚美辛对创伤后HO 的影响,并探讨其可能的作用机制,为临床诊断、预防和治疗HO提供依据。
1 材料与方法
1.1 动物、试剂及仪器 SPF级SD雄性大鼠30只,5~6 周龄,体质量(132.0 ± 6.5)g,由广东省医学实验动物中心提供,实验动物许可证:SCXK(粤)2013-0002,在相同环境下喂养,室温约25 ℃,湿度55%,定期紫外线消毒鼠房。吲哚美辛购自广东华南药业集团有限公司,将吲哚美辛胶囊内粉末混溶于生理盐水,配置2 mL溶液。大鼠Sclerostin酶联免疫分析试剂盒购自武汉基因美科技有限公司,0.01 mol/L pH6.0枸橼钠缓冲液购自天津市永大化学试剂有限公司,水合氯醛购自上海化学试剂公司,离心机购自湖南湘西医学设备公司,-20 ℃低温冰箱购自青岛海尔公司,高压锅购自上海博讯医疗生物仪器股份有限公司,酶标仪购自美国Thermo公司。
1.2 动物分组及模型构建 30 只大鼠适应性喂养1周,将其随机分为药物组、模型组、对照组各10只。各组分别行左小腿拍片,排除干扰实验的异常情况。药物组和模型组大鼠采用跟腱切断法诱导HO模型[10]。10%水合氯醛按0.3 mL/100 g 腹腔注射麻醉,于大鼠左后小腿跟部剪毛、消毒、备皮,再予碘酊、乙醇消毒后在无菌条件下,切开皮肤及皮下组织至跟腱,沿跟腱中点处横行切断,在断裂跟腱两端用止血钳反复钳夹5次,跟腱不予缝合,充分止血后以庆大霉素盐水冲洗术口,4号丝线缝合切口。对照组仅切开皮肤、皮下组织,暴露跟腱,但未切断跟腱。造模第1天,药物组给予吲哚美辛10 mg/(kg·d)强制灌胃,模型组与对照组给予同等体积生理盐水强制灌胃,均1 次/d,连续干预4 周。模型制备过程中死亡大鼠5只,给予相应补充。1周左右大鼠伤口愈合良好,无红肿、伤口裂开等现象。
1.3 X 线检查 分别于造模第5、10 周取两组大鼠予10%水合氯醛按0.3 mL/100 g 腹腔注射麻醉,用X线片检查大鼠左后肢正位片,观察大鼠跟腱HO情况。分级标准[11]:无骨化病灶为0级;骨化病灶密度低为Ⅰ级;骨化病灶成高密度影,边界欠清为Ⅱ级;骨化病灶密度高,边界清晰为Ⅲ级。HO 的诊断标准为跟腱部位出现密度影。由2名具有副高级及以上职称放射科医师及2名具有副高级及以上职称骨科医师阅片,比较各组HO情况。
1.4 血清SO检测 采用酶联免疫吸附法。分别于造模前及造模第5、10 周清晨抽取各组麻醉下左侧股静脉血,以EDTA 抗凝管收集血液样本,4 ℃离心机离心(3 500 r/min,15 min),将上清液转移到离心管内,按标本收集时间分别标记,将标本放入-20 ℃冰箱内保存。采用酶联免疫吸附法检测血清SO。试剂盒购自武汉基因美科技有限公司。
1.5 跟腱肉眼观察 分别于造模第5、10 周X 线片检查、血清SO检测后,每组随机处死半数大鼠,切取跟腱组织,肉眼观察跟腱组织。
1.6 统计学方法 采用SPSS20.0 统计软件。计量资料用±s表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验;等级资料比较用秩和检验;计数资料比较采用Fisher 确切概率法检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组造模第5、10 周X 线检查结果比较 造模前大鼠均行左小腿跟腱部位X 线检查均无骨化影。造模第5周,对照组大鼠跟腱均未出现骨化影;模型组大鼠7 只出现骨化影;药物组2 只出现骨化影,骨化区域与模型组相比较小且密度较低。造模第10周,对照组大鼠未见骨化影;模型组5 只出现骨化影,骨化均较第5 周时成熟,骨化区域更大,密度更高;药物组2只出现骨化影,骨化区域与模型组相比较小,密度较低。造模第5、10周,与对照组比较,模型组HO 数量及骨化程度分级均高(P均<0.05);与模型组比较,药物组HO 数量及骨化程度分级均低(P均<0.05)。见表1。
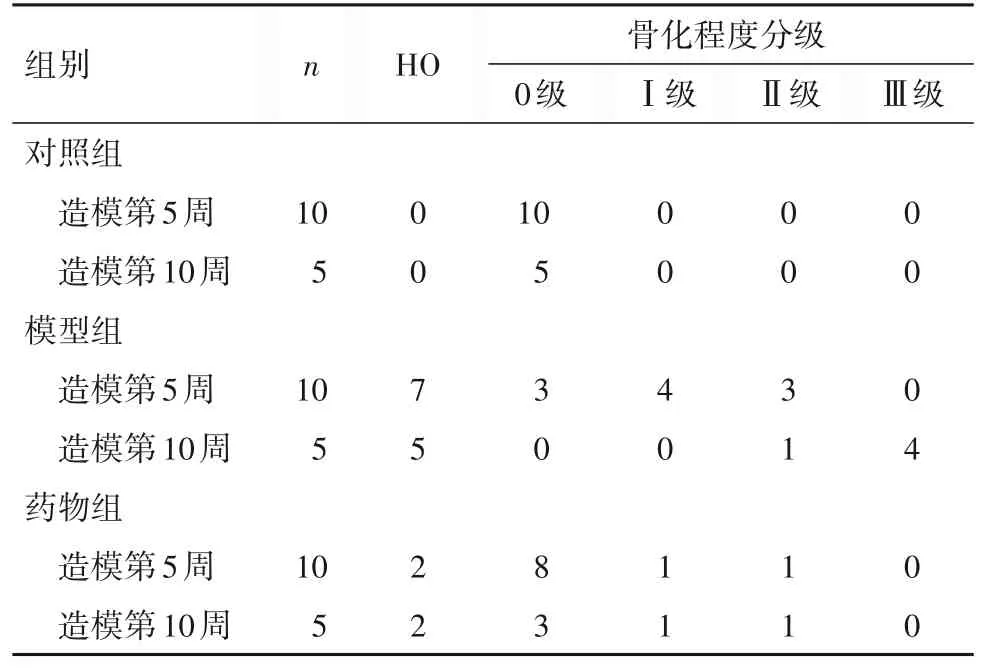
表1 三组造模第5、10周HO数量及骨化程度分级(只)
2.2 各组造模第5、10 周血清SO 水平比较 造模前各组血清SO 水平比较差异无统计学意义(P均>0.05);造模第5、10 周,与对照组比较,模型组血清SO 水平低(P均<0.05);与模型组比较,药物组血清SO水平高(P均<0.05)。见表2。
表2 各组血清SO水平比较[pg/mL,(±s)]
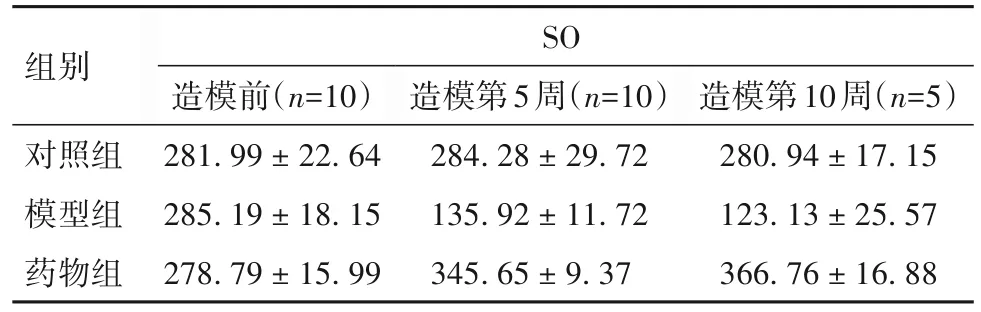
表2 各组血清SO水平比较[pg/mL,(±s)]
组别对照组模型组药物组SO造模前(n=10)281.99±22.64 285.19±18.15 278.79±15.99造模第5周(n=10)284.28±29.72 135.92±11.72 345.65±9.37造模第10周(n=5)280.94±17.15 123.13±25.57 366.76±16.88
2.3 各组造模第5、10 周跟腱肉眼观察结果 正常大鼠跟腱为白色,宽约3 mm,厚约2 mm。造模第5周,对照组大鼠跟腱组织中未发现软骨样组织;模型组跟腱断端肿大增粗呈浅棕黄色,有增生组织相连成条索状,质地硬;药物组跟腱组织质地及体积介于其他两组间,部分组织中有软骨样组织。造模第10周,各组观察结果基本与造模第5周时相似,但模型组硬度更大、范围更广。
3 讨论
HO 在骨科领域比较常见,但发病机制不确切。为了解HO 的病因、发病机制及治疗措施,人们设计并探讨了许多造模方法。LIN 等[10]建立大鼠跟腱切断HO 模型并行X 线评估,第3 周未见HO 形成,第5周60%大鼠出现HO,第10 周所有大鼠出现HO。XU 等[11]采用跟腱切断法诱导HO 模型的实验研究,在第5、10 周两个时间点进行X 线检查,发现模型的成功率较高。本研究采用跟腱切断法对20 只大鼠诱导HO,模型组在第10 周HO 发生率为100%。此方法操作简单,易重复,该实验均由同一人对大鼠跟腱施加相同次数及相同力量的钳夹造成跟腱损伤,保障创伤程度的相对一致性。大鼠的存活率也较高,造模后l~2 周大鼠均恢复正常活动。X 线检查出现骨化影提示HO 形成。于第5 周行X 线检查提示模型组10只大鼠中有7只出现骨化影,第10周时模型组5只大鼠均出现骨化影。模型组在第5、10周跟腱组织中出现软骨样组织。大鼠跟腱切断法诱导HO 模型可能的成骨机制是在组织修复过程中局部炎症增生,巨噬细胞聚集并释放炎症介质刺激间充质干细胞分化;首先是软骨细胞增殖和肥大,基质钙化及血管长入,然后通过软骨化骨的方式形成HO[12]。该动物模型在形态和放射学上与创伤所致HO 病理状态较为接近,近年来已有较多学者采用此种HO模型进行实验研究。
目前对SO 的研究主要集中在骨质疏松以及脊柱骨化等方面。强直性脊柱炎(AS)患者血清SO 水平明显降低,尤其在AS后期脊柱附着点韧带骨化后血清SO 水平降低更为明显。Wnt 信号通路在骨形成方面起重要作用[13],SO 是 Wnt 信号的阻断因子,SO 被骨细胞分泌后通过骨小管到达成骨细胞表面后与LRP5 及LRP6 辅助性受体结合,抑制卷曲蛋白及Wnt 信号与上述受体结合,从而抑制骨形成[14]。当SO 表达下调时,对Wnt 通路的阻断减弱,负向调节骨代谢导致骨密度、骨形成速率和骨骼强度明显增加,骨过度生长,考虑SO 在韧带骨化中起着重要作用。SO 作为成骨指标,在一定程度上反映HO 的骨化程度。本研究结果显示,模型组血清SO 在HO的形成过程中表达下调,提示SO 在血循环中不足,使抑制骨化作用减弱。其机制可能为骨细胞中SO蛋白及 SO mRNA 的表达被抑制,SO 不能与 Wnt 经典信号通路的受体结合,导致Wnt通路抑制解除,从而增加成骨细胞增殖、分化及矿化。成骨细胞的抑制解除,使骨代谢向骨形成方面转化,参与HO 的形成[15]。
影响血清SO 水平下调的因素有很多,包括激素、机械刺激、低氧环境等。在骨折愈合、脊柱韧带骨化及本次试验中模型组结果显示血清SO 水平与对照组相比降低。创伤、炎症等因素引起血管闭塞或断裂导致局部供氧途径发生阻碍,局部供氧减少或者缺乏[16],由此可以推测低氧状态下SO 水平下降,随后SO 作用于成骨细胞的平衡被打破。故SO对成骨细胞的抑制削弱或者解除,成骨细胞增殖、分化的功能开启。能够影响到SO的物质还有很多,比如骨形态发生蛋白、环氧化酶2、基质金属蛋白酶等,它们存在协同或拮抗作用。在本实验中相同条件下可知,SO水平下调导致HO形成。
目前临床上多采用吲哚美辛预防HO[17],使用NSAIDS 成功抑制HO 的发生表明炎性反应参与HO形成,同时也说明药物干预只有在HO 形成的早期有效;一旦HO 形成后药物干预效果较差。吲哚美辛主要通过抑制前列腺素E介导的炎性反应来预防HO 形成;也可以直接抑制间充质细胞向成骨细胞分化。本实验在动物模型上给予吲哚美辛预防HO,结果显示用药后第5、10 周,药物组较模型组中SO水平高。造模后第5周影像学X线检查提示药物组有2 只出现骨化影,第10 周时2 只大鼠出现骨化影,与模型组比较差异具有统计学意义。说明吲哚美辛能够上调SO 在大鼠跟腱局部异位骨组织的表达,阻止成骨活动的发展。本实验用吲哚美辛预防HO 形成,改变了HO 形成的微环境并抑制了成骨因子的作用。
综上所述,吲哚美辛可抑制或减缓HO 的形成,其机制可能与上调SO 水平有关。创伤后HO 血清SO 水平可作为一种新的诊断指标及反映骨化进展的生物学标志物。未来需探讨NSAIDS 类药物治疗HO 过程中相关蛋白的变化,进一步了解NSAIDS 治疗HO的机制。

