降糖干预对妊娠期糖尿病患者胰岛α、β 细胞功能及炎症因子水平的影响
唐正和,刘翠明,马学芹,董丽华,吴融花
山东第一医科大学附属莱钢医院,济南271126
妊娠期糖尿病(GDM)是一种妊娠前糖代谢正常或有潜在的糖耐量减退,但在妊娠期才出现或确诊的糖尿病[1],是妊娠期常见病之一,其发病率逐年上升,最新的研究表明目前GDM 的发病率高达8.1%[2]。随着国家二胎政策的实施,高龄孕妇增多,GDM 的患病率也相应升高,围产期母婴不良结局增加,且产妇远期2 型糖尿病发病风险明显增加[3]。GDM 的确切病因及发病机制迄今尚不明确,胰岛素(INS)抵抗(IR)、炎症以及胰高血糖素(GL)分泌异常都可能参与了GDM 的发病。目前,对GDM 患者胰岛β 细胞功能研究较多,对胰岛α 细胞功能及炎症因子的研究较少。本研究探讨降糖干预对GDM 患者胰岛α、β 细胞功能及炎症因子水平的影响,为临床治疗提供依据。
1 资料与方法
1.1 临床资料 选择2018年12月—2019年9月本院就诊的孕妇65 例,孕周24~28(26.38 ± 1.84)周。纳入标准:GDM 组符合 GDM 的诊断标准[4];病历资料完整。排除标准:多胎妊娠;妊娠前诊断为1型糖尿病或2型糖尿病;有糖尿病家族史;妊娠前存在高血压;伴严重的心、肝、肾等慢性疾病;妊娠期HbA1c>6.5%;近3 个月有急慢性感染、手术、外伤等临床情况。根据口服葡萄糖耐量试验(OGTT)分为GDM组 32 例、正常糖耐量(NGT)组 33 例。NGT 组年龄(25.73 ± 0.84)岁,孕周(24.13 ± 1.68)周,BMI(24.20 ± 1.86)kg/m2;GDM 组年龄(29.22 ± 3.31)岁,孕周(29.22±3.31)周,BMI(25.04±1.91)kg/m2。两组年龄比较差异有统计学意义(P<0.05),孕周、BMI 比较差异无统计学意义(P均>0.05)。两组均签署知情同意书;本研究经医院医学伦理委员会批准。
1.2 GDM 组治疗方法 对GDM 组进行糖尿病教育,给予饮食控制,血糖仍未达标者给予精蛋白生物合成人INS 注射液(预混50R)于早晚餐前30 min 皮下注射,根据患者血糖水平及体质量制定个体化起始剂量,复查血糖,根据血糖控制情况调整药物剂量,直至血糖持续稳定达标至少2周。
1.3 观察指标与方法 抽取两组清晨空腹静脉血10 mL;采血后进行OGTT,口服75 g 无水葡萄糖(溶于 250~300 mL 水中,于 5 min 内服完),分别于OGTT 1、2、3 h 抽取静脉血送检。血液标本经离心(3 000 r/min,离心15 min,离心半径10 cm),留取血浆,置于-80 ℃冷藏器中备用。空腹血标本用于测定空腹血糖(FPG)、空腹胰岛素(INS,OGTT 0 h)、空腹胰高血糖素(GL,OGTT 0 h)、糖化血红蛋白(HbA1c)、IL-6、TNF-α、CRP。OGTT 1、2、3 h 血液标本用于测定血糖(GLU,OGTT 1、2、3 h)、INS(OGTT 1、2、3 h)、GL(OGTT 1、2、3 h)。①血糖检测:用葡萄糖氧化酶法检测 FPG 及 OGTT 1、2、3 h GLU,计算GLU 曲线下面积(AUCGLU),AUCGLU=(FPG+3 h GLU)/2+1 h GLU+2 h GLU;用离子交换高效液相色谱法测定HbA1c。②胰岛α 细胞功能指标检测:用放射免疫法测定OGTT 0、1、2、3 h GL,计算GL 曲线下面积(AUCGL),AUCGL=(0 h GL+3 h GL)/2+1 h GL+2 h GL。③胰岛β细胞功能指标检测:用电化学发光法检测 OGTT 0、1、2、3 h INS,计算INS 曲线下面积(AUCINS)、稳态模型INS 抵抗指数(HOMA-IR)及AUCINS/AUCGLU,AUCINS=(0 h INS+3 h INS)/2+1 h INS+2 h INS,HOMA-IR=FPG×空腹INS/22.5。④炎症因子检测:用ELISA法检测IL-6、TNF-α,用免疫比浊法检测CRP。GDM 组治疗后血糖持续达标2周再行OGTT,复查上述指标。
1.4 统计学方法 采用SPSS22.0 统计软件。计量资料用±s表示,比较采用t检验或重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组血糖水平比较 与NGT 组比较,治疗前GDM 组 FPG 及 OGTT 1、2、3 h GLU、AUCGLU 高(P均<0.05),两组HbA1c 比较差异无统计学意义(P>0.05);与治疗前比较,治疗后GDM 组FPG 及 OGTT 1、2、3 h GLU、AUCGLU 均降低(P均<0.05),HbA1c降低但差异无统计学意义(P>0.05)。见表1。
2.2 两组胰岛α细胞功能指标水平比较 与NGT组比较,治疗前GDM组OGTT 0、1、2、3 h GL及AUCGL均高(P均<0.05);与治疗前比较,治疗后GDM组OGTT 0、1、2、3 h GL及AUCGL均降低(P均<0.05)。见表2。
表1 两组血糖水平比较(±s)
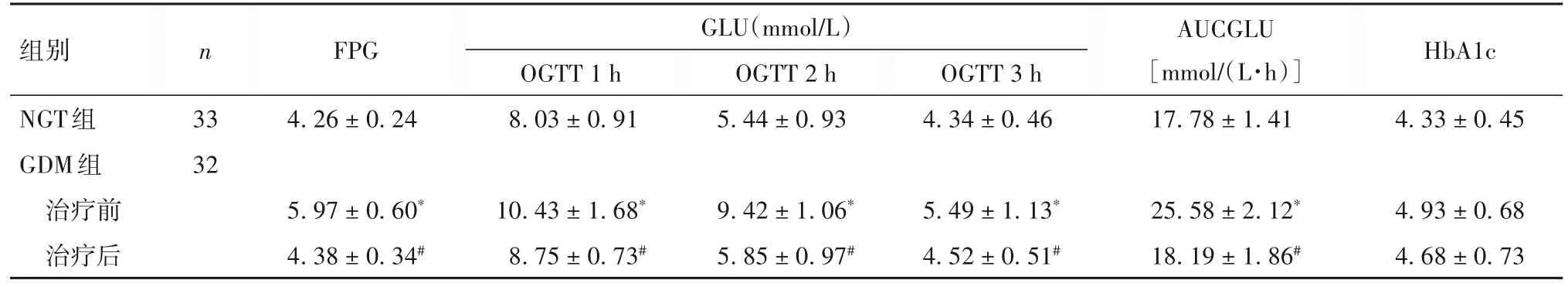
表1 两组血糖水平比较(±s)
注:与NGT组比较,*P<0.05;与同组治疗前比较,#P<0.05。
组别NGT组GDM组治疗前治疗后n 33 32 FPG 4.26±0.24 5.97±0.60*4.38±0.34#GLU(mmol/L)OGTT 1 h 8.03±0.91 10.43±1.68*8.75±0.73#OGTT 2 h 5.44±0.93 9.42±1.06*5.85±0.97#OGTT 3 h 4.34±0.46 5.49±1.13*4.52±0.51#AUCGLU[mmol/(L·h)]17.78±1.41 25.58±2.12*18.19±1.86#HbA1c 4.33±0.45 4.93±0.68 4.68±0.73
表2 两组胰岛α细胞功能指标水平比较(±s)

表2 两组胰岛α细胞功能指标水平比较(±s)
注:与NGT组比较,*P<0.05;与同组治疗前比较,#P<0.05。
组别NGT组GDM组治疗前治疗后n 33 32 GL(pg/mL)OGTT 0 h 136.00±31.95 164.15±53.93*139.90±45.94#OGTT 1 h 107.69±29.91 194.15±81.08*156.71±70.32#OGTT 2 h 103.80±25.84 207.70±64.36*162.58±68.76#OGTT 3 h 89.52±17.28 192.46±52.52*152.13±59.17#AUCGL[mmol/(L·h)]324.24± 44.07 573.16±103.48*462.54± 79.21#
2.3 两组胰岛β 细胞功能指标水平比较 与NGT组比较,治疗前 GDM 组 HOMA-IR 及 OGTT 0、2、3 h INS、AUCINS均高(P均<0.05),OGTT 1 h INS及AU⁃CINS/AUCGLU 均低(P均<0.05);与治疗前比较,治疗后GDM 组HOMA-IR 及OGTT 0、1、2、3 h INS、AU⁃CINS 均降低(P均<0.05),AUCINS/AUCGLU 升高(P<0.05)。见表3。
2.4 两组炎症因子水平比较 与NGT 组比较,治疗前GDM 组IL-6、TNF-α、CRP 水平高(P均<0.05);与治疗前比较,治疗后 GDM 组 IL-6、TNF-α、CRP 水平降低(P均<0.05)。见表4。
3 讨论
近年来,随着人们生活水平不断提高、饮食习惯的改变以及二胎政策的开放,GDM 的发病率呈上升趋势[5-6]。有研究证实,GDM 会导致孕妇及胎儿产生一系列严重的近、远期并发症或合并症,进一步影响母婴的生命健康[7]。目前,GDM 的发病机制尚不完全清楚,有关GDM 患者胰岛β 细胞功能的研究较多,认为胰岛β 细胞功能缺陷和INS 抵抗是GDM 发病的最主要机制[8],且GDM 患者胰岛 β 细胞功能缺陷呈进行性进展[9-10],但对胰岛α 细胞功能和炎症因子在GDM 发病中的作用研究较少,为进一步探讨GDM 发病机制,尤其是探讨胰岛α 细胞功能和炎症因子在GDM发病中的作用,我们开展了此研究。
表3 两组胰岛β细胞功能指标水平比较(±s)

表3 两组胰岛β细胞功能指标水平比较(±s)
注:与NGT组比较,*P<0.05;与同组治疗前比较,#P<0.05。
组别NGT组GDM组治疗前治疗后n 33 32 HOMA-IR 1.56±0.50 3.70±0.85*2.53±0.72#INS(pmol/L)OGTT 0 h 49.61±16.34 84.15±19.48*75.43±23.13#OGTT 1 h 516.28±150.51 392.52±122.75*302.43±110.54#OGTT 2 h 326.59±129.26 452.64±166.55*385.89±125.39#OGTT 3 h 105.36± 37.51 333.80±136.25*210.41± 88.34#AUCINS[mmol/(L·h)]920.36±271.05 1 054.13±216.02*829.69±176.85#AUCINS/AUCGLU 52.22±16.43 41.45± 9.20*50.14±10.32#
表4 两组IL-6、TNF-α、CRP水平比较(±s)

表4 两组IL-6、TNF-α、CRP水平比较(±s)
注:与NGT组比较,*P<0.05;与同组治疗前比较,#P<0.05。
组别NGT组GDM组治疗前治疗后n 33 32 IL-6(ng/mL)63.26± 9.86 93.54±13.21*71.02± 8.97#TNF-α(ng/mL)4.09±0.39 6.53±0.71*5.01±0.67#CRP(mg/L)1.69±0.54 6.01±1.78*3.86±1.05#
妊娠年龄是GDM 的独立危险因素,本研究中,GDM 组的妊娠年龄也高于NGT组,提示孕妇年龄越大,罹患GDM 的风险也越高。在正常妊娠状态下体内拮抗INS 的激素如催乳素、胎盘生乳素、孕激素等分泌增加,易导致INS 抵抗,胰岛β 细胞需要代偿性分泌更多的INS 来维持血糖正常,一旦失代偿,即可引起血糖升高,导致GDM 的发生。本研究也证实,GDM 组各时间点血糖均高于NGT 组。HbA1c 反映近8~12 周血糖水平。本研究中GDM 组血糖高于NGT 组,但两组HbA1c 比较差异无统计学意义。考虑可能与患者病程尚短,还未导致HbA1c 升高有关。
胰岛α 细胞主要分泌GL,故空腹GL 水平用于评价基础状态下胰岛α 细胞功能;AUCGL 用于评价糖负荷状态下胰岛α 细胞功能。正常情况下,进餐后血糖升高抑制α 细胞分泌GL,减少肝糖输出,防止餐后高血糖;空腹时血糖水平下降,GL分泌增多,促进糖异生、肝糖输出,避免空腹低血糖。GL 分泌异常是餐后血糖调节异常的重要因素[11]。本研究显示,GDM 组 OGTT 0、1、2、3 h GLU 水平及 AUCGL 高于NGT 组,证实GDM 患者存在GL 分泌增多。可能与高糖毒性有关。高血糖减弱了α细胞对血糖的敏感性,当出现高血糖时,葡萄糖抑制GL 分泌的能力减弱,GL的分泌不能随之减少。GDM患者胰岛α细胞分泌GL 增多,对葡萄糖的敏感性下降,与2 型糖尿病患者相似[12]。
胰岛β 细胞主要分泌INS,空腹INS 水平用于评价基础状态下胰岛β 细胞功能;AUCINS、AUCINS/AUCGLU 用于评价糖负荷状态下胰岛β 细胞分泌功能;HOMA-IR 用来评估INS 抵抗程度。本研究发现,GDM 组 HOMA-IR 高于 NGT 组,提示 GDM 患者较正常妊娠妇女存在更为强烈的IR,与施凤涟等[13]研究结论一致。INS 分泌模式缺陷在葡萄糖负荷下暴露会更充分[14]。本研究采用葡萄糖负荷前后各时间点的INS、AUCINS、AUCINS/AUCGLU 来评估胰岛β 细胞分泌 INS 的功能状态。AUCINS、AUCINS/AUCGLU 都是反映胰岛β 细胞功能的指标,代表了葡萄糖负荷状态下胰岛β 细胞分泌INS 的能力,但AUCINS/AUCGLU 同时结合了血糖水平,比单纯的AUCINS 更能准确反映葡萄糖负荷状态下胰岛β 细胞分泌INS 的能力。本研究结果显示,GDM 组OGTT 0、2、3 h INS及AUCINS 较NGT 组高,AUCINS/AUCGLU 较 NGT 组低。提示 GDM 患者胰岛 β 细胞代偿性分泌INS 增多,尽管如此,相对于葡萄糖负荷后增高的血糖水平而言,这种代偿性的INS 分泌作用仍显不足,提示GDM 患者存在葡萄糖负荷后胰岛β 细胞功能降低。此外,本研究还显示,GDM 组OGTT 1 h INS 低,INS 分泌高峰出现在 OGTT 2 h。提示GDM 患者同时存在INS 分泌异常,表现为INS分泌高峰延迟。
近年来,炎症与胰岛功能的关系越发受到关注。研究表明,炎症因子升高可影响胰岛β 细胞功能,导致IR,二者关系密切[15-16]。IL-6、TNF-α 和CRP为体内较为常见的炎症因子,参与并介导机体炎症反应的多个过程,是反映机体炎症的指标。IL-6 由单核巨噬细胞、T 淋巴细胞等分泌,可影响IR。TNF-α 主要由单核巨噬细胞分泌,可使脂肪细胞中的转运葡萄糖的蛋白活性表达降低,IR 程度增强,在IR 中也发挥重要作用。CRP 为急性时相蛋白,其水平上升与IR、糖尿病等密切相关,高糖毒性可刺激CRP 分泌增多,进一步加重糖尿病的进展[17]。本研究也发现,GDM 组 IL-6、TNF-α 和 CRP 高于 NGT组,提示GDM 患者体内炎症因子水平升高,其通过诱发或增强IR参与了GDM的发生发展。
本研究对GDM 患者进行了降糖干预。在给予饮食控制和胰岛素治疗后,GDM 患者FPG,OGTT 1、2、3 h GLU,AUCGLU,OGTT 0、1、2、3 h GL,AUCGL,HOMA-IR,OGTT 0、1、2、3 h INS,AUCINS,IL-6,TNF-α,CRP 均降低,AUCINS/AUCGLU 升高,提示GDM患者经治疗后血糖、胰岛α和β细胞功能改善,炎症减轻。因此上述改变可能是因为经干预治疗后糖毒性减轻,炎症因子水平下降,从而减轻IR,同时糖毒性缓解后,α 细胞对血糖的敏感性也改善。此外,研究发现,经干预治疗后,GDM 患者INS 分泌高峰仍出现在OGTT 2 h,提示干预治疗虽可改善GDM患者胰岛β细胞功能,尚不能改善其分泌模式异常,同时,其HbA1c 虽较治疗前降低,但差异无统计学意义,考虑可能与患者血糖达标时间尚短,还不足以引起HbA1c 降低有关。尽管如此,对GDM 患者而言,饮食控制及胰岛素治疗仍然是一种行之有效的治疗措施。
综上所述,本研究提示,GDM 患者既存在IR 和胰岛β 细胞功能缺陷,也存在胰岛α 细胞功能异常,同时存在炎症因子水平异常,这与T2DM 的发病机制极为相似。高糖毒性、胰岛α 细胞功能异常、IR、胰岛β 细胞功能缺陷以及炎症因子之间相互影响,共同参与 GDM 的发生发展。KHAN 等[18]认为,GDM和糖耐量减低均是 T2DM 的前期,GDM 与 T2DM 有类似的代谢异常与发病基础[19]。本研究结果也支持上述观点,因此,GDM患者也是T2DM高危人群。积极的生活方式干预和INS 治疗有很好的疗效,可有效缓解高糖毒性,减轻胰岛α细胞功能异常,减轻IR和胰岛β细胞功能缺陷,降低炎症因子水平,是目前国内治疗GDM 的主要措施。本研究还存在不足之处,样本量有限,观察时间短,未跟踪观察GDM 患者妊娠后期的胰岛α、β 细胞功能及炎症因子变化,也缺乏炎症因子与胰岛α 细胞功能之间关系的研究。还需扩大样本,延长观察时间,获取更多的数据。

