肝癌组织miR-200家族的表达水平及其与免疫检查点分子PD-L1的关系
王晓露,张 缨,江龙委,秦 峰,贾绍昌
0 引 言
肝癌是严重威胁人类健康的一种消化道肿瘤,具有较高的发病率和病死率。全球范围内,原发性肝癌的发病率位居各类肿瘤第6位,病死率位居第2位[1]。尽管手术切除或肝移植是治疗肝癌的有效方法,但大多数肝癌发病时已为晚期,手术切除后复发率较高;且部分患者无法手术切除[2]。近年来研究发现免疫治疗,尤其是免疫检查点抑制剂对于多数肿瘤具有良好效果[3-4]。目前,基于PD-1/PD-L1的免疫检查点抑制剂已有多种产品上市,主要针对包括恶性黑色素瘤、非小细胞肺癌、肝癌、胃癌、肾癌、膀胱癌、头颈部肿瘤、霍奇金淋巴瘤等以及所有微卫星高度不稳定(MSI-H)的实体瘤[5-6]。虽然PD-1对于以上肿瘤的应用已经取得一定成功,但其总体有效率仍不理想。多项临床研究结果显示,其在肝癌中客观临床反应率仅为10%~20%[7-8]。对于疗效的提高成为当前PD-1研究的热点。
miR-200是一种与肿瘤发生发展密切相关的microRNA,包括miR-141、miR-200a/200b/200c 及miR-429在内的5种类型[9-10]。研究表明,miR-200可抑制肿瘤的上皮间质转化,肿瘤细胞的迁移,肿瘤干细胞的自我更新及分化,并在部分肿瘤中能逆转肿瘤耐药性[11-13]。因此,miR-200可能具有调控PD-1/PD-L1的作用。本文旨在研究miR-200与PD-L1的关系,以期为增强PD-1抑制剂的抗肿瘤作用提供参考。
1 资料与方法
1.1 研究对象收集2018年6月-2019年8月期间东部战区总医院秦淮医疗区60例行手术治疗原发性肝细胞癌患者的癌旁组织及肝癌组织标本。所有病例均经病理检测为肝细胞癌并排除合并其他肿瘤。本研究经伦理委员会通过(批件号:81YY-KYLL-18-07),患者及家属均知情同意并签署同意书。
1.2主要材料人肝癌HepG2细胞系由中国科学院上海生物细胞研究所提供,于10%FBS的DMEM培养液(Gibco公司产品)、37 ℃、5%CO2的培养箱中培养。PD-L1检测试剂盒选择Ventana公司生产的SP263兔单抗,在Ventana平台进行检测。TriZol试剂盒购自Invitrogen公司。3个miRNA类似物(mimics)化学合成由广州锐博生物公司进行。CCK-8试剂盒购自碧云天公司产品。
1.3方法
1.3.1 PD-L1免疫组化检测免疫组织化学染色过程参照SP试剂盒说明进行。所选标本中肿瘤细胞数不少于100个,以扁桃体组织作为阳性对照。免疫组化阳性染色部位定位于细胞膜上。结果判读:根据肿瘤比例评分(tumor proportion score,TPS)进行等级划分,以任意膜染色强度TPS≥1%定义为PD-L1表达阳性[14]。
1.3.2miR-200家族qRT-PCR检测新鲜样本经TriZol试剂盒裂解提取总RNA。qRT-PCR试剂盒检测miR-200a、miR-200b、miR-200c水平。按照试剂盒说明将RNA逆转录为cDNA模板,采用TaqMan miRNA探针对miRNA进行定量。U6小核RNA(small nuclear RNA,snRNA)作为内参。使用循环阈值(cycle threshold,CT)计算RNA的相对表达量。取3次qRT-PCR结果计算平均CT值。
1.3.3肝癌HepG2细胞过表达miRNA实验合成上述3个miRNA的类似物(mimics),以miNC为阴性对照。在24孔板中按每孔1×105细胞数接种HepG2细胞,24 h细胞贴壁后,换无血清培养液并加入miRNA mimics,每孔的终浓度20 μg/mL,继续培养48 h。收集细胞,采用TriZol试剂盒提取总RNA,qRT-PCR检测miR-200a、miR-200b、miR-200c的表达水平。
1.3.4蛋白质印迹法检测PD-L1的表达上述转染miR-200a、miR-200b、miR-200c mimics的HepG2细胞,培养48 h后收集细胞,将细胞在RIPA缓冲液中裂解,于冰上提取蛋白。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离并转移至PVDF膜上,用5%牛血清白蛋白封闭1 h,并在4 ℃摇床下与一抗抗PD-L1孵育过夜。次日将膜用TBST缓冲液洗涤3次,后与偶联至辣根过氧化物酶的二抗共同孵育1 h。免疫印迹条带用Image J软件定量并标准化。
1.3.5CCK-8法检测miR-200对HepG2细胞增殖能力的影响按CCK-8试剂盒(碧云天公司产品)说明进行细胞增殖活性的检测。在96孔板中按每孔1×103细胞数接种HepG2细胞,24 h细胞贴壁后,换无血清培养液。同时加入miRNA mimics,每孔终浓度20 μg/mL,继续培养0、24、48、72、96 h;弃培养液后,加入0.1 mol/L PBS溶液100 μL/孔,再加CCK8试剂,置孵箱内孵育过夜;酶标仪上读取吸光度值,绘制细胞生长曲线。
1.3.6PD-L1与miR-200家族调控的EGFP报告基因测定合成PD-L1基因的3′-UTR序列的2个片段F1和F2,F1(5′-AGAGTCTCAGTGTTG-3′)含有miR-200a的结合位点,F2(5′-AACGGGACAGTATTT-3′)含有miR-200b、miR-200c的结合位点。F1和F2分别插入pDC315质粒中,构建EGFP报告基因载体pDC315-F1和pDC315-F2质粒。
HepG2细胞铺96孔板,每孔1×103细胞数。培养24 h后,换无血清培养液,加入miRNA mimics和阴性对照miNC,每孔终浓度20 μg/mL。24 h后每孔转染pDC315-F1或pDC315-F2 200 ng,继续培养48 h,荧光显微镜下观察EGFP表达活性。构建含有PD-L1基因3′-UTR的EGFP报告基因载体pDC315-F1和pDC315-F2,与pRL-TK质粒共转染HepG2细胞,48 h后检测EGFP表达情况。
1.4统计学分析应用SPSS 18.0软件进行分析。计数资料以n(%)表示,组间比较采用2检验;计量资料以形式表示,组间比较采用t检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 临床标本的PD-L1免疫组化检测本组纳入肝癌组织检出PD-L1总阳性率为58.33%(36/60),显著高于癌旁组织阳性率(8.33%),差异有统计学意义(P<0.05)。见图1。
2.2临床标本的miR-200家族qRT-PCR检测肝癌患者癌组织中miR-200a(4.26±0.99vs30.89±4.78,P=0.0007)、miR-200b(9.59±2.04vs26.19±3.79,P=0.0026)、miR-200c(10.37±2.20vs18.70±3.35,P=0.023)含量均明显低于癌旁组织,差异均具有统计学意义(P<0.05)。
2.3临床标本中miR-200a、miR-200b、miR-200c的表达水平与PD-L1的关系本组PD-L1表达阳性患者相比阴性患者具有更低水平的miR-200家族表达量。其中miR-200a相比阴性患者(2.53±0.49vs4.99±0.64,P=0.0061)、miR-200b(7.56±1.03vs11.67±1.06,P=0.0084)、miR-200c(8.03±1.52vs11.86±1.65,P=0.0412),差异均有统计学意义。
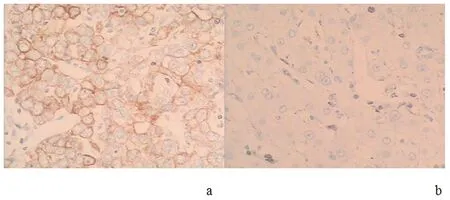
a:肝癌组织;b:癌旁组织
2.4肝癌HepG2细胞过表达miR-200a、miR-200b、miR-200c后PD-L1的表达情况PD-L1在癌细胞miR-200a、miR-200b、miR-200c含量均显著升高,差异均有统计学意义(P<0.05)。见图2。
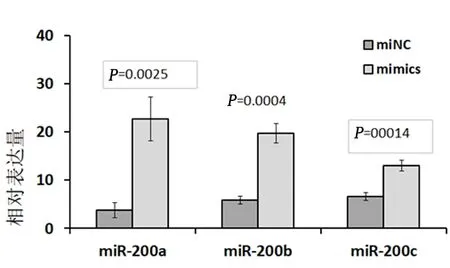
图 2 HepG2 细胞转染mimics后miR-200a、miR-200b、miR-200c的过表达情况
HepG2细胞转染3种miRNA mimics后, PD-L1表达水平均有显著下调,见图3。
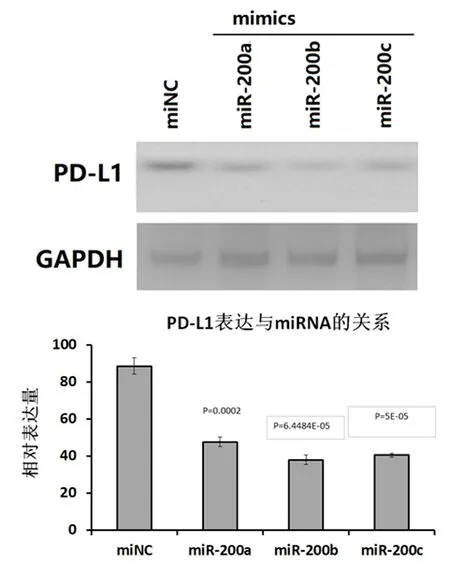
图 3 HepG2 细胞转染mimics后PD-L1表达情况
2.5过表达miR-200a、miR-200b、miR-200c对HepG2细胞增殖活性的影响转染miRNA mimics后,癌细胞存活比率下降,且随时间延长存活率逐渐下降。其中miR-200a导致的存活率最低,miR-200c其次,miR-200b最高,见图4。
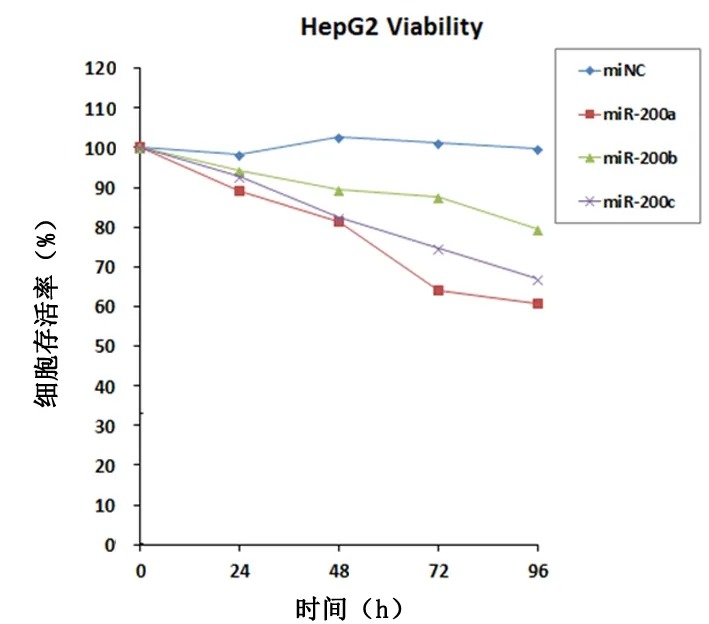
图 4 HepG2 细胞转染mimics后增殖活性情况
2.6PD-L1与miR-200家族调控的EGFP报告基因测定miR-200a mimics可使pDC315-F1的EGFP表达下调,miR-200b和miR-200c的mimics可使pDC315-F2的EGFP表达下调。结果提示,PD-L1是miR-200家族的靶基因,miR-200家族可直接下调PD-L1的表达,见图5。
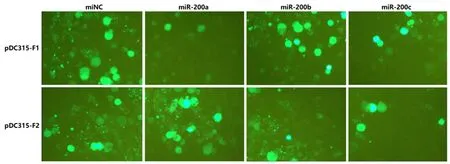
图 5 miR-200家族对含PD-L1基因的荧光报告质粒的作用情况
3 讨 论
由于免疫检查点抑制剂在肿瘤治疗上的巨大潜力,PD-1/PD-L1的调控成为当前的研究热点。研究表明,PD-1/PD-L1的调控与microRNA密切相关。在非小细胞肺癌中,miR-200家族是PD-L1的调控基因之一[15-16]。Chen等[15]研究发现在原发性非小细胞肺癌中,PD-L1的高表达与上皮间质转化有直接关系,且可以受到miR-200的调控。证明miR-200能抑制肿瘤细胞上皮间质转化及肿瘤转移并直接靶向PD-L1。Gibbons等[16]也发现miR-200的低表达与PD-L1的高表达相关,并导致肿瘤细胞的增殖、转移能力上升及CD8+ T细胞浸润的下降。本研究的结果显示在60例原发性肝细胞癌组织样本中,miR-200a、miR-200b、miR-200c在癌组织中的表达显著低于癌旁组织,而PD-L1在癌组织中的表达显著高于癌旁组织,进一步分析发现miR-200a、miR-200b、miR-200c与PD-L1呈反向相关关系。本结果与前述非小细胞肺癌中的结果类似,证明在肝癌中miR-200家族的表现与非小细胞肺癌中相似。
为进一步研究miR-200家族的功能,本研究合成了miR-200a、miR-200b、miR-200c的mimics,并转入肝癌细胞株HepG2。结果显示mimics能发挥预期作用,使miR-200a、miR-200b、miR-200c表达上升;而miR-200a、miR-200b、miR-200c表达上升后PD-L1表达下降,同时癌细胞的增殖活性显著下降,说明miR-200a、miR-200b、miR-200c能负向调控PD-L1的表达,同时降低肝癌细胞的增殖能力。与非小细胞肺癌中的研究结果类似。
前述结果证明了miR-200家族在肝癌中能调控PD-L1的表达,为了验证这种调控是直接的还是间接的,本研究利用荧光报告基因实验证明了miR-200a、miR-200b、miR-200c直接靶向PD-L1的3′-UTR,证明了PD-L1是miR-200家族的靶点之一。本研究对miR-200家族的功能研究不够完善,仅分析癌细胞的增殖活性,并未对miR-200家族与癌细胞的转移及与免疫细胞相互作用情况进行深入探讨。
综上所述,本研究通过对人肝细胞癌组织标本进行分析,证明miR-200家族与PD-L1呈负相关关系;又通过体外实验证明肝癌中miR-200能直接靶向PD-L1对其进行负向调控,同时miR-200家族能抑制肝癌细胞的增殖。提示miR-200可能在PD-1/PD-L1免疫检查点治疗肝癌患者中发挥作用,具有一定的临床治疗潜力。

