牛樟叶水提物对 D-半乳糖致衰老模型小鼠的作用机制研究*
张 蓓,余潇苓,万永艳,梁学政,覃开羽△
(1.广西壮族自治区柳州市中医医院,广西 柳州 545026; 2.浙江中医药大学附属第一医院,浙江 杭州 310006)
牛樟 Cinnamomum Kanehirae Hayata分布在中国南部,为台湾特有树种,近年来被中国大陆地区多地引进栽培。其根、皮、果、叶均可入药,但功效略有不同,牛樟叶的功效以祛风除湿、止痛、杀虫为主[1]。现代研究主要以牛樟的无性繁殖、引种栽培、生长特性和分子鉴定为主[2-3],药学部分仅见牛樟叶精油成分研究,未见药理和化学成分的报道[4]。衰老是生物生命周期的重要组成部分,是任何生命活动的必然规律,虽不可阻滞,但可延迟。随着世界人口老龄化的加快,探讨延缓衰老作用机制和抗衰老研究已成为医学领域的热门课题之一。自由基理论是衰老机制的重要理论之一,以氧化应激为特点的氧化还原失衡是衰老的重要病理进程[5-6]。多糖类物质是抗衰老的活性成分[7]。课题组前期研究发现,牛樟叶富含多糖成分,但尚未阐明牛樟叶多糖延缓衰老的药效和作用机制。本研究中建立 D-半乳糖衰老小鼠模型,以抗氧化相关酶为指标,探讨了牛樟叶水提物(AECL)的抗衰老作用及其作用机制。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:Epoch型全波长酶标仪(美国Bio Tek公司);ME204E型分析电子天平(梅特勒-托利多仪器<上海>有限公司,精度为0.01 mg);UV1780-5型紫外分光光度计(岛津企业管理<中国>有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司,功率为240 W,频率为 40 kHz,转速为 500 ~5 000 r/min)。
试药:维生素E(桂林南药股份有限公司,批号为VE181101);D-半乳糖(上海惠兴生化试剂有限公司,批号为120214)。超氧化物歧化酶(SOD)试剂盒(批号为20190815),谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号为 20190414),一氧化氮 (NO)试剂盒(批号为20181114),总抗氧化能力 (T-AOC)试剂盒(批号为20190801),过氧化氢酶(CAT)试剂盒(批号为20190719),BCA 试剂盒(批号为 20190815),均购自南京建成生物工程研究所。牛樟叶由柳州市天姿园艺有限公司提供,经广西中医药大学药学院杨柯教授鉴定为正品,标本保存于广西壮族自治区柳州市中医医院药学部标本室。
动物:清洁级 KM 小鼠 60 只,体质量(20±2)g,雌雄各半,购自湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2016-0002。饲养环境为温度(23±2)℃,相对湿度 60% ~65% ,明暗 12 h/12 h交替,分笼饲养,给予标准饲料,自由进食、饮水。
1.2 方法
1.2.1 衰老动物模型建立
每天于小鼠颈背部皮下注射 D-半乳糖100 mg/kg,连续造模20 d后,每周周一、周四按相同方法造模2次,共 3 周[8]。
1.2.2 分组及给药
称取干燥牛樟叶10 kg,按物料30倍、20倍加水,加热提取3次,每次3 h,合并3次滤液,常压加热,浓缩至流浸膏,分装,4℃冰箱冷藏保存,备用,流浸膏1 g相当于8.805 g牛樟叶,即得AECL。取造模后10 d的KM小鼠,雌雄各半,按体质量随机分为5组,即模型组(B组),阳性对照组(C 组,维生素 E,200mg/kg),AECL 高、中、低剂量组[D1组、D2组、D3组,给药剂量相当于每1kg体质量20,10,5 g(生药)],每组 10 只;另取 10 只同批健康 KM种小鼠,雌雄各半,作为正常对照组(A组)。C组和D1,D2,D3组灌胃给药,每日2次,连续30 d,A组和B组给予等体积生理盐水。末次给药2 h后,摘取眼球取血,分离血清,立即处死动物,剖取肝脏、心脏、肾脏、脑。
1.3 观察指标
分离血清和肝、心、肾、脑组织匀浆后,严格按试剂盒说明书方法检测相应组织器官的SOD,GSH-Px,CAT,T-AOC,NO 水平。
1.4 统计学处理
2 结果
2.1 药效学评价
D-半乳糖干预5周后,小鼠出现行动迟缓,皮毛逐渐无光泽和变灰色,体质量逐渐下降,表现出明显的衰老特征。与A组比较,B组小鼠血清中SOD,GSH-Px,T-AOC水平均明显下降(P<0.05),表明成功构建D-半乳糖衰老小鼠模型。与B组比较,C组、D1组、D2组小鼠血清中SOD和GSH-Px水平均明显升高,C组、D1组 SOD,GSH-Px,T-AOC水平差异均显著升高(P <0.05)。详见表 1。
表1 AECL对 D-半乳糖衰老小鼠血液生化指标的影响(±s,n=10)Tab.1 Effect of AECL on blood biochemical indexes of D-galactose-induced aging mice(±s,n=10)
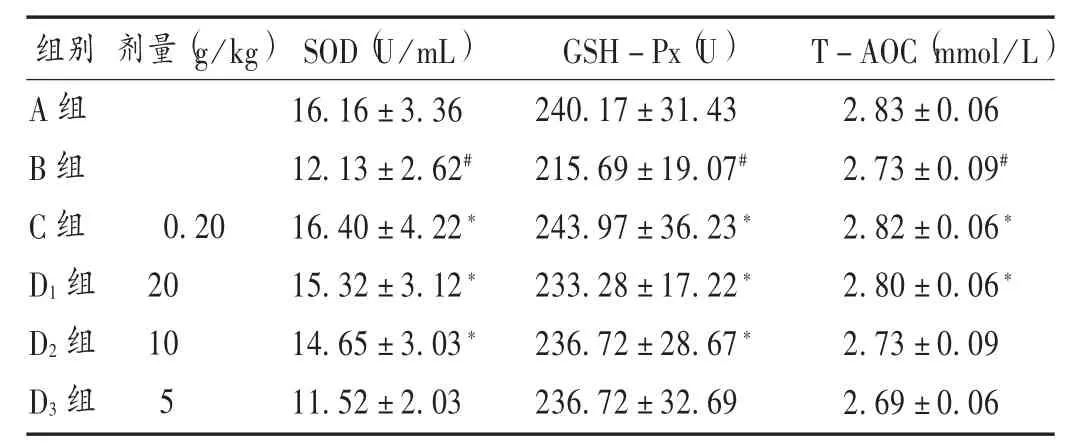
表1 AECL对 D-半乳糖衰老小鼠血液生化指标的影响(±s,n=10)Tab.1 Effect of AECL on blood biochemical indexes of D-galactose-induced aging mice(±s,n=10)
注:与A组比较,#P<0.05;与B组比较,*P<0.05。下表同。Note:Compared with those in group A,#P < 0.05;compared with those in group B,*P < 0.05;as well as the following tables.
组别 剂量(g/kg)SOD(U/mL)GSH-Px(U)T-AOC(mmol/L A组B组C组D1组D2组D3组0.20 20 10 5 16.16±3.36 12.13±2.62#16.40±4.22*15.32±3.12*14.65±3.03*11.52±2.03 240.17±31.43 215.69±19.07#243.97±36.23*233.28±17.22*236.72±28.67*236.72±32.69)2.83±0.06 2.73±0.09#2.82±0.06*2.80±0.06*2.73±0.09 2.69±0.06
表2 AECL对 D-半乳糖衰老小鼠肝脏、心脏SOD和CAT及肾脏SOD的影响(±s,U/μg pro,n=10)Tab.2 Effect of AECL on the levels of SOD and CAT in liver and heart,the level of SOD in kidney of D-galactose-induced aging mice(±s,U/μg pro,n=10)
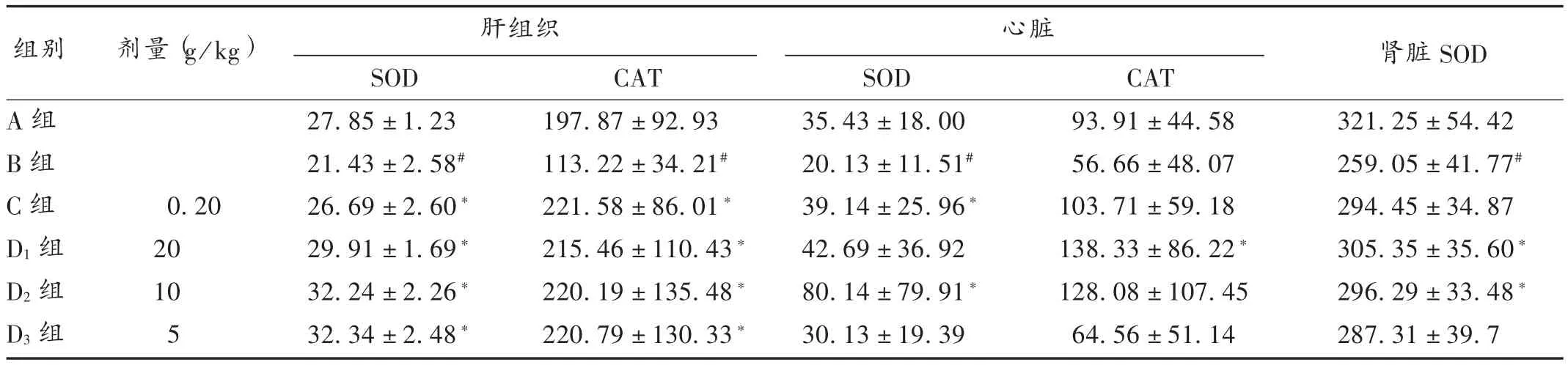
表2 AECL对 D-半乳糖衰老小鼠肝脏、心脏SOD和CAT及肾脏SOD的影响(±s,U/μg pro,n=10)Tab.2 Effect of AECL on the levels of SOD and CAT in liver and heart,the level of SOD in kidney of D-galactose-induced aging mice(±s,U/μg pro,n=10)
组别 剂量(g/kg) 肝组织 心脏 肾脏SOD A组B组C组D1组D2组D3组0.20 20 10 5 SOD 27.85±1.23 21.43±2.58#26.69±2.60*29.91±1.69*32.24±2.26*32.34±2.48*CAT 197.87±92.93 113.22±34.21#221.58±86.01*215.46±110.43*220.19±135.48*220.79±130.33*SOD 35.43±18.00 20.13±11.51#39.14±25.96*42.69±36.92 80.14±79.91*30.13±19.39 CAT 93.91±44.58 56.66±48.07 103.71±59.18 138.33±86.22*128.08±107.45 64.56±51.14 321.25±54.42 259.05±41.77#294.45±34.87 305.35±35.60*296.29±33.48*287.31±39.7
2.2 对肝脏SOD和CAT的影响
与A组比较,B组小鼠肝组织匀浆中SOD和CAT活性均明显降低(P<0.05),表明 D-半乳糖衰老小鼠肝脏抗氧化能力下降;与B组比较,C组、D1组、D2组、D3组小鼠肝组织匀浆中SOD和CAT水平显著升高(P<0.05)。结果见表2。
2.3 对心脏SOD和CAT水平的影响
与A组比较,B组小鼠心脏组织匀浆中SOD水平明显降低(P<0.05),CAT水平有降低趋势,但无显著差异(P>0.05);与B组比较,C组、D2组小鼠心脏组织匀浆中SOD水平均显著升高(P<0.05),D1组CAT水平显著升高(P<0.05),表明AECL能显著提高衰老小鼠心脏的抗氧化能力。详见表2。
2.4 对肾脏SOD的影响
与A组比较,B组小鼠肾脏组织匀浆SOD水平明显降低(P<0.05);与B组比较,D1组、D2组小鼠肾脏组织匀浆中SOD水平均显著升高(P<0.05)。详见表2。
2.5 对脑组织SOD,GSH-Px,NO的影响
与A组比较,B组小鼠脑组织匀浆中SOD,GSH-Px,NO水平均明显降低(P<0.05);与B组比较,C组、D1组小鼠脑组织匀浆中NO水平均显著升高(P<0.05),SOD和GSH-Px水平均呈升高趋势,但无显著差异(P >0.05)。详见表 3。
表3 AECL对 D-半乳糖衰老小鼠脑组织指标影响(±s,n=10)Tab.3 Effect of AECL on brain tissue indexes ofD-galactoseinduced aging mice(±s,n=10)
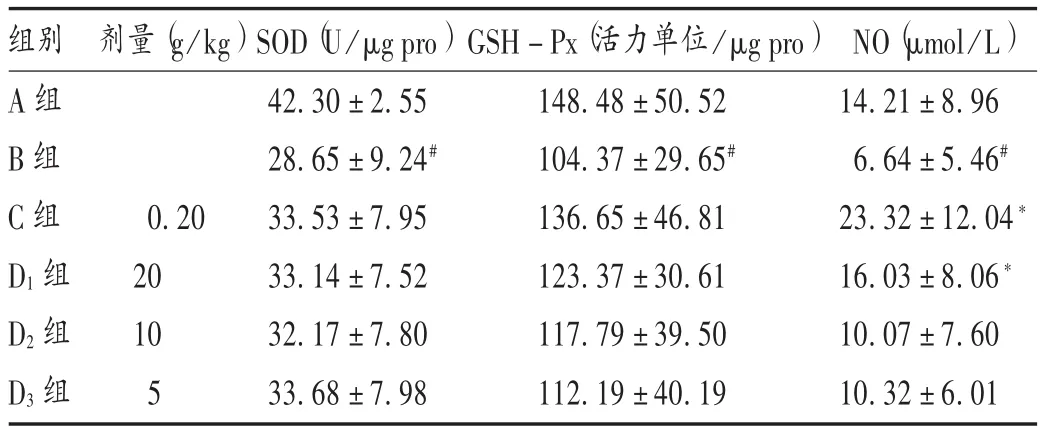
表3 AECL对 D-半乳糖衰老小鼠脑组织指标影响(±s,n=10)Tab.3 Effect of AECL on brain tissue indexes ofD-galactoseinduced aging mice(±s,n=10)
组别A组B组C组D1组D2组D3组剂量(g/kg)0.20 20 10 5 SOD(U/μg pro)42.30±2.55 28.65±9.24#33.53±7.95 33.14±7.52 32.17±7.80 33.68±7.98 GSH-Px(活力单位 /μg pro)148.48±50.52 104.37±29.65#136.65±46.81 123.37±30.61 117.79±39.50 112.19±40.19 NO(μmol/L)14.21±8.96 6.64±5.46#23.32±12.04*16.03±8.06*10.07±7.60 10.32±6.01
3 讨论
研究表明,机体衰老与氧化应激密切相关,生化指标测定一般多集中在氧化应激相关酶的测定[9]。SOD,CAT,GSH-Px可清除超氧阴离子,维持机体氧化还原平衡[10]。
本研究结果显示,与模型组比较,药物干预组动物血清的 T-AOC,SOD,CAT,GSH-Px生化指标均明显改善,表明AECL有抗衰老作用。SOD调节活性氧簇(ROS)和活性氮簇(RNS)的水平,减少对蛋白质和核酸的损害[11]。本研究中,AECL明显提高衰老模型小鼠肝脏、肾脏和心脏匀浆的SOD水平,加快ROS的清除,维持机体的氧化还原平衡。CAT负责将SOD催化生成的过氧化氢转化成氧分子,降低过氧化氢浓度,促进超氧阴离子的清除[12]。本研究中,AECL处理后,衰老模型小鼠心脏和肝脏匀浆的CAT水平明显升高,抗氧化能力增强。NO可通过隔离铁离子的方式发挥抗氧化作用[13],可通过调节SOD活性发挥抗氧化作用[14]。AECL可提高心脏SOD水平,D2组小鼠SOD水平明显高于D1组和D3组。由于中药具有多靶点、多组分的特点,各活性成分间又存在协同作用及拮抗作用。因此,量效曲线可能呈钟形曲线。AECL处理 D-半乳糖衰老小鼠后,小鼠脑组织匀浆中NO水平明显上升,AECL的抗衰老作用可能与提高脑组织NO水平有关;脑组织匀浆中SOD和GSH-Px水平并未显著改善,但影响心脏和肾脏中SOD水平,肝脏、心脏匀浆CAT水平及脑组织匀浆中NO水平的详细作用机制还需进一步研究。
综上所述,AECL具有一定的延缓衰老作用,其作用机制可能与提高肝脏、心脏、肾脏和脑组织的抗氧化能力有关,但详细作用机制需要作进一步探讨。

