基于NVIVO 12.0及政策文本的国家药品抽检发展历程分析
王瑞丽,朱嘉亮,黄志禄△
(1.沈阳药科大学工商管理学院,辽宁 沈阳 110016;2.中国食品药品检定研究院,北京 102629)
药品抽查检验(以下简称药品抽检)是指国务院、省级、市县级药品监督管理部门依法对生产、经营、使用药品开展的质量抽查检验工作,是监管上市后药品的技术手段之一,为打击假劣药品、加强药品监督管理、了解上市后药品的质量状况、保护公众用药安全有效提供技术支撑。1984年发布的《药品管理法》规定,药品监督员有权按照规定对辖区内药品企业的药品质量进行监督、检查、抽验,必要时可按照规定抽取样品。第一次明确了药品抽检工作的合法性。2019年新修订的《药品管理法》规定药品抽检实行有偿抽取样品,2020年国家药品抽检实施方案中实施了非现场结算购买样品、抽检结果以电子报告书方式传递等新措施,标志着我国药品抽检新模式的开始。《药品管理法》作为我国药品监管体系中的特别立法,奠定了抽检工作的法律地位。本研究中运用NVIVO12.0软件,对1984年至2019年公开发布的32份政策文本进行裂解编码,形成以政策发文单位、政策目标、抽检工作重点为一级节点的分析框架,将子节点与“发文时间”进行矩阵编码,分析不同政策发文单位、政策目标、抽检工作重点等方面的特点,并结合现行抽检模式提出对策和建议。现报道如下。
1 文献综述和理论基础
1.1 文献综述
我国学者对药品抽检的研究可分为抽检数据平台建设类、抽检数据挖掘类、抽检现状及模式探索类和国外先进经验借鉴类。包括建议我国从规划设计、数据清洗和挖掘等方面建立国家药品抽检数据共享平台[1-4];运用灰色理论、关联规则、因子分析等方法挖掘抽检数据,探索数据与药品质量间的关联[5-9];通过分析我国药品基本药物抽检现状,总结我国药品抽检发展模式[10-16];借鉴风险沟通理念等国外先进经验[17-19]。梳理药品抽检政策发展历程,可为今后抽检模式提出思路和方法,更好地规划和把握未来政策的发展趋势。
1.2 理论基础
2019年颁布的《药品质量抽查检验管理办法》规定:药品抽检根据监管目的可分为监督抽检和评价抽检。监督抽检是指药品监督管理部门根据监管需要对质量可疑药品进行的抽查检验。评价抽检是指药品监督管理部门为评价某类或一定区域药品质量状况而开展的抽查检验。
根据组织实施主体,可分为国家药品抽检和地方药品抽检。国家药品抽检以评价抽检为主,是指由国务院药品监督管理部门在全国范围内对生产、经营、使用环节的药品质量开展的抽查检验,组织方式为“分散抽样、集中检验、探索研究、综合评价”,即在全国分散抽样,同一品种样品交由一个药检机构开展法定检验,并开展探索性研究,完成质量分析报告。地方药品抽检以有针对性的监督抽验为主,是指由地方药品监督管理部门对本行政区域内生产环节及批发、零售连锁总部和互联网销售第三方平台的药品质量开展的抽查检验,以发现假劣药品为主要目标。
2 方法与结果
2.1 资料来源
遵循“公开性、权威性、完整性”等原则,在百度检索以“药品抽查检验”“药品抽验”“药品抽检”等为词条公开发表文献里提到的政策文件,共选取1984年至2019年来自中国政府网、国家药品监督管理部门、各地药品监督管理部门等官方网站的政策文本62份,剔除不相关与不完整政策文件,得到32份政策文件。为保证样本内容分析的科学性与合理性,由相关领域的专家进行论证与确认。
2.2 研究工具
运用NVIVO 12.0质性分析软件进行政策文本的分析,遵循开放编码、轴心式编码和选择式编码三级编码步骤。首先,利用NVIVO 12.0软件导入相关文本资料,对其仔细阅读并进行标注和初步编码,形成自由节点;其次,通过对各自由节点的进一步组织,建立类属关系,编码成结构性的树状节点,表达质性研究概念间的相互关系;最后,反复进行亲子节点关系的疏理,编码完成后建立关系模型,运用可视化手段呈现文本的变化情况。因此,通过对32份政策文本进行逐级裂解成分析单元,对相似的单元汇总后构建出药品抽检政策发展历程分析框架,最终形成3个一级节点、20个二级节点、29个三级节点的分析框架。详见图1。
2.3 结果
2.3.1 政策发文单位变化
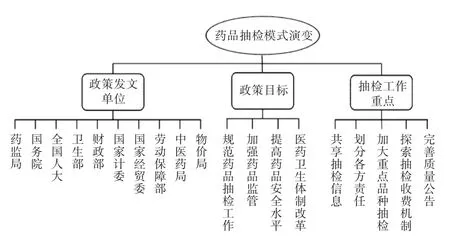
图1 药品抽检模式发展历程框架Fig.1 Developmentprocess framework ofdrug sampling and testing mode
将政策文本导入到NVIVO软件,在节点创建“发文单位”节点,阅读文本后在“发文单位”下创建子节点“全国人大”“国务院”“国家药品监督管理局”等,分别将政策文本拖拽至相应节点下。将“发文单位”“发文时间”进行矩阵分析(见图2)。可见,1984年至2000年,药品抽检政策发文单位较分散,国务院、卫生部、财政部、药监局(因国务院机构改革,国家医药管理局、国家药品监督管理局、国家食品药品监督管理局、国家食品监督管理总局简称为药监局)是主要的发文单位,国家计委(因国务院机构改革,国家计划委员会、国家发展计划委员会简称为国家计委)、国家经贸委(因国务院机构改革,国家经济贸易委员会简称为国家经贸委)等都参与政策发布,这与当时药品监管职能的划分有关;1998年以前,药品监管工作主要由卫生部药政管理局和国家经贸委的国家医药管理局负责;1998年,卫生部药政管理局与国家医药管理局等部门合并成立国家药品监督管理局;2001年后,药品抽检政策则主要由全国人大、国务院、药监局发布,其中,国务院发布的主要有医药卫生体制改革与国家药品安全规划系列政策,国家药监局则具体规范药品抽检工作,如《抽样原则与程序》《国家药品计划抽验质量分析指导原则》《药品质量抽查检验管理办法》等,全国人大主要颁布《药品管理法》,形成了全国人大制定法律,国务院总体规划,国家药监局具体规定的模式。
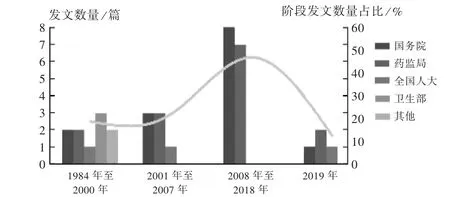
图2 1984年至2019年不同单位发文数量Fig.2 Documents issued by different agencies from 1984 to 2019
2.3.2 政策目标变化
将政策中工作目标的内容进行裂解编码,形成4个二级节点、10个三级节点的分析框架,详见图3。对二级节点与“发文时间”进行矩阵分析(见图4),可见不同时期,药品抽检相关政策的目标也有所不同。1984年至2000年,政策目标主要是推进城镇医药卫生体制改革的顺利进行,为了解决群众“看病难、住院难、就医需求远大于医疗服务供给”的问题[20];2001年至2007年,主要是规范药品质量监督抽查工作,加强对药品的监督管理;2008年至2018年,主要推进医药卫生体制改革、规范国家药品计划抽检管理工作、加强基本药物管理等;2019年至今,主要是规范药品质量抽检工作和上市后药品的监督管理。
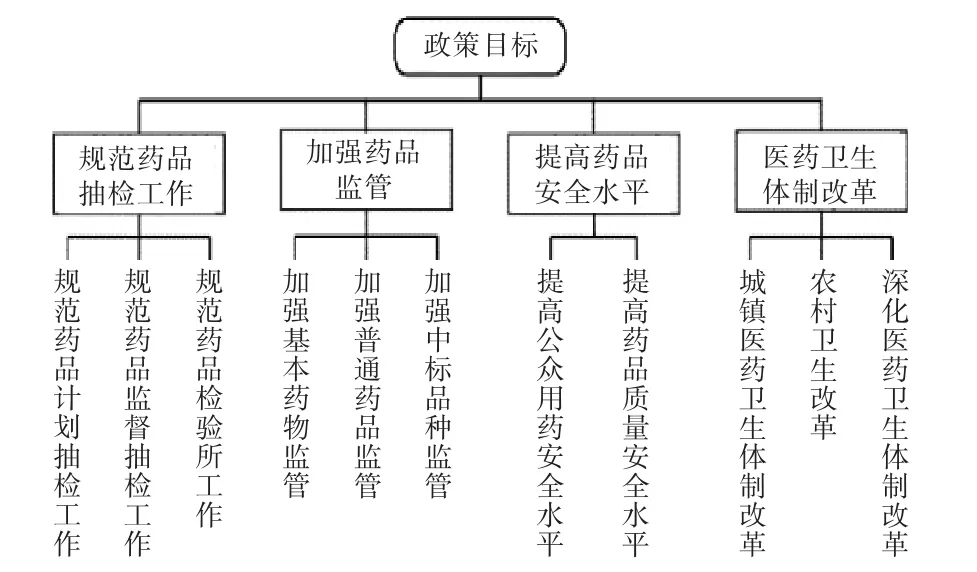
图3 政策文件目标编码结构Fig.3 Target coding structure of policy documents
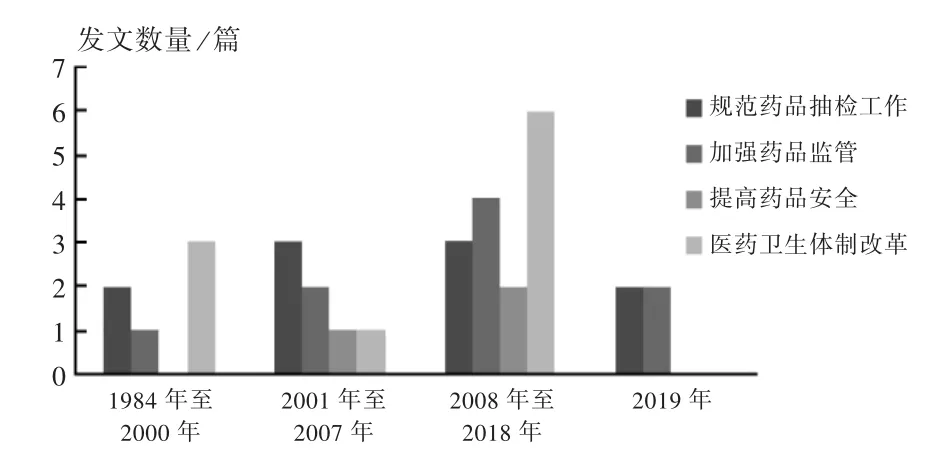
图4 1984年至2019年药品抽检政策目标变化Fig.4 Policy objectives of drug sampling and testing from 1984 to 2019
2.3.3 抽检工作重点变化结果
将政策中涉及到的药品抽检工作内容进行裂解编码,形成6个二级节点、19个三级节点的分析框架(见图5),将二级节点与“发文时间”进行矩阵分析(见图6)。可见,药品抽检工作的发展历程可分为以下4个阶段。
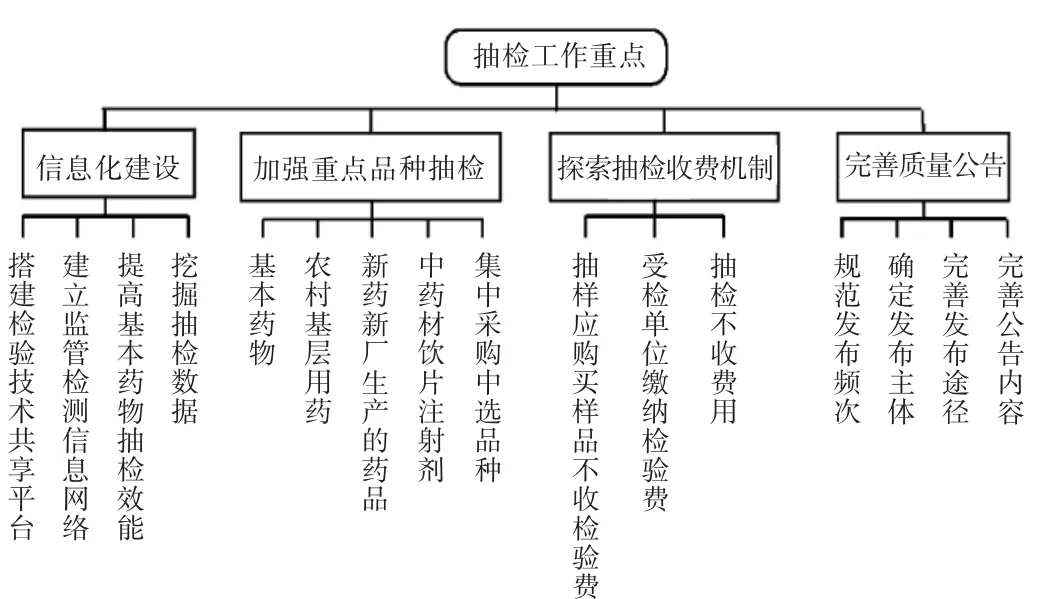
图5 药品抽检工作重点编码结构Fig.5 Key coding structure of drug sampling and testing
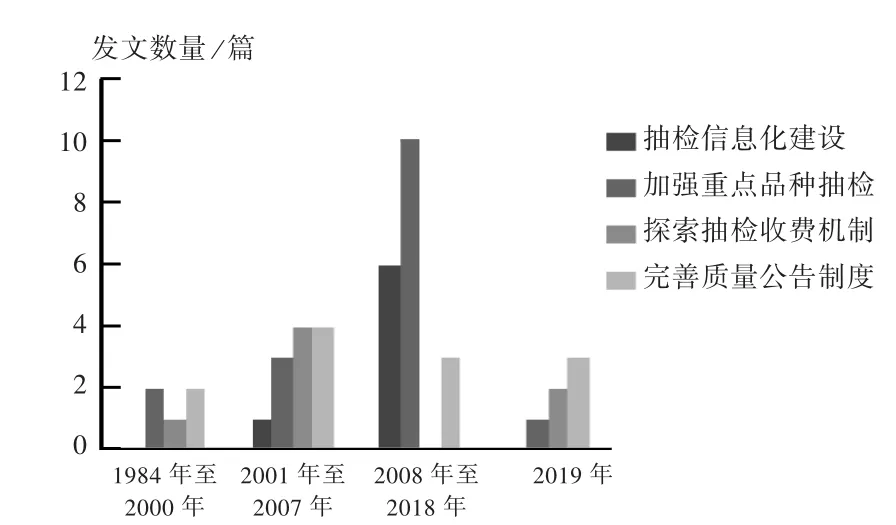
图6 1984年至2019年药品抽检工作重点变化Fig.6 Key changes ofdrug sampling and testing from 1984 to2019
1)探索阶段(1984年至2000年)
确立药品抽检收费制度:1990年以前,药品抽检不收检验费,因此药品检验机构面临着抽检药品越多、经费越困难的困境。为扩大药品抽检的覆盖面,1990年卫生部《关于加强药品质量监督检验有关问题的通知》规定,药品抽检需由受检单位缴纳检验费。
加强重点品种抽检:1990年,卫生部《关于加强药品质量监督检验有关问题的通知》规定,在进行药品质量抽验时要加强对贵细中药材、新药、新产品和优质品的考核,新建、扩建、改建厂房(车间)生产的药品,质量不稳定药品,医疗单位制剂室配制的大输液、中药注射液、注射用水,药品经营单位库存5年无效期药品要进行经常性监督检验;2000年,药监局《关于贯彻城镇医药卫生体制改革指导意见的实施意见》规定,药品抽验工作要重点抽验农村用药、医疗单位、流通混乱区域的药品及中药材和中药饮片。
完善药品质量公告制度:1986年,卫生部开始实行药品质量公报制度。1988年,药品生物制品检定所制定改革方案中明确国家药品质量公报每年发布4期,内容为国家级抽验结果和从省、自治区、直辖市公报中选取的部分品种抽验结果;省级药品质量公报每年发布2~4期[21]。2000年,药监局《关于贯彻城镇医药卫生体制改革指导意见的实施意见》对公报的内容加以规范,提高了公报的规范性和准确性。
2)发展阶段(2001年至2007年)
取消药品检验收费机制:由于收取检验费使得药品企业产生规避抽检的行为,药品抽检工作难以开展。2001年修订的《药品管理法》规定,抽查检验应当按规定抽样,并不得收取任何费用。
加强重点品种抽检:2001年至2006年,药监局发布了3版《药品质量抽查管理规定》,强调加强重点品种抽检,尤其是对农村地区基层药品经营和使用单位或个人的监督检查工作。
完善药品质量公告制度:2001年修订的《药品管理法》中规定,药品监督管理部门应当定期公告药品质量抽检结果,明确了药品质量公告发布的法定性;2002年,《药品管理法实施条例》对公告内容进行统一规定。
加快药品抽检信息化建设:2007年,国务院发布的《国家食品药品安全“十一五”规划的通知》规定,实施“3511”工程,建立和完善覆盖国家、省、市(地)三级药品监管信息系统,建立药品和医疗器械检验检测系统。
3)创新阶段(2008年至2018年)
加强重点品种抽检:自2009年实行国家基本药物制度起,药监局发布《关于加强基本药物质量监督管理规定的通知》等政策,规定通过在国家药品抽检计划中加大基本药物的比例和省级药监局加强对辖区内生产企业生产的基本药物抽检等方式,实现对基本药物的全覆盖抽检。
完善药品质量公告制度:2016年,中国食品药品检定研究院首次发布的《国家药品抽检年报》,详细介绍了国家药品抽检的总体情况,创新了药品抽检结果公布的方式;2017年,药监局《关于规范药品抽检核查处置和信息发布工作的通知》规范了抽检结果公开模式[22]。
确立探索性研究机制:2008年,国家药品抽检组织方式由“各自抽样,分散检验”调整为“分散抽样,集中检验、探索研究、综合评价”[23];2009年,药监局发布的《药品评价抽验质量分析指导原则》明确了探索性研究的定义,从制度上确立了探索性研究机制[24]。
推进药品抽检信息平台建设:2008年上线的国家药品抽验管理信息系统实现了对药品全生命周期(抽样、检验、核查、质量分析等)的信息化管理;2015年建成国家药品抽检数据平台,其可向检验人员和管理人员共享历年的药品抽检数据和药品质量分析信息。
4)抽检新纪元阶段(2019年及以后)
确立药品有偿购样机制:2019年新修订的《药品管理法》明确实行药品有偿购样机制,规定抽检应当按照规定抽样,不得收取任何费用,抽样应当购买样品。
加强重点品种抽检:2020年起加强对国家集中采购中标药品的抽检,药监局《关于加强药品集中采购和使用试点期间药品监管工作的通知》规定:各省级药品监管部门要对行政区域内通过仿制药一致性评价品种及中标药品生产环节开展全品种覆盖抽检。
完善药品质量公告制度:2019年新修订的《药品管理法》同时规定,国家实行药品安全信息统一公布制度,国家药品安全总体情况、药品安全风险警示信息等由国务院药品监督管理部门统一公布。
3 讨论
由图2可见,我国对药品抽检的监管形成了全国人大制定法律、国务院总体规划、国家药监局具体规定的模式。由图4可见,药品抽检不仅是查处市场上假劣药品的技术支撑,还应发挥风险防控作用,挖掘潜在的药品质量风险,提高药品质量安全水平,保障公众的健康水平。由图6可见,抽检收费机制由药品抽取检验费到不收检验费再到有偿抽样,抽检重点由农村基层重点抽样到基本药物全覆盖抽检再到集中采购中标品种全覆盖抽检,药品质量公告的内容不断规范,发布渠道和模式不断多样化,监管信息化水平不断提升。
建议我国还应建立以下长效机制,以提升药品监管的科学性和有效性。
加强药品检查、检验、查处的联动机制:以问题为导向,将既往抽检不符合规定的、质量体系存在问题的、探索性分析发现存在风险隐患的企业和流通链条作为药品检查重点,将日常监督检查发现问题的品种作为抽检重点,将药品抽检过程中出现的质量问题、探索性研究的结论作为查处依据,联动行政监督与技术监督,提高药品监管的权威性。
完善药品质量公告制度:药品抽检结果发布途径和模式越来越多样化,但大量抽检数据存在信息孤岛的现象,未能被充分使用和挖掘。建议统一药品抽检结果发布渠道,在同一个平台上对不同渠道的抽检信息进行汇总;整合国家和地方药品质量公告,统一公告内容格式,便于学者对数据进行统计与分析;完善药品质量公告的内容,可借鉴风险管理的理念[24]在公告中补充药品质量风险点,提示药品质量是否存在地域性、季节性等风险点,更好地发挥药品质量公告的预警效能。
科学、有效地执行药品购样政策:在选择抽样单位时由于时间和地理位置的限制,抽样人员可能为追求方便而选择同一批发企业的多个品种或距离近的企业进行抽样,减少在质量风险高的农村基层地区的企业抽取药品,导致达不到抽检规定的覆盖面;在样品抽取过程中,由于抽样人员抽错样品或样品丢失时,抽样单位需要支付样品费用,导致抽样人员对某些不确定的情况采取不抽取以躲避惩罚,达不到抽检计划数量。建议加大对抽样人员的培训及业务考核,严格按规定和计划进行抽样,确保抽取的样品覆盖面具有统计学意义。
合理规划抽检覆盖面:我国现阶段要求对仿制药一致性品种和中选品种全覆盖抽检,但全覆盖抽检会导致部分药品抽检占比过大,间接缩小了抽检的覆盖面,使得抽检效能降低,建议以问题为导向,合理规划药品抽检品种,遵循“双随机,一公开”的监管模式,在重点监管品种中随机抽取检查对象,随机选派执法检查人员,可能会比每年1次的全覆盖抽检更有威慑力[10]。

