神经生长因子对兔牙髓干细胞体外增殖、成骨分化影响的实验研究
路晓淼,姜 晟,李孝亮,田瑞雪,刘姗姗,赵莉莉,张 凯
牙髓干细胞(dental pulp stem cells,DPSCs)是外胚层来源的干细胞,具有较高的细胞活性及多向分化潜能,因其取材丰富、易于培养等优点一直受到研究者的青睐。DPSCs可参与牙髓的修复与重建[1-2],具有高增殖、自我更新的能力,在适当的诱导下可以分化为脂肪组织、软骨组织和神经组织等,因其高增殖率、高克隆潜力、高矿化潜力和较低的免疫原性,目前被认为是口腔医学中骨组织工程的种子细胞[3-5]。
神经生长因子(nerve growth factor,NGF)是目前医学上应用较为广泛的外源性调节因子,具有营养神经和修复神经损伤等方面的作用[6-7],在伤害性感受器的功能调节中起关键作用。外源性NGF还可通过注射的方式补充内源性NGF的含量,避免其凋亡,保护受损的神经元[8]。本研究在前期的实验研究中发现NGF可以在体外将骨髓间充质干细胞定向分化为软骨并促进其向成骨方向分化,但 NGF对DPSCs 的影响机制尚不明确,且NGF联合DPSCs用于种植体周围是否能够促进种植体早期骨结合也尚未可知。因此,本研究旨在探讨NGF对兔DPSCs的增殖活性及成骨分化的影响,分析NGF和DPSCs的联合应用对牙髓损伤的修复,以期为探索NGF和 DPSCs促进骨生成提供一定的依据和思路。
1 资料与方法
1.1 实验动物、主要试剂与仪器 选取健康的新西兰兔3只,3~4周龄,体质量1.5~2.0 kg,雌雄不限(由东方集团提供)。饲养环境:温度(25±2)℃、湿度(60±5)%,动物生产许可证号SCXK(苏)2015-0005。新西兰兔于蚌埠医学院科研中心适应性喂养1周后用于实验。主要试剂:胎牛血清(FBS)(美国GIBCO公司)、DMEM培养液(美国Hyclone公司)、0.25% EDTA胰蛋白酶消化液(北京Solarbio公司)、青霉素-链霉素混合液(美国Hyclone公司)、Ⅰ型胶原酶(北京Solarbio公司)。仪器:细胞培养箱(德国Eppendorf公司)、离心机(上海卢湘仪)、倒置显微镜(上海蔡康光学)、超净台(苏州德汇)、移液枪(北京康林)。
1.2 兔DPSCs的培养 在局麻环境下拔除兔前牙及前磨牙,放入三倍双抗液中浸泡30 min,在超净台中用0.1 mmol/L的PBS溶液冲洗3次,用无菌拔髓针拔出牙髓组织,剪去距根尖1mm左右组织,余下牙髓组织剪成1 mm×1 mm×1 mm大小块状,置于15 mL离心管中。在离心管中加入3 g/L Collagenase-1和4 g/L分解酶各1 mL,混匀后置入37 ℃水浴中消化50 min,观察细胞的消化情况。通过细胞筛网(孔径200目)筛拣出未通过的组织块,用0.1 mmol/L的PBS溶液冲洗3次,加入培养液后,置入CO2培养箱中,待细胞贴壁后,3 d换液一次。
1.3 细胞传代 显微镜下观察细胞形态的变化,瓶底的细胞铺满80%左右时,去除原培养液,用PBS溶液冲洗3次。加适量的胰蛋白酶,置于37 ℃的细胞培养箱中孵育3 min。后离心加入培养基,放入培养箱中培养,每隔3 d换一次液,在倒置显微镜下观察细胞的生长,2~5代的细胞用于后续实验。
1.4 DPSCs成骨分化能力的比较
1.4.1 实验分组 将生长良好的第3代DPSCs设置为3组:空白组为纯DPSCs组,含10%FBS,1%双抗的DMEM高糖培养液;实验组为DPSCs加NGF组,10%FBS,1%双抗的DMEM高糖培养液加入100 μg/L的NGF;对照组为DPSCs加矿化液组,10%FBS,1%双抗的DMEM高糖培养液加入10 mmol/L β-甘油磷酸钠、100 nmol/L地塞米松、50 mg/L抗坏血酸。分别在7、14 d后收集细胞进行后续实验。
1.4.2 细胞碱性磷酸酶(ALP)活性检测 第3代DPSCs以5×104个/孔细胞接种于24孔板中,随机分为3组,在培养7、14 d时各组取一个24孔板,用0.1 mmol/L PBS冲洗3次,490 nm 处酶标仪测吸光度值计算裂解液中ALP水平。
1.4.3 RT-qPCR检测COL-1、Runx-2和OCN基因表达 取第三代细胞1×106个/孔接种于6孔板中分组培养,分别于培养7、14 d时提取细胞RNA,第一链cDNA模板通过逆转录试剂盒合成,以β-actin为内参对照,设置无模板阴性对照。PCR反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,40循环(引物序列见表1)。

表1PCR引物序列
1.5 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 DPSCs组织形态学观察 酶解组织法顺利培养出兔DPSCs,2 d即可见周围组织块有细胞游出(见图1),细胞呈集落生长,胞质均匀,形状呈圆形。5~6 d后可汇合达80%,此时可进行再次传代。实验7、14 d时3组细胞形态见图2。实验7 d时,与空白组和对照组比较,实验组细胞呈聚集性生长,梭形细胞逐渐向多角形分化;14 d时,实验组细胞间隙增多,多角形改变更加明显。
2.2 细胞ALP活性结果 实验14 d时的空白组、实验组和对照组的ALP活性值均高于7 d时的活性值(P<0.01);实验7 d和14 d时3组间ALP活性值差异均有统计学意义(P<0.01),实验组高于空白组(P<0.05),对照组高于实验组(P<0.05)(见表2)。


2.3 3组兔DPSCs RT-qPCR结果 各组培养在7 d时实验组中COL-1和OCN基因的表达值均高于空白组(P<0.05);培养14 d时实验组中COL-1、Runx-2和OCN基因的表达值均高于空白组(P<0.05)(见表3~5)。
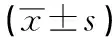
表2 空白组、实验组和对照组7、14 d的ALP活性比较
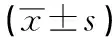
表3 兔DPSCs中COL-1基因表达情况
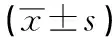
表4 兔DPSCs中Runx-2基因表达情况
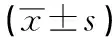
表5 兔DPSCs中OCN基因表达情况
3 讨论
DPSCs具有成骨分化能力,而且其是存在于牙髓组织中的一类成体干细胞,具有高度自我更新能力和多向分化潜能,在口腔颅颌面部的缺损修复中具有一定的同源优越性。自 GRONTHOS等[11]成功从成人牙髓源性细胞中分离出间充质干细胞以来,DPSCs就开始在再生医学的应用中发挥着重要的作用。
NGF是多种组织再生中的理想细胞因子,由于其潜在的成骨诱导作用,也让其成为近期的研究热点[12-13]。NGF是在1952年发现的第一个神经营养因子。早期研究证实了NGF是重要的神经营养蛋白,可以促进神经的再生、营养和发育[14]。相关研究[15-16]显示NGF有很好的促进骨修复的作用,可以促进兔胫骨骨折部位的愈合,也能促进人体四肢骨的骨折愈合,使其愈合时间缩短。近期研究[17]显示,NGF可在小鼠肋骨的骨折部位检测到,2 d达到高峰值,说明NGF与骨的形成有关。
NGF可加速干细胞向成骨方向分化,因此,本研究拟在前期基础上,通过ALP检测、RT-qPCR等技术明确DPSCs体外在NGF作用下的成骨影响,研究结果,发现实验组ALP水平明显高于空白组,RT-qPCR结果显示14 d时实验组中COL-1、Runx-2和OCN基因的表达量均高于空白组,具有一定加速成骨向分化的作用。
综上所述,本研究证实NGF体外能够促进兔DPSCs向成骨向分化,缩短临床种植骨结合修复的时间,为其运用到颌面部及种植体周围骨缺损的修复提供新的视角和思路。

