白及颗粒对慢性阻塞性肺疾病模型大鼠肺组织α-1 antitrypsin、Neutrophil Elastase及MPO表达的影响*
程芳,武尚亮,赵丽华
(1.天津海滨人民医院药剂科,天津 300280;2.天津红日康仁堂药业有限公司,天津 301700;3.北京大学肿瘤医院暨北京市肿瘤防治研究所中心实验室,北京 100142)
慢性阻塞性肺病(COPD)是慢性气道阻塞性疾病的统称,是以呼吸气流受限为特征的肺部疾病。呼吸气流受限不完全可逆,呈进行性发展,与肺部对香烟的烟雾等有害气体或其他有害颗粒的异常炎症反应有关[1]。COPD与慢性支气管炎及肺气肿密切相关,呼吸道反复病毒感染和继发性细菌感染是导致慢性支气管炎病变发展的重要因素,长期接触工业粉尘、大气污染及过敏因素也是引起慢性支气管炎的重要原因,而机体抵抗力下降,呼吸系统防御受损则是发病的内在因素[2]。已有研究证明白及或白及颗粒对PM2.5、石英粉(矽肺)、盐酸等引起的肺损伤具有很好的疗效[3]。白及归肺、肝、胃经,功效为收敛止血,消肿生肌,说明书指明白及颗粒可用于慢性气管炎,肺气肿等肺部相关疾病[4]。在临床上,慢性支气管炎和肺气肿是导致COPD的最常见疾病,慢性支气管炎或肺气肿的早期,大多数患者有慢性咳嗽、咳痰症状,肺气肿常与慢性支气管炎并存,一般病程较长,当患者病情严重到一定程度,肺功能检査出现持续气流受限时,则诊断为慢阻肺[5]。本实验研究了白及颗粒对COPD模型的影响,为白及颗粒的临床应用提供了药效学实验研究基础。
1 材料与方法
1.1 仪器 BX53型奥林巴斯显微镜。DHP-9082型电热恒温培养箱,上海合恒仪器设备有限公司。KD-PⅢ型摊片机,北京世纪科信科学仪器有限公司。KD-H型烤片机,北京世纪科信科学仪器有限公司。徕卡石蜡切片机,德国(徕卡)生产。酶标分析仪,北京普朗新技术有限公司。Alpha1502型紫外可见分光光度计,上海谱元仪器有限公司。DYCZ-24KS型双板垂直电泳仪,北京六一仪器厂。KB-900型智能脱色摇床,海门市其林贝尔仪器制造有限公司。
1.2 动物 SPF级健康SD大鼠60只,体质量180~220 g,雄性,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。
1.3 药品和试剂 白及颗粒:云南永安制药有限公司,规格:10 g/袋(相当于 10g生药),批号 20171206,服用方法:开水冲服。每次10 g,每日2次。水合氯醛:北京市旭东化工厂,批号20160730。脂多糖(LPS),Sigma公司。多聚甲醛,批号:F20170503,国药集团化学试剂有限公司。无水乙醇,国药集团化学试剂有限公司,批号20170121。二甲苯,国药集团化学试剂有限公司,批号:20161125。枸橼酸,批号:20170621,国药集团化学试剂有限公司。TMS-P超敏试剂盒,批号:1703031405,福建迈新生物技术开发有限公司。枸橼酸钠,批号:20170713,国药集团化学试剂有限公司。磷酸盐缓冲液(PBS),批号:20170815,北京Solarbio科技有限公司。α-1抗胰蛋白酶抗体(α-1 antitrypsin),北京博奥森生物技术有限公司。中性粒细胞弹性蛋白酶抗体(Neutrophil Elastase),北京博奥森生物技术有限公司。髓过氧化物酶抗体(MPO),北京博奥森生物技术有限公司。
1.4 模型制备 取60只SPF级健康雄性SD大鼠(180~220)g,除预留空白对照组大鼠 10只外,其余50只均用于制备COPD大鼠模型。于实验第1、15天(每隔2周1次)以3.5%水合氯醛腹腔麻醉大鼠后,造模大鼠采用一次性气管插管法经气管注入0.2 mL LPS溶液(用生理盐水配制为1 mg/mL溶液)。第15天除外第2~28天每天给予烟熏,放入自制的有机玻璃密闭熏烟箱内,每次10只,用8支香烟,烟熏每天2次,每次30 min。将麻醉大鼠仰卧位固定在鼠板上,头高尾低呈45°角放置,暴露声门,在光源下将套管针迅速插入大鼠气管内,拔出套管针钢芯,以棉丝放在塑料套管外口插管成功后,先抽取空气0.3 mL后抽取LPS溶液0.2 mL,通过套管针快速注入气管。然后将大鼠固定板直立旋转,左右摇晃30次,使LPS液能够均匀分布于两肺[6]。
1.5 分组给药 除10只空白对照组大鼠,另取50只造模大鼠,随机分为模型对照组、羧甲司坦片组(0.14 g/kg)、白及颗粒高剂量组(生药5.4 g/kg)、白及颗粒中剂量组(生药3.6 g/kg)、白及颗粒低剂量组(生药1.8 g/kg)。灌胃给药,每日1次,连续4周,末次给药1 h后使用动物呼吸功能测定仪测定大鼠第0.3秒呼气容积与肺活量比值(FEV 0.3/FVC%)。
1.6 样品提取与保存 实验结束,取左肺4%多聚甲醛溶液固定,右肺各叶-80℃保存。
1.7 肺组织形态学检测[7]常规脱水、透明、浸蜡、包埋及切片。苏木精-伊红(HE)染色:观察肺组织炎性细胞浸润,进行炎症病理学评分。HE染色肺脏病理分级:0级,无炎症;1级,轻度炎症,炎性细胞浸润,病变范围小于10%;2级,中度炎症,肺泡间隔增厚,病变范围占10%~30%;3级,重度炎症,炎性细胞浸润,肺泡间隔增厚,病变范围大于30%。
1.8 免疫组化法测定肺组织α-1 antitrypsin、中性粒细胞弹性蛋白酶(NE)及MPO表达 石蜡切片脱蜡至水。3% H2O2室温孵育10 min,10%山羊血清封闭 10 min,滴加 Ι抗(α-Antitrypsin 1∶400;NE 1∶450;MPO 1∶400[8]),37℃孵育2 h,滴加适量生物素标记Ⅱ抗,37℃孵育30 min。滴加适量的辣根酶标记的链霉卵白素工作液,37℃孵育30 min。DAB显色剂显色,冲洗,复染,脱水,透明,封片。免疫组化图片采用Image J软件进行灰度值分析,计算各组平均光密度值(IOD)。IOD=log[gv0/gv)],gv0 为背景灰度值,gv为目标区灰度值。
1.9 Western Blot法测定肺组织Neutrophil Elastase、MPO表达 取适量肺组织,提蛋白,取上清液,BCA法蛋白定量。将蛋白样品直接上样到SDSPAGE胶加样孔内,开始时电压80 V,后增加到180 V,电泳到染料抵达分离胶底部。将蛋白后转印至PVDF膜上。封闭1 h,加Ι抗(中性粒细胞弹性蛋白酶抗体封闭液稀释浓度1∶650;髓过氧化物酶抗体封闭液稀释浓度1∶800)4℃孵化过夜。TBST清洗3次,加入辣根过氧化物酶标记的Ⅱ抗(封闭液稀释浓度 1∶4 000),室温孵育 2 h,ECL 法显色曝光,使用Image J软件分析图像。结果以相对光密度值表示,相对光密度值=目的蛋白光密度值/β-action光密度值。
1.10 统计学方法 所有数据采用SPSS 24.0软件进行统计处理,以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异具有统计学意义。
2 结果
2.1 白及颗粒对大鼠COPD模型肺功能的影响 与空白对照组相比,模型对照组FEV 0.3/FVC%显著降低(P<0.01),与模型对照组相比,白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组FEV 0.3/FVC%显著升高(P<0.05或P<0.01)。见表 1。
表1 各组FEV 0.3/FVC%的比较(±s)Tab.1 Comparison of FEV 0.3/FVC% in each group(±s)

表1 各组FEV 0.3/FVC%的比较(±s)Tab.1 Comparison of FEV 0.3/FVC% in each group(±s)
注:与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.05,##P<0.01。
组别 动物数 剂量(g/kg) FEV0.3/FVC%(%)空白对照组 10 — 88.69±0.93模型对照组 10 — 78.57±1.93*羧甲司坦片组 10 0.14 84.37±1.42##白及颗粒低剂量组 10 1.8 81.38±1.53#白及颗粒中剂量组 10 3.6 82.75±1.36#白及颗粒高剂量组 10 5.4 83.63±1.77#
2.2 白及颗粒对大鼠慢阻肺模型肺脏HE染色病理分级的影响 与空白对照组相比,模型对照组HE染色病理分级显著增加(P<0.01),与模型对照组相比,白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组HE染色病理分级显著降低(P<0.05或P<0.01)。见表 2,图 1。
表2 各组肺脏HE染色病理分级的比较(±s)Tab.2 Comparison of pathological grades of lung in each group(±s)

表2 各组肺脏HE染色病理分级的比较(±s)Tab.2 Comparison of pathological grades of lung in each group(±s)
注:与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.05,##P<0.01。
组别 动物数 剂量(g/kg) 病理分级(级)空白对照组 10 — 0模型对照组 10 — 2.5±0.3*羧甲司坦片组 10 0.14 1.5±0.4##白及颗粒低剂量组 10 1.8 2.3±0.3白及颗粒中剂量组 10 3.6 1.7±0.3#白及颗粒高剂量组 10 5.4 1.4±0.4##

图1 大鼠肺组织HE结果(×200)Fig.1 HE results of rat lung tissue(×200)
2.3 白及颗粒对大鼠慢阻肺模型肺脏α-1 antitrypsin表达的影响 与空白对照组相比,模型对照组肺脏细胞α-1 antitrypsin表达显著增加(P<0.05),与模型对照组相比,白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组肺脏细胞α-1antitrypsin表达显著增加(P<0.05或P<0.01)。见表 3,图 2。
2.4 白及颗粒对大鼠慢阻肺模型肺脏NE表达的影响 与空白对照组相比,模型对照组肺脏细胞NE表达显著增加(P<0.01),与模型对照组相比,白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组肺脏细胞NE表达显著降低(P<0.05或P<0.01)。见表 4,图 3。
2.5 白及颗粒对大鼠慢阻肺模型肺脏MPO表达的影响 与空白对照组相比,模型对照组肺脏细胞MPO表达显著增加(P<0.01),与模型对照组相比,白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组肺脏细胞MPO表达显著降低(P<0.05或P<0.01)。见表5,图4。
表3 各组免疫组化染色肺脏细胞α-1 antitrypsin表达的比较(±s)Tab.3 Comparison of α-1 antitrypsin expression in lung cells of each group(±s)

表3 各组免疫组化染色肺脏细胞α-1 antitrypsin表达的比较(±s)Tab.3 Comparison of α-1 antitrypsin expression in lung cells of each group(±s)
注:与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.05,##P<0.01。
组别 动物数 剂量(g/kg) IOD空白对照组 10 — 0.035±0.008模型对照组 10 — 0.107±0.011*羧甲司坦片组 10 0.14 0.241±0.032##白及颗粒低剂量组 10 1.8 0.134±0.024#白及颗粒中剂量组 10 3.6 0.183±0.022##白及颗粒高剂量组 10 5.4 0.223±0.038##

图2 大鼠肺组织α-1 antitrypsin表达的结果(×200)Fig.2 Results of α-1 antitrypsin expression in rat lung(×200)
表4 各组免疫组化染色肺脏细胞NE表达的比较(±s)Tab.4 Comparison of NE expression in lung cells of each group(±s)

表4 各组免疫组化染色肺脏细胞NE表达的比较(±s)Tab.4 Comparison of NE expression in lung cells of each group(±s)
注:与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.05,##P<0.01。
组别 动物数 剂量(g/kg) IOD空白对照组 10 — 0.074±0.015模型对照组 10 — 0.387±0.081*羧甲司坦片组 10 0.14 0.153±0.038##白及颗粒低剂量组 10 1.8 0.335±0.066白及颗粒中剂量组 10 3.6 0.272±0.063#白及颗粒高剂量组 10 5.4 0.218±0.072##

图3 大鼠肺组织NE表达的结果(×200)Fig.3 Results of NE expression in rat lung tissue(×200)
表5 各组免疫组化染色肺脏细胞MPO表达的比较(±s)Tab.5 Comparison of MPO expression in lung cells of each group(±s)

表5 各组免疫组化染色肺脏细胞MPO表达的比较(±s)Tab.5 Comparison of MPO expression in lung cells of each group(±s)
注:与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.05。
组别 动物数 剂量(g/kg) IOD空白对照组 10 — 0.075±0.021模型对照组 10 — 0.537±0.061*羧甲司坦片组 10 0.14 0.337±0.069*白及颗粒低剂量组 10 1.8 0.424±0.094#白及颗粒中剂量组 10 3.6 0.379±0.082#白及颗粒高剂量组 10 5.4 0.301±0.078*

图4 大鼠肺组织NE表达的结果(×200)Fig.4 Results of NE expression in rat lung tissue(×200)
2.6 Western blot法检测大鼠肺脏NE和MPO的水平结果 与空白对照组相比,模型对照组NE和MPO蛋白表达显著增高(P<0.01),与模型对照组相比,白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组NE表达均显著降低(P<0.05或P<0.01),见表6。与模型对照组相比白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组MPO表达均显著降低(P<0.05),结果见图 5。
3 讨论
COPD大多是由慢性支气管炎、支气管哮喘等发展而来。其主要病理改变是由于病原微生物造成支气管黏膜不同程度的纤维增生或溃疡,导致气道狭窄和阻塞以及细支气管周围炎,从而造成纤毛运动障碍和痰液分泌增多,痰液不易排出而阻塞,进一步发展为支气管壁溃疡,形成肉芽组织,小支气管塌陷,从而形成阻塞性肺气肿[9]。
COPD是以持续存在的呼吸道症状,气道黏液高分泌气道阻塞同时肺功能快速下降为特征。慢阻肺存在不完全可逆性气流受限是诊断慢阻肺的必备条件[10]。肺功能测定指标是诊断慢阻肺的金标准,FEV1<80%预计值可确定为不完全可逆性气流受限[11]。本研究结果表明白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组FEV0.3%显著增加。
表6 大鼠肺脏NE和MPO表达的相对光密度值(±s)Tab.6 Relative optical density values of NE and MPO expression in lungs of each group(±s)
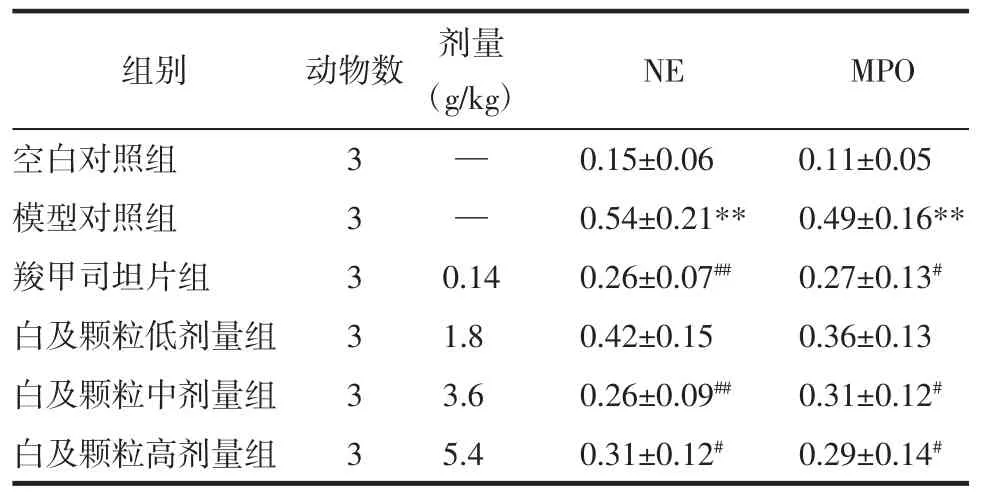
表6 大鼠肺脏NE和MPO表达的相对光密度值(±s)Tab.6 Relative optical density values of NE and MPO expression in lungs of each group(±s)
注:与空白对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01。
组别 动物数 剂量(g/k g) N E M P O空白对照组 3 — 0.1 5±0.0 6 0.1 1±0.0 5模型对照组 3 — 0.5 4±0.2 1** 0.4 9±0.1 6**羧甲司坦片组 3 0.1 4 0.2 6±0.0 7## 0.2 7±0.1 3#白及颗粒低剂量组 3 1.8 0.4 2±0.1 5 0.3 6±0.1 3白及颗粒中剂量组 3 3.6 0.2 6±0.0 9## 0.3 1±0.1 2#白及颗粒高剂量组 3 5.4 0.3 1±0.1 2# 0.2 9±0.1 4#

图5Westernblot法检测大鼠肺脏NE和MPO的水平结果Fig.5 Results of Western blot detection of NE and MPO in rat lungs
黏蛋白是气道黏液的主要成分,是由储存在气道上皮杯状细胞及黏膜下腺的胞内颗粒分泌而来的。中性粒细胞弹性蛋白酶是目前已知的促黏蛋白分泌的最重要的诱导剂[12]。与肺气肿发生有关的内源性蛋白酶主要是中性粒细胞和单核细胞释放的弹性蛋白酶。中性粒细胞弹性蛋白酶能降解肺组织中的弹性硬蛋白及结缔组织基质中的胶原蛋白,破坏肺泡壁的结构。肺泡壁破坏、弹性减弱,更影响到肺的排气能力,末梢肺组织则因残气量不断增多而发生扩张,肺泡孔扩大,肺泡间隔也断裂,扩张的肺泡互相融合形成气肿囊腔。病变累及肺腺泡的各个部位,从终末呼吸细支气管直至肺泡囊和肺泡均呈弥漫性扩张,遍布于肺小叶内。如果肺泡间隔破坏较严重,气肿囊腔可融合成直径超过1 cm的大囊泡,形成大泡性肺气肿[13]。慢性支气管炎伴有肺感染,尤其是吸烟者,肺组织内渗出的中性粒细胞和单核细胞较多,可释放多量弹性蛋白酶。同时,中性粒细胞和单核细胞还可生成大量氧自由基,能氧化α-1 antitrypsin活性中心的蛋氨酸使之失活[14]。α-1 antitrypsin乃弹性蛋白酶的抑制物,失活后则增强了弹性蛋白酶的损伤作用。α-1 antitrypsin缺乏是引起原发性肺气肿的原因,α-1 antitrypsin缺乏的家族,肺气肿的发病率比一般人高15倍,主要是全腺泡型肺气肿。α-1 antitrypsin为呼吸系统的非特异性可溶因子,与呼吸道抵抗力关系密切,它可抑制多种酶的活性,包括细菌的酶,以及中性白细胞溶酶体分泌的蛋白酶、弹性蛋白酶、胶原酶、纤维蛋白溶酶和凝血酶。α-1 antitrypsin的缺乏与慢性阻塞性肺病的形成关系密切,因为它的缺乏,不能及时控制感染和炎症产生的多种蛋白酶,而造成肺组织破坏。
MPO是中性粒细胞的激活标志,其水平变化代表着嗜中性多形核白细胞的活性状态[15]。MPO的主要功能是在吞噬细胞内杀灭微生物,利用过氧化氢和氯离子产生次氯酸盐,并形成具有氧化能力的自由基。MPO不仅能杀灭吞噬于细胞内的微生物,而且可释放到细胞外,破坏多种靶物质,如肿瘤细胞、原虫、毒素等,对机体产生和调节炎症反应等多方面发挥作用。然而,在特定条件下,MPO催化反应生成的氧化剂超过局部抗氧化剂的防御反应时,就会导致氧化性组织损伤[16],炎症向管壁周围组织及肺泡扩展,导致细支气管周围炎,而且还可发生纤维闭塞性细支气管炎,是引起慢性阻塞性肺气肿的病变基础。阻塞性通气障碍慢性细支气管炎时,由于小气道的狭窄、阻塞或塌陷,导致了阻塞性通气障碍,使肺泡内残气量增多,肺泡扩张,间隔变窄,肺泡孔扩大,肺泡间隔断裂,扩张的肺泡融合成较大的囊腔。病理检测结果显示:白及颗粒中剂量组、白及颗粒高剂量组HE染色炎症分级显著降低;白及颗粒剂低剂量组、白及颗粒中剂量组、白及颗粒高剂量组大鼠肺脏细胞α-1 antitrypsin表达显著增加;白及颗粒中剂量组、白及颗粒高剂量组大鼠肺脏细胞NE表达显著降低;白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组大鼠肺脏细胞MPO表达显著降低。蛋白印迹检测结果显示:白及颗粒中剂量组、白及颗粒高剂量组大鼠肺组织内NE及MPO表达显著降低。
白及颗粒可能通过增加慢阻肺模型大鼠肺脏α-1 antitrypsin表达,降低NE及MPO的表达,起到减轻慢阻肺模型大鼠肺组织细胞炎症反应,最终产生改善慢阻肺模型大鼠肺功能的药理作用。

