Sestrin3在子宫内膜样腺癌中的表达及其临床意义
高佩璐 刘 钧
川北医学院,四川省南充市 637100
子宫内膜癌(Endometrial carcinoma,EC)是一类发生于子宫内膜上皮的恶性肿瘤,是女性生殖系统三大恶性肿瘤之一,而子宫内膜样腺癌(Endometrioid adenocarcinoma,EA)是子宫内膜癌中最常见的组织学类型。尽管大多数子宫内膜癌患者确诊时都在早期,具有良好的预后,但晚期或者发生转移的子宫内膜癌患者预后往往较差、生存率较低[1]。预后不良可能与子宫内膜癌的进展有关,进一步探索子宫内膜癌发生发展过程中的具体机制,对于子宫内膜癌患者的诊治及预后具有重要意义。
Sestrins是一类高度保守的应激诱导蛋白家族,包括Sestrin1、Sestrin2和Sestrin3。其中,Sestrin1、Sestrin2的表达受P53调控,而Sestrin3的表达受叉头盒O转录因子(Forkhead box O transcription factor)调控。研究表明,Sestrins在衰老、代谢稳态、脂质积聚和胰岛素抵抗等方面发挥了重要作用[2]。近年来,大量证据表明其与恶性肿瘤性疾病的发生发展也有一定关系。目前研究发现,Sestrin3通过不同机制在食管鳞癌、肝癌、肺癌的进展中发挥了一定作用[3-5],但尚缺乏Sestrin3在子宫内膜癌中的研究报道。本研究应用免疫组织化学方法对子宫内膜样腺癌组织及其前期病变子宫内膜增生不伴非典型性(Endometrial hyperplasia without atypia,EH)/子宫内膜增生伴非典型性(Atypical endometrial hyperplasia,AEH)组织,和增殖期子宫内膜(Proliferative phase of endometrium,PE)组织中Sestrin3的表达情况进行检测,并分析子宫内膜样腺癌组织中Sestrin3的表达与临床病理特征及预后的关系,以对Sestrin3在子宫内膜样腺癌发生发展过程中的作用作一初步探讨。
1 资料与方法
1.1 病例资料 选取2010年4月—2015年4月期间于川北医学院附属医院经病理确诊的93例子宫内膜样腺癌患者组织标本及临床资料,同时选取同期增殖期子宫内膜组织标本30例及子宫内膜增生不伴非典型性、子宫内膜增生伴非典型性组织标本各40例作为对照组。纳入标准:(1)有完整临床资料;(2)子宫内膜样腺癌病例均为原发,术前均未经放化疗或激素治疗;(3)增殖期子宫内膜组织来源于因子宫肌瘤切除子宫的患者。排除标准:(1)合并其他部位恶性肿瘤;(2)正在参与其他研究。子宫内膜样腺癌患者共93例,年龄35~79岁,中位年龄55岁,其中≤50岁28例,>50岁65例;根据2014版世界卫生组织(World health organization,WHO)分级标准,组织学分级1级64例,2级21例,3级8例;国际妇产科联盟(International federation of gynecology and obstetrics,FIGO)分期Ⅰ期81例,Ⅱ期8例,Ⅲ期4例;浸润深度≤1/2肌层80例,>1/2肌层13例;其中63例进行淋巴结清扫手术,术后证实有淋巴结转移3例,无淋巴结转移60例。本研究经医院伦理委员会审批通过,所有患者均对本研究知情并签署知情同意书。
1.2 免疫组织化学染色方法 将石蜡包埋的组织标本进行连续切片(厚度约4μm),使用环保透明剂脱蜡,梯度乙醇脱水,使用高压锅法用柠檬酸组织抗原修复液进行抗原修复,依次滴加3%过氧化氢(封闭内源性过氧化物酶)、山羊血清(封闭组织内非特异性抗原)。之后加入适量Sestrin3抗体(克隆号:P58005,1∶40,成都正能生物公司),4℃冰箱内孵育过夜。第2天滴加相应种属二抗,DAB显色剂显色,苏木素复染,返蓝,脱水,透明,中性树脂封片,显微镜下观察。以试剂盒提供的阳性标本作为阳性对照,以PBS替代一抗作为阴性对照。
1.3 免疫组织化学染色方法结果判读 病理结果由本院两名资深病理科主任医师分别阅片完成,Sestrin3蛋白阳性表达主要位于细胞质及部分细胞核中,呈棕褐色或棕黄色颗粒。依据染色强度评分:0分:不着色,1分:黄色,2分:棕黄色,3分:黄褐色;依据阳性细胞比例评分:0分:无细胞染色,1分:<25%,2分:25%~50%,3分:50%~75%,4分:≥75%。将上述两项评分相乘,0~1分为阴性,2~3分为弱阳性,4~5分为中度阳性,>5分为强阳性。
1.4 随访方法 通过门诊或住院就诊、电话、微信等方式对所有患者进行随访,将因子宫内膜样腺癌死亡定义为结局变量,其他因素死亡均作为截尾数据处理,随访截止时间为2020年4月,记录患者的预后情况。
1.5 统计学方法 采用SPSS21.0软件进行统计学分析,计数资料组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 Sestrin3在不同子宫内膜组织中的表达情况 Sestrin3蛋白主要表达于细胞质和部分细胞核,阳性颗粒为棕褐色或棕黄色(图1)。本实验中Sestrin3在增殖期子宫内膜、子宫内膜增生不伴非典型性、子宫内膜增生伴非典型性、子宫内膜样腺癌组织中的表达阳性率分别为93.33%、87.50%、62.50%、39.78%。各组间Sestrin3的表达不完全相同,且Sestrin3在子宫内膜增生伴非典型性和子宫内膜样腺癌组织中表达的阳性率明显低于增殖期子宫内膜、子宫内膜增生不伴非典型性组织(表1)。
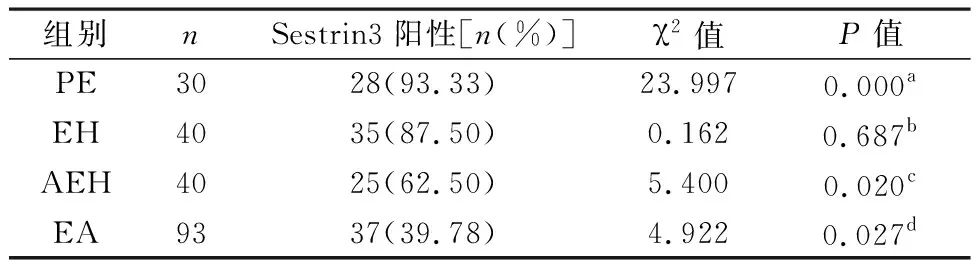
表1 Sestrin3在不同子宫内膜组织中的表达情况
2.2 子宫内膜样腺癌中Sestrin3的表达与临床病理特征的关系 如表2所示,子宫内膜样腺癌中Sestrin3的表达与组织学分级相关(P<0.05),与年龄、肌层浸润深度、淋巴结转移、FIGO分期无相关性(P>0.05)。

表2 Sestrin3表达与子宫内膜样腺癌患者临床病理特征之间的关系
2.3 Sestrin3表达情况与子宫内膜样腺癌患者生存情况的关系 93例子宫内膜癌患者中,共62例患者获得完整随访资料,共5例患者因子宫内膜样腺癌死亡,其中1例为Sestrin3阳性,4例为Sestrin3阴性。Kaplan-Meier生存分析表明,Sestrin3的表达情况与子宫内膜癌患者的生存期无相关性(P>0.05)。见图2。

图2 Sestrin3阳性与阴性患者的总生存曲线Sestrin3阳性18例,阴性44例
3 讨论
Sestrin是一种在应激状态下产生的高度保守的蛋白家族,受P53和FoxO调控。Sestrin可通过抑制雷帕霉素作用靶点复合物1[mechanistic target of rapamycin(mTOR) complex 1,mTORC1]活性、减少活性氧(Reactive oxygen species,ROS)积累、刺激自噬,在多种疾病过程中发挥重要作用[6-7]。
本研究检测了Sestrin3在增殖期子宫内膜、子宫内膜增生不伴非典型性、子宫内膜增生伴非典型性、子宫内膜样腺癌组织中的表达,免疫组织化学法显示Sestrin3的阳性表达率依次降低,符合子宫内膜样腺癌的进展过程,提示Sestrin3的表达下调可能与子宫内膜样腺癌的发生发展相关。Sestrin3作为Sestrin家族的一员,目前在恶性肿瘤中的研究比较缺乏,但已有研究表明,Sestrin3在多种肿瘤发生发展中起着重要作用。敲除Sestrin3基因的小鼠更容易被诱发肝细胞肝癌[4]。在非小细胞肺癌中,胡萝卜素B可通过Sestrin3调控肿瘤细胞的增殖与凋亡[5]。然而在与临床病理特征相关性分析时,发现Sestrin3的表达仅与组织学分级有关,而年龄、肌层浸润深度、淋巴结转移与否、FIGO分期与生存时间关系不显著。虽然生存分析结果显示Sestrin3的表达与子宫内膜样腺癌患者的生存时间关系不显著,但数据表明Sestrin3阴性表达患者中死亡病例共4例,多于Sestrin3阳性表达病例。且Sestrin3阴性死亡病例的生存时间分别为3、7、8、48个月,短于Sestrin3阳性死亡病例。若扩大随访数据、延长随访时间可能会得到不同结果。
mTORC1信号通路在许多肿瘤中都被激活,该通路可通过增加蛋白质、脂质的生物合成和增加能量的产生以促进肿瘤表型。研究表明,mTORC1在子宫内膜样腺癌细胞株中的活性水平明显升高,并促进肿瘤细胞的生长和增殖。且mTOR抑制剂可逆转子宫内膜样腺癌细胞的增殖、迁移和上皮—间质转化(EMT)标志物的表达[8-9]。自噬可作为肿瘤发生的抑制因素,抑制自噬可导致蛋白降解减少、合成代谢增加,从而促进癌细胞的增殖[10]。而在子宫内膜样腺癌中发现存在自噬基因的频繁突变,提示其自噬作用受到损害[11]。已有研究证实Sestrin3的表达可抑制mTORC1信号传导并刺激自噬。
综上所述,Sestrin3在子宫内膜样腺癌发生发展过程中表达逐渐降低,提示Sestrin3可能在子宫内膜样腺癌的发生、发展中发挥抑癌基因的作用,并且可能通过抑制mTORC1和刺激自噬而发挥作用,但这一推测需进一步实验验证。此外,Sestrin3调控mTORC1和自噬的具体机制还有待进一步研究。

