基于转录组测序技术研究慢性避水应激对大鼠腰膨大脊髓背角中基因表达的影响
马力天,白 杨,林 强,苏保伟,孟宪博,王景杰*
(1空军军医大学第二附属医院消化内科,西安 710038;2解放军北部战区总医院神经外科;*通讯作者,E-mail:jingjie@fmmu.edu.cn)
慢性应激在功能性胃肠病症状的发生和发展中起重要作用。慢性避水应激模型(chronic water avoidance stress,CWAS)是Sylvie Bradesi教授在2005年首次提出,该模型会出现持久的内脏痛觉敏化(不低于1个月)、焦虑样行为、粪便颗粒数增多以及结肠免疫系统的轻度激活[1]。肠易激综合征(irritable bowel syndrome,IBS)是一种慢性的功能性胃肠病。全球有9%-23%的人常被该病困扰,并寻求医治[2]。IBS的发生发展与慢性、持续、紧张的人类日常精神应激事件息息相关,且文献表明IBS患者也伴有轻度焦虑和抑郁[3,4]。这些特征与CWAS符合得很好,因此,该模型常被用于研究IBS的内脏痛觉敏化和肠道动力异常。本研究通过慢性避水应激法建立大鼠的CWAS模型,并利用OFT和AWR分别评价其焦虑样行为和内脏敏感性,之后采用转录组学测序探究其腰膨大处脊髓背角中基因表达的变化,为后续对慢性应激的研究提供参考。
1 材料与方法
1.1 动物、主要仪器和试剂
SPF级健康雄性SD大鼠24只,体质量180-220 g,由空军军医大学实验动物中心提供。大鼠在实验前进行为期1周的适应性饲养,环境温度22-26 ℃,湿度40%-60%,自由饮食,光照12 h/12 h明暗交替。所有的努力都是为了减少实验动物的数量和痛苦。过量使用2%的戊巴比妥钠(40 mg/kg)安乐死动物后进行取材。本研究实验动物的使用及处置方法符合3R原则,实验开展前经过空军军医大学动物伦理委员会的批准。24只大鼠被随机分成两组:假模型组(sham组)和慢性避水应激组(CWAS组),每组12只。
高通量转录组测序仪(Illumina),Qubit荧光计(Invitrogen,Q32866),微型旋涡混合仪(上海沪西,WH-3),台式高速低温离心机(Thermo,Thermo Scientific Sorvall Legend Micro 21R),PCR仪(Bio-rad,T100TMThermal Cycler),电泳仪(北京六一,DYY-11),生物电泳图像分析系统(复日,FR-980A)。
Qubit RNA检测试剂盒(Life,Q32855),Qubit DNA检测试剂盒(Life,Q10212),Hieff NGSTMMaxUp Dual-mode mRNA Library Prep Kit for Illumina(YEASEN,12301ES96),Hieff NGS DNA Selection Beads(YEASEN,12601ES96)。
1.2 CWAS造模方法
根据文献[5]所述,用亚克力板制作一透明塑料盒,长宽高分别为45,25,25 cm。其中央有一平台,长宽高分别为10,8,8 cm(见图1)。实验时,向盒中注入25 ℃的水,水面距台面约1 cm。每日上午9点将大鼠轻轻放置于平台上1 h,并持续10 d。对照组放置于不盛水的相同的塑料盒中,时间与CWAS相同。

图1 自制的CWAS造模设备
1.3 旷场实验
旷场实验(open field test,OFT)由黑色有机玻璃组成,长宽高分别为100,100,60 cm,中间50 cm×50 cm为中央区。提前24 h将大鼠饲养于行为室。实验时,双手轻轻将大鼠抱起置于中央区,使用动物追踪系统(Shanghai Mobile Datum Information Technology)记录大鼠活动轨迹10 min。每只动物检测前,清理其中大小便并用70%的乙醇擦拭实验装置,待酒精完全挥发后进行下一次实验。采用中央区路程百分比、中央区活动时间百分比来评价大鼠焦虑行为。
1.4 腹壁撤退反射
腹壁撤退反射(abdominal withdrawal reflex,AWR)是公认的评价内脏敏感性的方法。AWR通过扩张肠道,观察动物腹部收缩的程度来评价动物内脏敏感性。利用血压计、橡胶手套(中指段)、三通管和8F导尿管(沃德硅胶管)自制实验设备(见图2)。实验前用乙醚轻微麻醉大鼠,并提前30 min将其置于亚克力材质的自制有机玻璃盒中,使大鼠无法前后运动。气囊每次进入大鼠肛门的深度约为6 cm,并用胶布将尿管末端黏在大鼠尾根部,防止脱落。同一压力扩张时间约为20 s,每次扩张的间隔时间为4 min。分别在20,40,60,80 mmHg四个压力等级处观察大鼠行为学反应,并按照以下标准进行评分[6]:0分,大鼠对扩张无任何反应;1分,大鼠出现轻微不适,偶尔扭动头部;2分,腹背部肌肉轻微收缩但未抬离地面;3分,肌肉强烈收缩并将腹部抬离地面;4分,呈弓形,并将腹部和会阴部抬离地面。每一压力等级测量3次取平均值进行统计学分析。

图2 自制的AWR测量仪器
1.5 真核转录组RNA建库、测序和分析
分别选取对照组和CWAS组各3只大鼠,安乐死后用脊髓吹出法[7]取出脊髓,并使用无RNA酶的手术器械小心取出腰膨大处的脊髓背角,置于冻存管内并于液氮中速冻。首先利用Qubit RNA检测试剂盒对总RNA精确定量并进行mRNA纯化和片段化。之后合成、纯化双链cDNA、末端修复/dA尾添加反应、接头连接,并进行分选,用于文库扩增。最后用凝胶电泳进行文库质检,并进行测序,测序后依次进行样本质量控制、样本相关性检验、表达差异分析及差异基因功能富集分析,具体步骤如下。
①样本质量控制:高通量测序平台(Illumina HiseqTM)测得的原始图像数据文件经CASAVA软件碱基识别(base calling)分析转化为原始测序序列(sequenced reads),称为raw reads。raw reads中含有带接头的、低质量的序列。为了保证信息分析质量,必须对原始数据过滤,得到过滤后的数据,使用数据过滤软件(Trimmomatic)进行数据处理。
②样本相关性检验:在本实验中,每组有3个生物学重复,其目的一方面证明涉及的生物学实验操作是可以重复的且变异不大,另一方面确保后续得到可靠的结果。在转录组学测序结果的分析中,为了使不同基因、不同实验之间的基因表达水平具有可比性,TPM(transcript per million)被引入用来估算基因表达水平。TPM同时考虑了测序深度、基因长度以及样本对reads计数的影响,常用于基因表达水平的估算。样品间基因表达水平相关性是检验实验可靠性和样本选择是否合理的重要指标。采用Pearson相关系数表示样本间基因表达的相关性,Pearson相关系数数越接近于1,表明相关性越强[8]。
③表达差异分析:对照组和CWAS组,每组有3个生物学重复,我们采用R中的软件包DESeq进行分析。筛选条件设为:q<0.05(q值是校正后的P值,该值越小表示基因表达差异越显著)且差异倍数|fold change|>2。
④差异基因功能富集分析:与基于基因表达差异分析不同,基因富集分析可以找出表达水平有差异的基因集。富集分析为基因集合的表达差异分析,能够识别出生物现象最相关的生物学途径。使用ClusterProfiler进行功能富集分析,当q(校正后的P值)小于0.05时,认为该功能存在显著富集情况。我们采用GO(gene ontology)和KEGG(Kyoto encyclopedia of genes and genomes)两种分析方法对差异基因进行功能注释,并绘制差异基因富集功能气泡图。
1.6 统计学分析
2 结果
2.1 CWAS组大鼠的行为学变化
OFT结果提示,与对照组相比,CWAS组的中央区路程百分比和中央区活动时间百分比均显著低于对照组(P<0.01,见图3)。
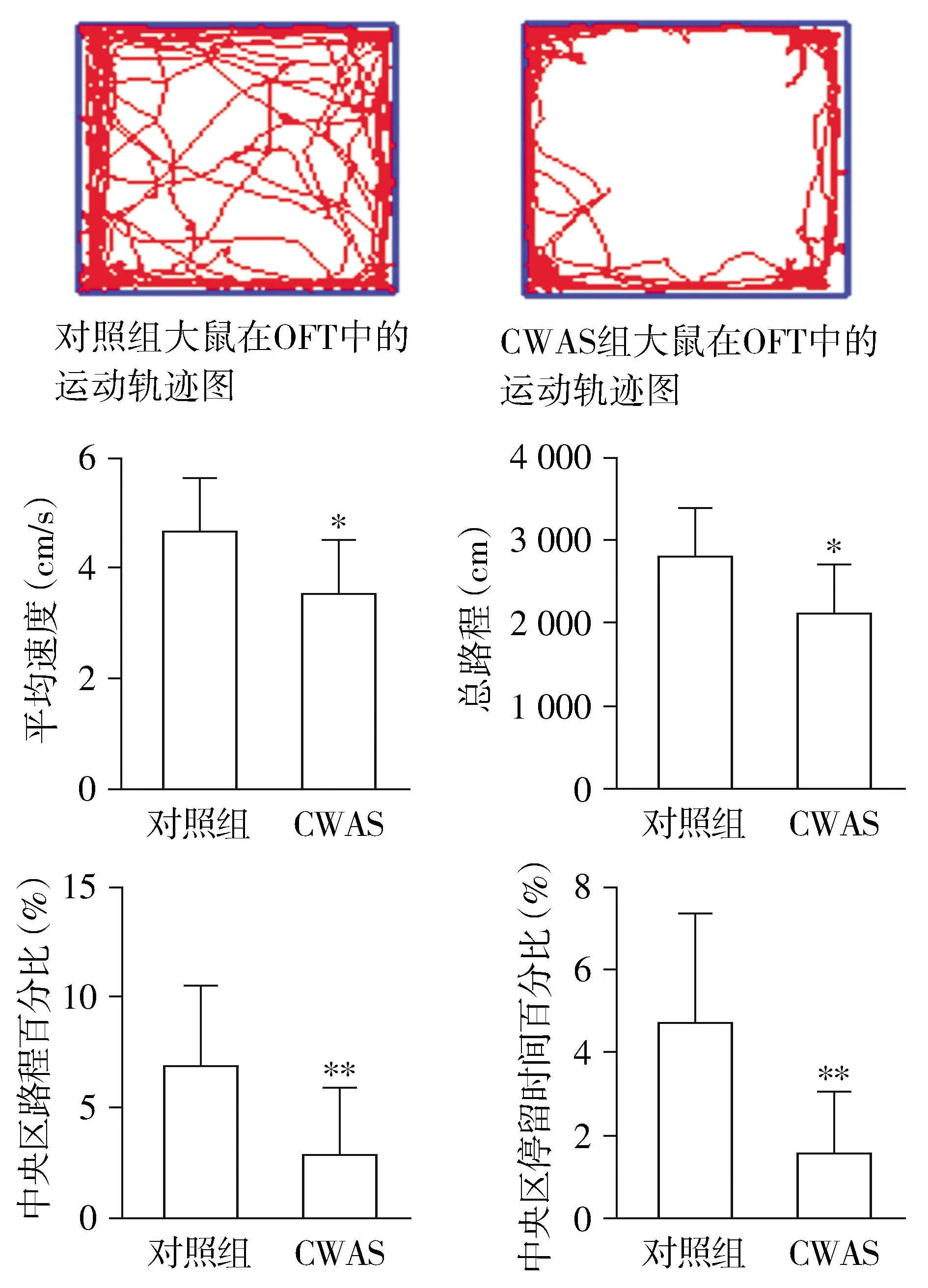
与对照组相比,*P<0.05,**P<0.01
2.2 CWAS组大鼠的内脏敏感性增加
造模结束后,与对照组相比,CWAS组在20,40,60,80 mmHg压力下的AWR评分显著增加(P<0.05,见图4)。

与对照组相比,*P<0.05
2.3 各样本质量控制后数据信息
使用数据过滤软件(Trimmomatic)依次去除带N碱基的序列、去除reads中的接头序列和去除低质碱基。各样本质量控制后数据信息见表1。

表1 各样本质量控制后数据信息
2.4 样本相关性检验结果
对不同样品的基因表达图谱进行相关性分析,并制作成热图(见图5),结果表明,生物学重复样本间相关性较好,能够进行下一步统计学分析。

颜色块代表相关性指数值,颜色越灰表示样本间相关性指数越低,颜色越黄则相关性指数越高
2.5 组间基因表达差异分析
与对照组相比,CWAS组有11个基因发生了上调,基因表达差异分析结果见表2。我们选用散点图将基因在两组中测量值用点表示在坐标系中,可以直观地反映出两个测量值之间的关系,结果见图6。散点图中,横纵轴分别为两组样本log2TPM值,图中每个点代表一个基因,越接近原点的点表达量越低。其中红色表示上调基因,绿色表示下调基因,黑色表示非差异基因,上调/下调均是纵轴样本相对于横轴样本。

表2 CWAS组中发生上调的基因

图6 两组间差异基因表达散点图
2.6 差异基因功能富集分析
通过GO富集分析和KEGG富集分析,可以识别出生物现象最相关的生物学途径。气泡图的纵轴表示功能注释信息,横轴表示功能对应的富集指数(注释到该功能的差异基因数目除以注释到该功能的基因数目),q(校正后的P值)的大小用点的颜色表示,q越小则颜色越接近红色。每个功能下包含的差异基因的多少用点的大小来表示。CWAS组与对照组相比,细胞质部分的差异最大(校正后P<0.05,见图7);CWAS组的PI3K-Akt、FoxO、NF-κB和破骨细胞分化相关信号通路被激活(见图8)。

图7 两组间差异基因的GO富集分析

图8 两组间差异基因通路的KEGG富集分析
3 讨论
一些与压力相关的精神类疾病或者应激常会导致内脏痛,并常合并焦虑症和抑郁症,然而其具体机制仍有待阐明[9]。在啮齿类动物中,束缚应激、避水应激和母婴分离常被用于研究应激引起的内脏敏化,有证据表明,长期的应激会促进对疼痛的感知并使疼痛感觉通路更加敏感[10]。既往的研究表明,应激诱导的内脏痛与大脑内DNA甲基化和组蛋白乙酰化模式改变有关,从而导致伤害感受神经递质表达增加[11]。然而,脊髓中内脏痛觉敏化的机制需要进一步研究。在本研究中,我们用转录组学测序分析了CWAS组与对照组之间脊髓背角腰膨大中基因表达的差异,并进行了富集分析。结果提示,与对照组相比,CWAS组有11个基因表达显著上调,以下将分别进行讨论。
Retsat主要编码视黄醇饱和酶,该酶催化全反式视黄醇双键的饱和,导致生成二氢类视黄醇代谢物。除了主要参与维生素A的代谢之外,还可以调节细胞对氧化应激的反应,是细胞对氧化应激和活性氧(ROS)的主要调节剂,并在脂肪的形成和积累中发挥重要作用[12]。慢性不可预测的轻度应激(chronic unpredictable mild stress,CUMS)会产生氧化应激和炎症相关的代谢改变,并最终引发许多慢性退行性疾病,例如心血管疾病、糖尿病和阿尔兹海默病[13]。慢性避水应激会引起小鼠神经系统炎症[14]以及大鼠肠道黏膜炎症[15]。Retsat在CWAS组中的上调,可能是对CUMS响应。
Sgk1基因编码血清和糖皮质激素调节蛋白激酶,是一种新的丝/苏氨酸蛋白激酶,该酶在细胞应激反应中起重要作用。当细胞受到糖皮质激素、血清、IL-6、扭转力刺激等,Sgk的转录水平会迅速升高[16]。升高的SGK1调节下游多个信号通路,抑制细胞凋亡,拮抗缺血再灌注所致的神经细胞凋亡。此外,SGK1在抑郁症患者和动物体内的表达水平明显升高,可能与抑郁症的发生有关[17,18]。SGK1与CWAS的直接联系尚未有报道,我们推测,SGK1可能与慢性避水应激引起的大鼠的焦虑情绪有关,可能也参与了CWAS引起的炎症反应,这需要进一步验证。
ZBTB16亦称为早幼粒细胞白血病锌指蛋白(PLZF),该蛋白除了调控细胞周期并参与细胞增殖、凋亡等过程外,还可被糖皮质激素强烈诱导,引起脂质和胰岛素水平的改变[19,20],并通过降低正常小鼠IRS1、Akt和FoxO1磷酸化来负调节胰岛素信号通路[21]。下丘脑—垂体—肾上腺轴(HPA)的持续激活是慢性应激的显著特征之一[22],激活的HPA释放皮质醇,激活多种信号通路,并启动基因组事件,从而导致外周和中枢神经系统生理发生长期变化[23]。慢性避水应激可能是通过激活HPA轴产生皮质醇,并诱导ZBTB16的表达增加,参与了CWAS所致的内脏敏化,并与神经可塑性有关。
CDKN1A(Cyclin dependent kinase inhibitor 1A)编码一种细胞周期蛋白依赖激酶抑制剂,是调控细胞周期的一个重要因子。P53严格调控该基因的表达,通过该蛋白介导P53依赖细胞周期G1期停滞,以响应各种应激刺激。该基因还可在S期DNA复制和DNA损伤修复中起调节作用。流行病学研究表明,慢性心理应激会促进肿瘤发生,其可能的原因是慢性应激激活HPA轴并释放皮质醇,诱导ZBTB16和SKG1的表达增加,进而增加MDM2并降低P53的活性与功能[24]。P53功能的降低可能会使CDKN1A表达下降,细胞周期停滞变短,从而促进肿瘤发生。
核因子kappa B(NF-κB)参与细胞对外界刺激的响应,在细胞的炎症反应和免疫应答中起关键作用。NFKBIA是NF-κB复合物抑制蛋白IκB的编码基因,可与NF-κB结合,并阻止其向核内转移。研究表明,CWAS组大鼠的回肠末端,NF-κB信号通路和炎症因子的活化会介导低度黏膜炎症[25]。NF-κB信号通路会引起促炎因子的表达,促炎因子的表达又会进一步促进NF-κB信号通路的活化,从而使肠道黏膜通透性增强,导致肠易激综合征[26]。NFKBIA在脊髓背角中的上调,可能是对NF-κB信号通路活化的响应,其作用或许是抑制过度活化的NF-κB信号通路。我们推测,在CWAS中,NF-κB信号通路的活化与抑制蛋白IκB表达的上调同时存在。
巨噬细胞加帽蛋白(CapG)属于凝溶胶蛋白超家族之一,参与细胞内信号转导过程并调控肌动蛋白[27]。在神经系统中,CapG可能会调控树突棘的成熟[28]。已有研究证实,慢性束缚应激导致大脑的某些区域(如海马)的树突棘密度增加,并且糖皮质激素也可以通过调节脑源性神经营养因子(BDNF)调控树突棘的密度[29]。因此我们推测,在CWAS中,CapG表达的增加可能与突触的可塑性和内脏敏化有关。
Apold1是在内皮细胞中鉴定出的一种基因,可对不同刺激(包括缺血、细胞因子和压力等)做出反应,该基因在血管内皮中的缺失会增加凝血并促进血栓形成[30]。最新的研究表明,Apold1作为一种炎症标志物可在精神分裂症患者的海马中增加,提示可能参与了神经系统的炎症反应[31]。IBS除了肠道中的黏膜炎症外,神经炎症常通过脑肠轴参与IBS的病理过程,从而导致神经—内分泌等一系列生理病理变化[32]。CWAS中的Apold1表达增加,可能是神经系统炎症所致。我们还需要更多的数据才能明确其功能。
3-磷酸甘油脱氢酶-1(Gpd1)和丙酮酸脱氢酶激酶-4(Pdk4)都与机体能量代谢有关。Gpd1的功能是催化磷酸二羟丙酮(DHAP)和α-磷酸甘油之间的转化,与人体的肥胖有关并与体质量指数(BMI)成正相关[33]。Pdk4是调节丙酮酸脱氢酶复合物(PDC)的关键酶,禁食和高脂饮食的刺激下,Pdk4在组织中的活性明显增加,心脏中Pdk4的过度表达会导致脂肪酸利用率升高和碳水化合物消耗降低[34]。IBS患者可在多种因素的作用下发生水、糖和电解质的代谢紊乱[35]。CWAS组中Gpd1和Pdk4的高表达可能与慢性应激所致的代谢改变有关,具体作用方式还需要进一步研究。
结缔组织生长因子(CTGF)参与神经系统的炎症反应或损伤修复过程。大鼠星形胶质细胞分泌的CTGF可通过活化星形胶质细胞中的ASK-p38/JNK-NF-κB/AP-1信号通路,以自分泌的方式激活星形胶质细胞,并促进星形胶质细胞介导的炎症反应[36]。CWAS组中CTGF表达显著升高可能参与了神经系统炎症反应,其机制需要进一步研究。
肿瘤坏死因子受体超家族成员11A(Tnfrsf11a)属于肿瘤坏死因子及其受体超家族,编码蛋白体核因子κB的受体激活剂(RANK)[37]。RANK是核因子κB受体活化因子配基(RANKL)唯一的受体,启动RANKL-RANK信号通路。该基因的突变会导致Paget骨病、扩张性高磷血症和家族膨胀性骨溶解[38]。研究表明,RANKL-RANK信号通路可通过小胶质细胞中的Toll样受体信号通路减轻小鼠缺血性脑病中的炎症[39],并且,RANKL可以在发育过程中直接作用于神经元的轴突,并抑制其生长[40]。目前尚不清楚在CWAS中Tnfrsf11a的上调是否为机体对慢性应激所致轻度炎症的响应,还需要进一步研究。
到目前为止,IBS仍然对人们造成极大的困扰。随着科学的发展,人们希望能找到新型的生物标志物来帮助对IBS进行诊断,并且更好地理解IBS的病理生理,尤其是在基因组、蛋白质组和转录组等层面深入了解IBS的发病机制。我们在本研究中,使用啮齿类动物的避水应激模型模拟人类的IBS,通过转录组学的方法筛选出表达异常的基因,为进一步研究提供参考。

