在自主建构中深度认识非金属元素的研究思路
魏平 程洁銮 吕明静
摘要:以“位—构—性”思维模型为指引,充分发挥元素周期表的预测功能。基于卤族元素的位置和结构特点,引导学生对卤族元素的非金属性和对应单质的氧化性进行推断和预测,并设计实验验证,从而实现学生对卤族元素性质的意义建构,充分发挥学生的主体性,发展并提升学生证据推理与模型认知素养。
关键词:“位—构—性”模型;元素性质;意义建构
文章编号:1008-0546(2021)11-0044-03中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.11.011
一、问题的提出
建构主义的学习要求学生通过高水平的思维活动来学习,通过问题解决进行学习。学生要不断思考,对各种信息和观念进行加工转换,基于新、旧知识进行综合和概括,解释有关的现象,形成新的假设和推论,并对自己的想法进行反思性的推敲和检验[1]。但在教学实践中,发现教师往往容易忽视旧知对新知建构的重要性,使学生无法以旧知为出发点,通过信息提取,尝试推理分析,从而获得新知,解决问题。
譬如,卤族元素及其化合物的学习安排在元素周期表和碱金属元素的内容之后,可以作为一个很好的案例来引导学生应用前面已经建立的“位—构—性”思维模型[1],这可使学生在加深对元素周期表认识的同时,发展其对模型的应用能力。反观目前,大部分教学多采用观察和归纳的教学方法来引导学生认识卤族元素及其化合物的性质,将构建“位—构—性”思维模型作为教学的终点[2]。此教学忽略了该内容对发展学生的学科核心素养的价值,特别是证据推理和模型认知素养,教师无法引导学生思考学习这个模型有什么用以及如何应用,学生无法认识到模型的作用——预测功能,导致其在应用该模型预测其它陌生元素的性质时出现了障碍,只能通过机械记忆的方法来认识卤族元素的性质,无法建立非金属元素的研究思路,从而未能自主构建元素周期律。
二、教学设计
1.教学逻辑分析
本课时的教学内容主要是探究卤族元素递变性、相似性的规律。通过前面的学习,学生已经具备了元素周期表的相关知识并对碱金属元素的性质进行了探究,初步建立了“位—构—性”思维模型,本节课的目标在于促进学生对原子结构与元素周期律第三层次知识的认识,重点引导学生巧妙运用“位—构—性”模型来预测和认识卤族元素的性质,在体会元素周期表预测功能的同时,达到模型的应用水平,从而发展学生的证据推理与模型认知素养,为下一步自主构建元素周期律打下思维和方法的基础。
在学习本节课之前,学生需要具备的已有认知基础和认识角度,以及教师所需发挥的作用,具体见表1。


2.学情分析
本校学生已认识了碱金属元素性质的相似性和递变性,建立了金属元素的研究思路,初步构建了“位-构-性”的思维方式,但体现到应用上,还存在一定的差距。本节内容从金属元素到非金属元素的迁移,既有元素失电子能力和得电子能力的差异,又有单质还原性和氧化性强弱比较的实验方法的差异。通过本节课,引导学生应用“位—构—性”模型对非金属元素的性质进行预测和分析,从而诊断和发展学生的证据推理和模型认知素养。
3.目标分析
(1)通过卤族元素的原子结构的推导认识原子结构与元素在周期表中的位置关系,为“位—构—性”方法模型提供认识基础。
(2)通过卤族元素单质氧化性强弱预测及实验验证,发展学生的证据推理素养。
(3)通过卤族元素的元素结构到物质性质的学习,充分应用“位-构-性”的方法模型,提升学生的模型认知素养。
4.教学流程(见表2)
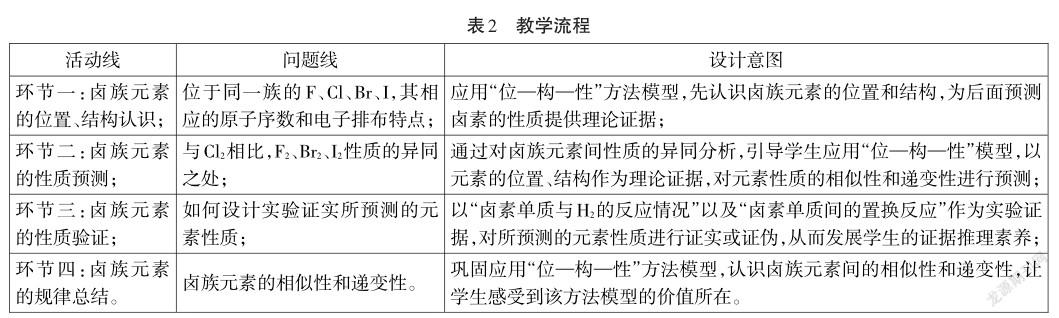
5.教学实录
环节一:认识卤族元素的结构、位置
【教师】如何推测Cl位于元素周期表的位置?
【学生】画出Cl的原子结构示意图,根据其电子层数和最外层电子数推断出Cl在元素周期表中的位置为第三周期ⅡA族。
【教师】已知F、Cl、Br、I位于同一族,其相应的原子序数和电子排布是?
【学生】根据元素周期表中各周期的元素种类,推导出F、Br、I的原子序數,并根据核外电子的排布特点,画出卤族元素的原子结构示意图。
环节二:了解卤族元素单质的物理性质和化学性质的相似性
【教师】首先,我们来看卤族元素构成的单质的图片,发现物理性质会有一定的规律性,比如颜色逐渐加深,由浅黄绿色的氟气变为紫黑色的碘单质,状态由气体变为固体,熔沸点都在逐渐增大。那么卤族元素构成的单质化学性质有什么规律性吗?Cl元素对应的单质Cl2具有什么性质呢?
【学生】能与水发生反应;能与碱发生反应;能与金属单质(如Fe、Cu)发生反应;能与非金属单质(如H2)发生反应。
【教师】那么Br2能发生哪些反应呢?
【学生】能与水发生反应;能与碱发生反应;能与金属单质发生反应;能与非金属单质发生反应。(大部分同学并不能通过同族元素性质相似来进行预测,只是零星的说出一些反应)
【教师】为何如此预测呢?预测的依据是什么?
【学生】Br与Cl位于同一族,最外层电子数一样,性质相似。
环节三:卤族元素单质化学性质的递变性
【教师】同一族的元素性质具有相似性,那是否存在差异呢?
【学生】有,从上到下,元素对应的核外电子层数逐渐增大。
【教师】电子层数增大,相应的原子半径有何变化呢?
【学生】变大。
【教师】这对元素的性质有何影响?
【学生】(进行讨论后得出结论)原子半径增大,原子核对外层电子的吸引力变小,得电子能力变弱。
【教师】卤族元素从上往下,得电子能力越来越弱,那么卤素的单质性质会发生怎样的变化呢?比如氯气能够与氢气发生反应,氯气做氧化剂,氢气做还原剂。其它卤素单质都能够与氢气反应,都是做氧化剂,请大家讨论,氟气、氯气、溴单质、碘单质与氢气反应,哪种反应最容易,最剧烈?
【学生】(讨论后)随着原子核电荷数的增多,卤素单质与H2的反应越来越难。
【教师】为什么反应越来越难?
【学生】卤素原子要吸引电子,达到8电子的稳定结构,说明了随着原子核电荷数的增多,卤素原子半径增大,核内质子对核外电子的吸引力减弱,卤素单质的得电子能力越来越弱,所以与氢气反应越来越难,氢化物的稳定性也越来越弱。(通过课本表格验证)
【教师】随着原子半径的增大,卤族元素的非金属性从上往下逐渐减弱,对应单质的氧化性也是逐渐减弱,即氧化性:F2>Cl2>Br2>I2,那应如何设计实验,证实Cl2的氧化性大于Br2呢?
【学生】氧化剂大于氧化产物,可选Cl2作氧化剂,以Br-作还原剂(如KBr),看是否能够生成产物Br2。
【教师】演示实验,向KBr溶液中滴加适量的氯水,充分振荡。
【学生】观察实验现象。发现溶液变黄。
【教师】能否判断生成了Br2吗?
【学生】不能,因为氯水也呈黄绿色,有可能是加了氯水的原因。
【教师】提供资料卡片,即Br2的CCl4溶液呈橙色,I2的CCl4溶液呈紫红色,CCl4为有机溶剂,不溶于水,密度比水大。
【学生】提议说,向混合溶液中,再滴加少量的CCl4,充分振荡,若CCl4层呈现橙色,则证实有Br2生成。
【教师】依照学生的讨论结果,继续实验操作,
【学生】观察到CCl4层呈现橙色,说明有Br2生成,即氧化性:Cl2>Br2。
【教师】那如何设计实验验证氧化性:Br2>I2呢?
【学生】参考上述的实验设计思路,在教师的引导下,取出试管中的Br2的CCl4溶液,并滴加适量的KI溶液,充分振荡,观察到下层溶液呈紫红色,证实了有I2生成,由此证明:氧化性:F2>Cl2>Br2>I2
环节四:卤族元素规律总结
【教师】由此,我们学习了非金属元素的研究思路,最外层电子数决定了非金属元素容易得电子,从而其单质一般具有氧化性;半径的大小决定了非金属元素得电子的能力,从而判断其单质氧化性的强弱。请归纳卤族元素的性质。
【学生】在卤族元素中,最外层电子数都为7个,容易得1个电子达到稳定结构,从而卤素单质都具有氧化性;随着原子核电荷数的增多,卤素原子半径增大,核内质子对核外电子的吸引力减弱,卤素单质的得电子能力越来越弱,所以其单质的氧化性:F2>Cl2>Br2>I2。
三、教学效果与反思
在以往的教学中没有区分元素性质和元素构成物质的性质,导致学生对得失电子能力和氧化性还原性等概念容易产生混淆,影響了学生对“结构决定性质”的判断,也无法形成研究非金属元素的思路,只能死记硬背物质的化学性质。本节教学中注意引导学生区分卤族元素的性质是得电子的能力,其构成单质的性质是氧化性,后期还要引导学生区分元素构成的化合物的性质,概念的层次区分明显,从而有助于学生的理解和构建研究思路。
当今的建构主义者提出:没有对事物的唯一正确的本质抽象表征,不能通过语言简单地把经过形式化概括的知识传递给学生[1]。在教学中发现,即使是最外层电子数相同,对应单质的化学性质相似这个类比推测性质的认识思路,大部分学生也仅仅是了解,无法应用在陌生物质性质的预测上,比如学生在预测Br2所能发生的反应上,只能零星说出个别反应,并不能根据Cl2性质的相似性来预测出所有的反应,所以在课堂上需要创设问题情景,使学生不断尝试使用刚建立的方法和思路,进行试错和思考,从而达到模型的应用水平,而不是简单的记忆和理解。通过本节课基于“位-构-性”教学模型的设计,在本节课的结尾,大部分学生可以预测和推理出I2能够与NaOH溶液反应,并且可以快速推测出反应的产物。
上一节课探究碱金属元素性质的相似性和递变性的方法是本节课的知识生长点,在此基础上,利用非金属元素与金属元素在原子结构上的相似性,比如最外层电子数相同,原子半径逐渐增大,来进行单质化学性质的预测,然后设计实验来进行验证,从而深化“位-构-性”方法模型,让学生完整体验了非金属元素的研究思路,发展并提升了学生证据推理与模型认知的核心素养。
参考文献
[1]张建伟,孙燕青.建构性学习[M].上海:上海教育出版社,2005:52
[2]庄乾敏,刘冰,张雪.基于化学史发展学生学科核心素养的教学——以“胶体”为例[J].化学教育(中英文),2019,40(13):28-32
[3]王峰,刘金翠.基于内容分析与教学设计的教材“二次开发”研究——以“元素周期律与元素周期表”为例[J].化学教育,2013,34(12):18-21

