超声引导下125I粒子植入联合TACE治疗HCC伴门静脉癌栓的SPECT-CT显像研究
钟锦绣 李海峰 简 艳 周 琳 陈志军
原发性肝细胞癌(hepatocellular carcinoma,HCC)是目前最常见的恶性肿瘤之一,而门静脉癌栓(portal vein tumor thrombosis,PVTT)是HCC晚期严重的并发症之一,发生率为62.2%~90.2%[1]。据报道,大概有1/3 HCC患者一经诊断就合并有PVTT[2]。PVTT会导致严重的门静脉高压,后期加重肝脏负担,最终导致肝功能衰竭,肝性脑病、全身多处转移,预后极差,若不干预治疗,患者平均生存期仅为2.7~4.0个月[3]。目前治疗肝癌合并PVTT的方式主要是TACE联合超声引导下125I植入术,但125I粒子漂移是粒子植入术后常见现象,而检出125I粒子漂移及精确位置定位比较困难。本文回顾性观察TACE-125I治疗HCC伴有PVTT患者的疗效,同时使用SPECT-CT评价125I粒子组织间植入术后粒子漂移情况,并利用SPECT-CT融合显像进行精确位置定位,对粒子漂移情况进行断层分析,探讨SPECT-CT显像评价125I粒子漂移的价值。
1 资料与方法
1.1 一般资料
收集我院自2016年2月至2020年12月行超声引导下穿刺治疗肝脏恶性肿瘤77例。纳入标准:①非手术适应证患者;②不能耐受手术治疗及放、化疗的患者;③拒绝手术、放疗、化疗的患者;④放疗、化疗后失败的患者;手术后复发不能再次手术的患者;⑤无全身广泛转移的患者,或者有转移经过积极治疗得到有效控制的患者;⑥KPS(Kamofsky performance statu,KPS)评分大于60分,预期存活6个月;⑦术后2~30天有SPECT-CT显像者;⑧所有患者同意并签署知情同意书。禁忌证:①恶病质;②不能耐受经皮穿刺手术;③严重心肺功能不全;④重度上腔静脉综合征及广泛侧支循环形成。77例入组患者治疗前后均完善血常规、心电图、肝功能、凝血功能检查、上腹部进行CT平扫+增强扫描及MRI检查。
初筛结果:77例伴有PVTT不可切除的HCC患者中,有26例因资料不全或没有在我院随访而排除,一共收集51例患者,患者中男性47例,女性4例,年龄25~77岁,平均年龄:(50.68±1.46)岁。平均随访时间为7.2个月。
1.2 器材
计算机三维系统治疗计划系统(treatment planning systern,TPS):北京航天科霖科技有限公司。18 G植入针,粒子枪,天津赛德生物技术有限公司;放射性125I粒子:半衰期59.4 d,活度1.48×107~2.96×107MBq/粒,北京原子高科公司;粒子植入防护设备包括铅围裙、铅眼镜、铅围脖、铅手套等。 SPECT-CT仪Symbia T2,德国Siemens公司。
1.3 方法
1.3.1 TACE治疗 用Seldingers法经股动脉穿刺插管至肝固有动脉或其分支后造影观察肿瘤染色情况。超选至肿瘤供应血管后化疗药(丝裂霉素、5-FU、伊立替康、洛铂、阿霉素等),超液化碘油10~30 mL乳化后缓慢注入,均常规护肝、抗感染治疗。
1.3.2125I粒子植入术 患者于术前3天行平扫+增强CT或MRI扫描,术前依照肿瘤位置、邻近重要器官、大小等确定其合适体位,再用真空负压垫将其固定。超声引导下行经皮穿刺51例肝脏恶性肿瘤,定位准确顺利,超声确定穿刺针的进针位置、方向、深度,避开大血管及神经(针道间隔0.5 cm)并行125I粒子植入术。术后行SPECT-CT显像,并将CT图像DICOM格式传输至TPS计划系统,设定处方剂量为120 Gy,用软件勾画肿瘤靶区体积(GTV)及毗邻危及器官(OAR),进行剂量验证并进行补种。
1.3.3 SPECT-CT扫描 采用德国SIEMENS SYMBIA T2双探头SPECT-CT仪,配低能通用型准直器。将粒子植入病灶静置于探头视野中心,仪器自动采集,采集能峰:35.5 KeV,窗宽:20%,全身扫描速度为10 cm/min;矩阵:128×128,采集速度:40秒/帧。行CT断层扫描,扫描参数:电压130 kV,螺距2,层厚5 mm扫描。最后利用SPECT-CT附台的融合软件,将SPECT断层图像和CT解剖图像进行融合。由2位医师单独分析全身扫描图像和SPECT-CT图像判断漂移粒子。
1.3.4 疗效评价 采用mRECIST评估近期疗效[4]。根据CT扫描或MRI检查,采用新系统[5]对PVTT反应进行分类,其分类如下:(1)完全反应(CR)为PVTT消失并恢复门脉血流;(2)部分反应(PR)为PVTT消失或最低横截面区域血栓减少>30%,门静脉血流改善;(3)疾病稳定(SD)为血栓扩展。
1.4 统计学方法
采用SPSS 22.0 软件进行统计学分析。
2 结果
2.1 粒子植入情况
手术操作成功率100%。肿瘤共植入粒子 967枚(平均每例 19枚)。 植入后验证,125I 粒子实际 D90为 90~160 Gy(平均 136 Gy)(图 1)。 51例患者中3例重复进行了125I粒子植入,并有40例患者进行了反复的TACE(范围1~8次)。125I粒子植入后4周胆红素水平上升,但8周时胆红素水平仍较高(表1)。
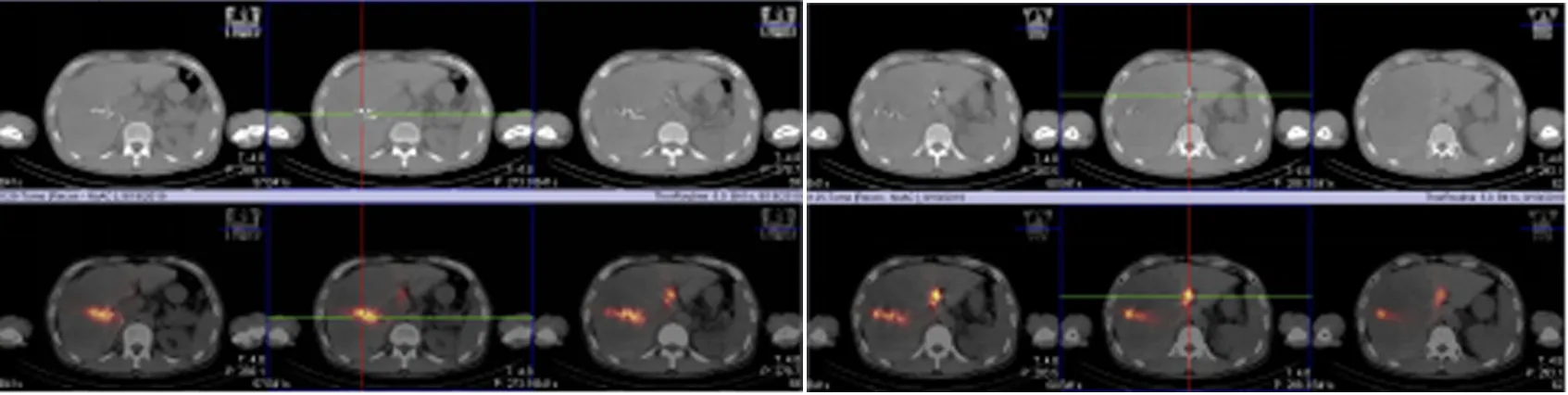
图1 肝癌并发肝左、右门静脉支癌栓患者的125I植入情况及SPECT-CT 融合图像
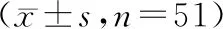
表1 TACE-125I组4周和8周后肝功能改变
2.2 临床疗效与随访情况
2.2.1 肝内病变治疗效果 肝内病变CR 0例,PR 34例,SD 10例,PD 7例;肝内病变疾病控制率86.3%。
2.2.2 PVTT反应 CR 0 例,PR 20例,SD 16例,PD 15例;客观反应率70.6%。
2.3 手术相关不良反应
肝脏包膜下少量出血2例(3.9%),粒子肝内游走13例(25.5%),肝区疼痛不适1 例(2.0%),均无需特殊处理;1 例(2.0%)术后3 h 出现寒战高热,给予对症解热处理。其余无气胸、骨髓 抑制、大出血、胆汁漏、肠出血等严重并发症。
2.4125I粒子植入后粒子漂移情况
所有患者均顺利完成粒子植入,术中未发生重要脏器如危及血管及气管损伤等严重并发症。51例患者均经125I全身扫描、CT检查、SPECT-CT检查进行比较。全身扫描可显示不同形态放射性分布,但不能确认粒子所在解剖位置,未明显发现粒子漂移;CT图像显示,CT检出粒子漂移数目25粒,其中5粒为误判。SPECT-CT融合图像显示致密金属高密度影的周围存在放射性环绕,共计发现20粒漂移粒子,肝脏内者17粒,位于肝门区1粒,位于右侧肋间隙1粒,左侧肝包膜下1粒。由图2可见该位45岁女性患者的局部SPECT-CT显示粒子游离至肝左叶及肝右后叶下段。

图2 肝癌合并门脉矢状部及横部交界处癌栓患者局部SPECT-CT 融合图像
3 讨论
对于伴有PVTT的HCC患者治疗指南规定是移植与治愈性切除的禁忌证,治疗方案有限[6-7];目前采取的治疗方案有单独使用TACE治疗HCC伴PVTT患者,生存期低,有报道称4.1个月[8]。TACE联合125I粒子植入治疗是治疗PVTT的HCC患者可行且有效的方法[5]。放射性125I粒子组织间近距离治疗是一种永久性粒子植入肿瘤内照射治疗方式,其原理是利用125I粒子辐射的射线对靶器官产生辐射,DNA分子链的单双链断裂,电离产生自由基,自由基与生物大分子作用杀伤肿瘤细胞,从而抑制肿瘤细胞生长,达到治疗肿瘤的作用,已经广泛应用于各种恶性肿瘤[9-10]。
临床常用的外照射治疗门脉癌栓往往因放射剂量限制而受到严格控制,与之不同的是,125I粒子持续低剂量照射,既能让靶区肿瘤组织获得较高有效吸收剂量,同时避免周围正常组织损伤,且不良反应较小,可取得良好的客观疗效。门脉癌栓内放入放射性125I粒子有以下优点:125I粒子持续低剂量发射γ射线,较长的周期,可导致肿瘤干细胞发生凋亡,同时可抑制内膜增生;125I粒子所产生的辐射在短距离内衰减,减少了对正常肝组织及邻近器官的损害;植入125I粒子产生的辐射不受呼吸运动的影响;④低剂量、持续辐射可改变肿瘤的免疫表型。
本研究肝内病变疾病控制率86.3%;PVTT客观反应率70.6%,与文献报道的[11]肝内病变疾病控制率86%、PVTT客观反应率78%相比,本研究显示TACE-125I的治疗疗效尚可。由此可见,TACE-125I手术对HCC门脉癌栓有较为显著的生存获益。此外,125I粒子植入后4周总胆红素水平上升,8周后未见明显下降,原因之一125I粒子治疗有可能影响了邻近门静脉的小胆管,导致胆红素上升,第8周胆红素未见明显下降有可能是因肿瘤本身破坏了胆管所致。
目前行125I粒子植入治疗PVTT最常采用的是经皮穿刺超声引导下125I粒子植入治疗术。超声引导下植入术优缺点:超声可以非常清晰地显示门静脉癌栓的位置以及与周围正常组织的分界;可清晰显示针道及种植的125I粒子;可单点穿刺,扇形排布穿刺道,减少出血;实时动态观察进针的位置、深度;即刻观察每一颗粒子的空间位置。但由于超声波无法穿透金属,产生声影,因粒子伪影干扰图像,造成图像模糊,从而无法准确辨别已植入粒子的门脉癌栓组织界限,导致某些部位漏种粒子而达不到应有的处方剂量,从而不能最大幅度的辐射肿瘤组织,达到抑制肿瘤的目的。CT引导下的优缺点:患者一周前行CT增强扫描,可非常清晰的显示门脉癌栓的病变范围,并通过胶片扫描法将图像传送到三维计划系统,行125I 粒子植入治疗计划,计划步骤包括勾画临床靶体积(CTV)、三维重建;通过治疗计划系统逆向计算肿瘤周边匹配剂量(matched peripheral dose,MPD)下所需粒子的数和粒子的活度。但实际操作中无法做到增强CT扫描下行125I粒子植入术,一般都是在CT平扫下进行,CT平扫时癌栓为低密度,但常与周边正常的组织分界欠清,且为非实时引导,需反复扫描,增加医患的X线辐射[12]。
对比两种检查的优缺点,当以超声为首选。患者在超声引导下行125I粒子植入术后一般采用CT增强扫描及再通过CT扫描图像进行术后验证,虽然快捷方便,但是有可能验证的剂量并不准确,因为术后X线、CT扫描通过高密度影判断标识粒子的位置是有难度的,而且较易出现人为标识错误,对那些发生漂移的粒子更难以发现。125I粒子释放的辐射是可被伽马相机探测到的,SPECT-CT可准确探测125I粒子周围放射性浓聚。
近期研究已证实SPECT-CT可准确探测125I粒子周围放射性浓聚并量化,有望作为粒子植入术后剂量验证的新方法[13]。石洪成等[14]也对20例前列腺癌患者在粒子植入后1~30 d内行全身扫描,再行粒子所在部位局部SPECT/CT检查,得出结论:结合全身扫描,SPECT/CT可以准确评价125I粒子的漂移。SPECT/CT优势在于克服了核医学平面重叠影像的不足,避免了CT成像因密度和形态相近所导致的误判,可指导CT扫描范围。
本研究采用超声引导下+粒子局部SPECT-CT融合图像的方法,不仅发挥超声的优势,同时也结合SPECT-CT的优点,将术后图像可视化,真实显示靶区及周围放射性核素浓聚范围,准确判别发生漂移粒子的位置,治疗冷区,尤其有望将SPECT-CT融合图像作为术后疗效评估的一种检测手段,也为病变区域提供可视化直观图像,避免病灶漏种粒子,为补种粒子也创造了机会,同时便于观察125I粒子术后是否存在漂移。
从收集病例的结果来看,CT检出粒子漂移数目较比SPECT-CT的多,原因是CT图像缺点:CT成像因密度和形态相近所导致的误判;血管钙化、高密度碘油、老年人盆腔内小的静脉石,肝脏内胆管结石、肾小结石等干扰,易与粒子混淆而导致误判。据文献报道[13-14],影响粒子游走事件发生的因素有肿瘤回缩挤压进入门静脉小分支所致,例如:肝门区肿瘤;直接注入静脉,斜针插入,植入后的水肿的发生等。从本结果来看,粒子游走多发生于肝脏,分析原因可能由于斜针带出或者静脉回流所致。
SPECT-CT融合显像[15-16]在粒子植入术后观察粒子分布有明显优势。SPECT-CT融合图像可以很好的解决全身扫描、CT扫描待解决的问题,一次扫描可以同时获得SPECT及CT图像。由于射线探测让剂量可视化,易于理解,同时容易寻找到移位粒子的大致范围。在此基础上行局部的SPECT-CT融合显像可以确定粒子解剖部位,获得粒子具体分布情况,同时体外探测射线,检测过程无需外加射线,对患者无损,因此降低检测对患者身体伤害,只需一位技术人员即可,放射性浓聚图像与CT图像自动融合,简单易行,通过后处理图像融合得出125I粒子在体内分布情况,总体上,CT检出的粒子漂移多于SPECT-CT,部分是误判导致,临床上采用SPECT-CT融合显像,取长补短,能提供更准确的影像诊断,从而为治疗评估发挥积极作用。总之,SPECT-CT图像既可以显示粒子的物理特征,又可以显示粒子的放射性分布,是判断粒子漂移的“眼睛”。有研究已证实SPECT-CT可准确探测125I粒子周围放射性浓聚并量化,有望作为粒子植入术后剂量验证的新方法[17-20]。
综上所述,TACE-125I 治疗HCC合并PVTT是安全且可行的,可有效改善患者的预后。SPECT-CT融合显像可准确评价125I粒子的漂移及具体情况,为粒子治疗肿瘤提供了重要信息,值得临床推广使用。

