利用生物信息技术分析iASPP与P53靶基因在肝癌中的临床意义
敖枫华 邱 杨 熊文敏 姚景亮 涂子为 叶新芊 李国庆 彭世义
肝细胞癌(hepatocellular carcinoma,HCC)是我国常见的恶性肿瘤之一,在肿瘤中死亡率居第三位[1],具有高发病率、高死亡率、恶性程度高等特点,属于难治性肿瘤,其发病机制不明,与病毒感染相关。目前,肝癌的主要的治疗方法有手术、肝介入栓塞化疗及全身化疗。对于早期的患者手术切除结合其他辅助治疗能显著延长生存;但由于我国肿瘤普查的欠缺,大部分肝癌患者确诊时为晚期,化疗效果差,生存期短,预后极差。近年来,虽然以索拉非尼为代表的靶向治疗开辟了肝癌治疗的新思路,但是临床试验证明索拉非尼对肝癌切除或消融后的辅助治疗不是有效的干预措施,无法改变治疗现状[2]。因此,探究肝癌的发病机制,发现新的靶点,开发新的药物对改善肝癌患者的预后尤为重要。
基因芯片技术是近年来的热门话题,随着人类基因组计划的进展,基因序列数据已经逐步向科研与临床方向推进,该技术将大量的探针固定于支持物上并与标记的样本进行杂交,通过检测每个探针的杂交信号强度来获得序列信息。本研究搜集了肝细胞癌测序与临床数据信息,探究其预后基因,研究是否可开发基因治疗药物。
P53凋亡刺激蛋白抑制剂(inhibitor of apoptosis stimulating protein of p53,iAPSS),也被称作PPP1R13L,属于ASPP家族。ASPP家族包括Aspp1、Aspp2和iASPP,它们能相互竞争与P53结合,调控P53家族蛋白的功能[3-4]。Aspp1、Aspp2属于P53家族蛋白的刺激因子,可以与P53、P63等结合,增强其促细胞凋亡作用,属于抑癌基因;而iASPP与P53结合,抑制P53的功能,其过度表达抑制DNA损伤后P53家族蛋白启动的细胞凋亡,从而导致肿瘤的发生和发展,属于癌基因[4-6]。由于不同组织中ASPP家族蛋白表达的差异,P53的纯合性并不代表对肿瘤发生的抵抗性,只有结合ASPP蛋白家族才能明确P53表达与肿瘤发生的关系[7]。
关于对iASPP与P53蛋白相互作用的结构研究发现,iASPP优先结合P53脯氨酸富集区域,P53脯氨酸富集区域是P53与DNA序列结合调控靶基因翻译转录的结构。iASPP与P53脯氨酸富集区域结合,参与P53对下游基因转录调控的作用[8]。最近有研究报道,iASPP参与P53转录调控的靶基因包括:AEN、FAS、FHL2、PMAIP1、AEN、FAS、FHL2、PMAIP1、RPS27L、ZMAT3、ACTA2、HES2、SLC30A1、BAX、BBC3、DRAM1和MDM2[9]。然而iASPP过表达对于P53靶基因的影响却鲜少报道,P53靶基因对iASPP参与肿瘤预后的作用并不清楚。
本文联合利用Oncomine、TCGA、Human Protein Atlas数据库评估iASPP在肝癌中的表达及其与肝癌患者预后的关系,并探索iASPP的高表达是否影响P53靶基因的表达。通过数据库分析P53靶基因的表达对预后的影响。
1 材料与方法
1.1 Oncomine数据库分析
将iASPP基因在不同类型癌症中的表达水平在Oncomine数据库(https://www.Oncomine.org)中进行了鉴定,根据P值为0.001,倍数变化为1.5,基因排序确定阈值。
1.2 TCGA数据库分析
进入TCGA主页(http://cancergenome.nih.gov/)下载HCC癌组织芯片信息,获取临床样本信息及RNA-seq数据,将部分数据不完整的患者筛除,共筛选出293例患者信息。
1.3 STRING数据库分析
进入STRING网站(https://string-db.org/),构建iASPP与研究的P53靶基因的网络图,挖掘相关基因调控网路,探索网路构成与肝癌发生发展的关系。
1.4 统计分析
在Oncomine中生成的正常肝组织患者和肝癌患者列组及2组之间生存信息差异的P值。使用SPSS 13.0统计学软件对数据进行处理。生存分析利用Kaplan-meier分析方法,2组之间表达水平的差异用独立样本的t检验。P<0.05为差异有统计学意义。
2 结果
2.1 iASPP基因在肝组织中的表达水平
使用Oncomine数据库分析了HCC肿瘤和正常肝组织中的iASPP mRNA水平,结果表明,与正常组织相比,肝癌组织中iASPP表达更高(P=0.001)(图1)。

图1 iASPP基因在肝组织中的表达情况
2.2 iASPP对HCC预后的影响
根据患者iASPP表达量中位数,将患者分为iASPP高表达组(n=147)和低表达组(n=146),使用Kaplan-Meier分析这2组患者的预后差异,结果显示iASPP高表达组预后较差(OS:P=0.042;PFS:P=0.175)(图2)。

图2 Kaplan-Meier生存曲线分析iASPP高表达组和低表达组肝癌患者的预后
2.3 iASPP蛋白对P53家族蛋白的调控功能
在STRING网站上构建iASPP的蛋白相互作用网络图,可以看到iASPP蛋白可以调控P53蛋白的功能,与iASPP直接相关的蛋白有FHL2、MDM,在后续研究中可以重点关注(图3)。

图3 iASPP蛋白相互作用分析网络
2.4 iASPP的表达水平对HCC患者P53靶基因表达的影响
我们运用t检验比较iASPP高表达组和低表达组中P53靶基因表达水平的差异(图4),发现iASPP高表达组PMAIP1(图4A)(P=0.021)、RAP2B(图4B)(P=0.001)、BBC3(图4C)(P=0.001)、HES2(图4D)(P=0.006)水平显著高于iASPP低表达组,而2组ACTA2(图4E)、BAX(图4F)、CDKN1A(图4G)、FHL2(图4H)、MDM2(图4I)、RPS27L(图4J)、DRAM1(图4K)、TIGAR(图4L)水平无显著差异。

图4 iASPP高表达组和低表达组P53靶基因的表达差异
2.5 P53靶基因的表达量与预后的关系
为了进一步探索有显著差异的靶基因表达量与HCC总体生存是否相关,我们利用Human Protein Atlas数据库分析了PMAIP1、RAP2B、BBC3、HES2表达量与肝癌的生存的关系(图5),发现PMAIP1(P=0.0020)、RAP2B(P=0.00016)、HES2(P=0.00026)高表达患者整体生存较低表达患者差,而BBC3(P=0.14)表达与整体生存关系不显著。这与我们前面的结果一致,iAPSS高表达患者组PMAIP1、RAP2B和HES2水平显著升高,且预后较差。
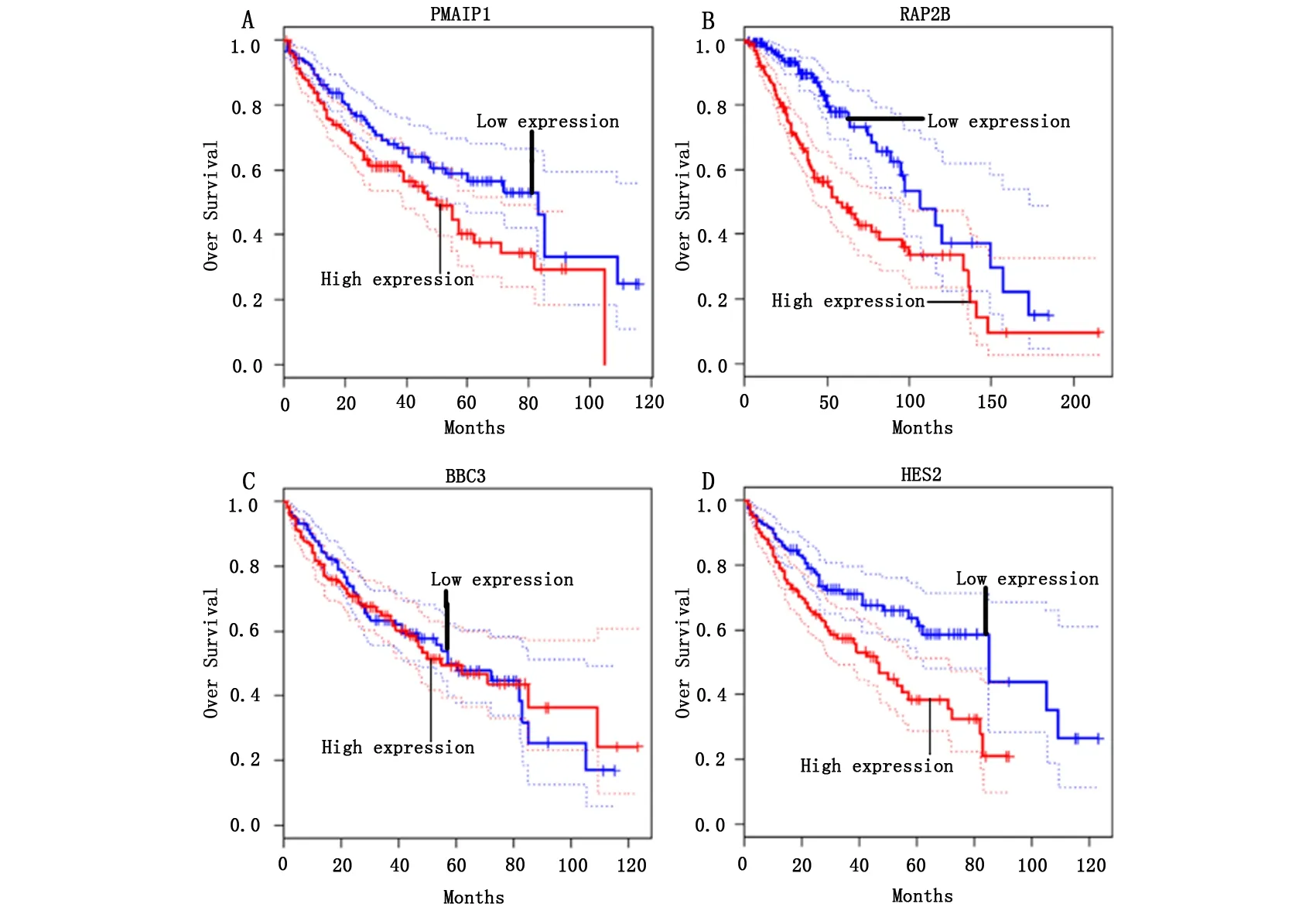
图5 P53靶基因的表达量与HCC患者总生存率的关系
3 讨论
在本研究中,我们利用生物信息学分析了肝癌患者iASPP的表达与预后的关系,并且结合P53作为转录因子作用,分析iASPP对P53靶基因表达的影响,及P53靶基因对肝癌患者生存的意义,深入挖掘iASPP参与肝癌患者预后作用的机制。
越来越多的研究发现肿瘤下调P53通路不限于P53基因的突变,还能通过iASPP表达升高抑制P53功能及信号通路,促进肿瘤的发生。最近的研究也报道了iASPP在许多肿瘤中的异常表达,包括膀胱癌[10],非小细胞肺癌[11],卵巢透明细胞癌[12],大肠癌[13],特别是在P53突变相对罕见的急性白血病[14-15]。同这些研究的结果相似,我们的研究也发现iASPP在肝癌表达升高,并且高表达的患者整体生存更差。
作为P53的调节因子,iASPP间接影响P53下游基因的表达,促进癌基因表达并抑制抑癌基因的表达。
本研究发现,iASPP高表达组患者较iASPP低表达组患者PMAIP1、RAP2B、BBC3、HES2显著升高。PMAIP1本身并不是癌基因,主要作用是对抗DNA损伤后p53介导的凋亡[16],RAP2B在研究中被证明影响肿瘤的黏附和增殖[17],BBC3是一个控制凋亡的效应子,HES2则在发育过程中起到了多效性作用。利用Human Protein Atlas数据库分析,发现RAP2B、RAP2B、HES2的高表达影响肝癌预后。这与iASPP高表达患者预后较差的结果相一致,表明高水平的iASPP可以通过结合P53,调控P53靶基因的表达,从而促进肿瘤增殖,影响患者生存。
总之,根据TCGA、Human Protein Atlas和Oncomine数据库的生物信息学分析,我们明确了iASPP的高表达影响肝癌预后,且iASPP高表达对P53靶基因的影响可能是其导致HCC预后不良的机制。这一发现有助于我们进一步了解P53通路对影响肝癌发生的机制,为进一步研究该病的治疗及预后提供了指导。在肝癌患者中,iASPP与P53靶基因的相互作用,以及其信号通路仍有待基础研究的验证。

