TAZmRNA在非小细胞肺癌组织中的表达及其临床意义
周建宏 张艳丽 张利斌



[摘要] 目的 探討TAZ(Transcriptional coactivator with PDZ-binding- motif)mRNA在非小细胞肺癌(NSCLC)组织中的表达及其临床意义。方法 选择2010年6月至2013年1月在云南省第一人民医院胸外科手术切除的62例经病理确诊的非小细胞肺癌组织为研究组,选择癌旁组织(距癌组织>5 cm)和21例肺良性肿瘤组织为对照组,采用实时荧光定量PCR法检测TAZmRNA表达量。 结果 ①实时荧光定量PCR法检测到TAZ mRNA的表达量在非小细胞肺癌组织高于癌旁/肺良性肿瘤组织,差异有统计学意义(P=0.027/0.016<0.05)。②非小细胞肺癌患者癌组织中TAZmRNA表达量在肿瘤大小、分化程度和p-TNM分期中差异有统计学意义(P=0.007/0.000/0.024<0.05)。结论 TAZ可能参与非小细胞肺癌的发生、发展;可作为NSCLC预后及转移的评价指标、提供非小细胞肺癌治疗的靶点。
[关键词] 非小细胞肺癌;mRNA;转录共激活因子;实时荧光定量PCR
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2021)36-0005-04
The expression and clinical significance of TAZmRNA in non-small cell lung cancer tissues
ZHOU Jianhong1 ZHANG Yanli2 ZHANG Libin3
1.Department of Thoracic and Cardiovascular Surgery,the People's Hospital of Chuxiong Yi Autonomous Prefecture in Yunnan Province,Chuxiong 675000,China;2.The First Department of Anesthesia,the People's Hospital of Chuxiong Yi Autonomous Prefecture in Yunnan Province,Chuxiong 675000,China; 3.Department of Thoracic Surgery, the First People's Hospital of Yunnan Province, Kunming 650032, China
[Abstract] Objective To investigate the expression and clinical significance of TAZ (Transcriptional coactivator with PDZ-binding-motif) mRNA in non-small cell lung cancer (NSCLC) tissues. Methods A total of 62 pathologically confirmed non-small cell lung cancer tissues previously resected at the Department of Thoracic Surgery of the First People's Hospital of Yunnan Province from June 2010 to January 2013 were selected as the study group. The tissues adjacent to cancer (more than 5 cm from the cancer tissue) and 21 benign lung tumor tissues were selected as the control group. The expression of TAZ mRNA was detected by real-time quantitative PCR. Results ①The expression level of TAZ mRNA in the non-small cell lung cancer tissues was higher than that in paracancerous/benign lung tumors by real-time fluorescent quantitative PCR, and the difference was statistically significant (P=0.027/0.016<0.05).②The expression of TAZ mRNA in non-small cell lung cancer tissues was significantly correlated with tumor size, differentiation, and p-TNM stage(P=0.007/0.000/0.024<0.05). Conclusion TAZ may be involved in the occurrence and development of non-small cell lung cancer. It may be used as a prognostic and metastatic evaluation index of NSCLC and provide a therapeutic target for lung cancer.
[Key words] Lung cancer; mRNA; Transcriptional coactivator; Real-time quantitative PCR
目前肺癌是全世界发病率和死亡率最高的肿瘤[1-2],其中约85%患者为非小细胞肺癌[3],早期肺癌的治疗效果已经突显,而对于晚期及进展期肺癌的治疗仍然是难题及研究重点。转移是癌细胞从原发肿瘤扩散到不同器官,是癌症相关死亡的主要原因,对转移相关的靶向治疗有望成为提高肿瘤患者生存率的有效策略;而转移是一个复杂的过程,包括不同的步骤,癌细胞需要在每个步骤中获得不同的能力,并受到多种细胞信号通路的调控[4]。TAZ/WWTR1(Transcriptional coactivator with PDZ-binding motif/WW-domain containing transcription regulator 1 WWTR1)即具有PDZ结合域的转录共刺激因子,是一种转录辅激活物,参与体内细胞增殖、凋亡调控及多种器官的发育。研究发现,TAZ在多种肿瘤中表达升高,作为致癌因子参与肿瘤的发生、发展[5]。本研究选择62例经病理确诊的非小细胞肺癌(NSCLC)组织为研究组,选择癌旁组织(距肿瘤边缘>5 cm)和21例肺良性肿瘤组织为对照组,采用实时荧光定量PCR法检测TAZmRNA表达,并探讨其临床意义,现报道如下。
1 资料与方法
1.1 一般资料
收集2010年6月至2013年1月在云南省第一人民医院胸外科手术切除的NSCLC患者62例(所有标本采集均在离体后2 min内完成,标本在液氮及-70℃冷藏备用),患者均资料完整且经手术病理确诊,术前未接受放、化疗,其中男43例,女19例,平均年龄(58±10)岁。对照组采用同一患者的癌旁组织(距肿瘤边缘>5 cm)和21例肺良性肿瘤组织(标本采集同研究组)。
1.2 主要试剂
总RNA提取试剂盒(Tiangen),qRT-PCR的M-MLV第一链合成系统(invitrogen),引物管家基因β-actin及目的基因TAZ、SYBR Premix EX TaqTMⅡ(TaKaRa)。
1.3 方法
Tiangen总RNA提取试剂盒提取组织总RNA。Gene quactⅡ比色仪测定总RNA浓度,制备1.2%的琼脂糖凝胶(0.5 μg/mL溴化乙锭染色),取l μL总RNA,加入8 μL DEPC H2O及1 μL 10倍上样缓冲液,上样60 V电泳40 min,检测总RNA完整性。qRT-PCR的M-MLV第一链合成系统试剂盒逆转录合成第一链体系。实时荧光定量PCR引物为TAZ序列F5′ CTTGGATGTAGCCATGACCTT3′R5′TCAATCAAAACCAG-GCAATG3′,β-actin序列F5′ CGGGAAATCGTGCGT-GAC3′R5′CAGGAAGGAAGGCTGGAAG3′;2×qPCR Mix 5 μL,2 pmolTAZ/β-actinF 1 μL,2 pmolTAZ/β-actin R 1 μL,模板cDNA 2 μL,dH2O1 μL共10 μL体系;95℃变性10 s,62℃退火延伸40 s,扩增共40个循环。2%的琼脂糖凝胶电泳及扩增溶解曲线鉴定实时荧光定量PCR产物、并用△CT進行定量分析。
1.4 统计学方法
采用SPSS 20.0统计学软件进行数据处理,计量资料以(x±s)表示,采用t检验及单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR结果
总RNA的A260/A280检测值均在1.74~1.98之间,提示总RNA纯度好;琼脂糖凝胶电泳可见28 S和18 S条带明亮、边缘清晰且亮度比值接近2∶1,提示总RNA质量高(图1)。PCR产物琼脂糖凝胶电泳显示,β-actin及TAZ扩增产物片段大小与设计相符并且为特异性扩增(图2)。溶解曲线显示单高峰特异性扩增(封三图1~2)。
2.2 NSCLC患者癌组织、癌旁组织中TAZmRNA表达结果
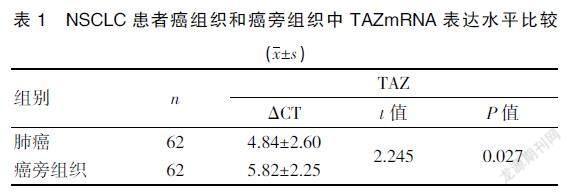
NSCLC患者癌组织、癌旁组织中TAZ mRNA平均ΔCT值分别为(4.84±2.60)和(5.82±2.25),癌组织TAZ mRNA表达量高于癌旁组织,差异有统计学意义(P<0.05)。见表1。
2.3 NSCLC患者癌组织、肺良性肿瘤组织中TAZmRNA表达结果
NSCLC患者癌组织、肺良性肿瘤组织TAZ平均ΔCT值分别为(4.84±2.60)和(6.35±1.87),癌组织TAZ mRNA表达量高于肺良性肿瘤组织,差异有统计学意义(P<0.05)。见表2。
2.4 NSCLC患者癌组织TAZmRNA表达与临床因素的关系
NSCLC组织中TAZmRNA表达量在肿瘤组织大小、分化程度及p-TNM分期比较,差异有统计学意义(P<0.05);而患者的性别、年龄、吸烟史、病理类型及淋巴结转移比较,差异无统计学意义(P>0.05)。见表3。
3 讨论
肿瘤的发生和癌症的发展是由于个体对组织器官中细胞的限定失效导致的,是包括细胞增殖能力增强、细胞凋亡被抑制等多种过程联合作用的结果。正常生理状态下,TAZmRNA在几乎(除胸腺和外周血细胞)所有组织和器官中均有表达,其中肾脏、心脏、胎盘和肺脏中表达量较高[5]。研究发现,YAP/TAZ参与肺再生[6]。TAZ作为一种转录辅激活物,参与体内细胞增殖、凋亡调控和多种器官的发育,其包含一个保守的WW结构域、14-3-3结合位点及C-末端的PDZ结合基序,通过第89位丝氨酸残基磷酸化与细胞质中的14-3-3蛋白结合,去磷酸化后具有转录共激活因子的活性易位于细胞核中[7],肿瘤的发生、演变过程是多因素、多通路、多阶段的复杂过程,其发生是细胞的增殖与分化失常所导致的恶性生长现象[8]。尽管存在这些复杂性,有些肿瘤的形成和存活还是倾向于被某一特定的癌基因所驱动[9]。TAZ和YAP在正常组织发育和稳态中发挥着独特的重要作用[10]。然而大量研究表明,YAP/TAZ在大多数实体肿瘤中是致癌转录因子,在肺癌、结直肠癌、乳腺癌、肝癌、胃癌、胰腺癌、前列腺癌、子宫内膜癌、食管癌、膀胱癌和卵巢癌等多种癌症中,YAP/TAZ在癌细胞中的高表达和(或)细胞核定位与不良临床预后相关[11]。本研究发现,TAZmRNA在非小细胞肺癌(NSCLC)组织中的表达量高于癌旁及肺良性肿瘤组织,与文献报道相符合。研究也发现,YAP/TAZ调控基因表达的特征与肺癌和乳腺癌的不良预后相关[12]。研究还发现,TAZ/YAP在小鼠肺癌模型中异位表达促进肿瘤的形成和进展[13]。在细胞水平上YAP/TAZ参与肿瘤进展所需的多种功能,YAP/TAZ通过上调大量参与细胞周期控制的基因如CCND1、CDK1、CDC25和MCMs,促进细胞增殖[14]。YAP/TAZ还能促进各种癌细胞的锚定非依赖生长并参与调节细胞迁移、侵袭、存活和上皮间质转化[15]。
基于以上的TAZ研究背景,本研究通过RT-qPCR法检测非小细胞肺癌(NSCLC)组织TAZmRNA的表达量,结果显示癌组织中的表达量远高于癌旁组织及肺良性肿瘤组织,差异有统计学意义(P<0.05)。非小细胞肺癌患者癌组织中TAZmRNA的表达量在其肿瘤大小、分化程度和p-TNM分期中差异有统计学意义(P<0.05)。与文献描述的TAZ参与肿瘤的转移及预后不良是相互吻合的。但本研究发现其表达量在淋巴结转移中差异无统计学意义,可能因肿瘤发生、演变过程是多因素、多通路、多阶段的复杂过程,或者与淋巴结转移的样本量少等相关,可为今后继续研究提供一些思路。
综上所述,TAZ可能参与非小细胞肺癌(NSCLC)的發生、发展;可作为NSCLC预后评价指标;并可能成为预测转移的指标、提供肺癌治疗靶点。
[参考文献]
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics 2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[3] Herbst RS,Morgensztern D,Boshoff C.The biology and management of non-small cell lung cancer[J].Nature,2018,553(7689):446-454.
[4] Valastyan S,Weinberg RA.Tumor metastasis:Molecular insights and evolving paradigms[J].Cell,2011,147(2):275-292.
[5] Kanai F,Marignani PA,Sarbassova D,et al.TAZ:A novel transcriptional co-activator regulated by interactions with 14-3-3 and PDZ domain proteins[J].EMBO J,2000,19(24):6778-6791.
[6] LaCanna R,Liccardo D,Zhang P,et al.Yap/Taz Regulate alveolar regeneration and resolution of lung inflammation[J].J Clin Invest,2019,129(5):2107-2122.
[7] Hong JH,Hwang ES,McManus MT,et al.TAZ,A transcriptional modulator of mesenchymal stem cell differentiation[J].Science,2005,309(5737):1074-1078.
[8] Croce CM.Oncogenes and cancer[J].N Engl J Med,2008, 358(5):502-511.
[9] Weinstein IB.Cancer.Addiction to oncogenes-the Achilles heal of cancer[J]. Science (New York,N.Y.),2002,297(5578):63-64.
[10] Reggiani F,Gobbi G,Ciarrocchi A,et al.YAP and TAZ are not identical twins[J]. Trends in Biochem Sci,2021,2(46):154-168.
[11] Lo Sardo F,Strano S,Blandino G.YAP and TAZ in lung cancer: Oncogenic role and clinical targeting[J].Cancers,2018,10(5):137.
[12] Noguchi S,Saito A,Horie M,et al.An integrative analysis of the tumorigenic role of TAZ in human non-small cell lung cancer[J].Clin Cancer Res,2014,20(17):4660-4672.
[13] Zhang W,Gao Y,Li F,et al.YAP promotes malignant progression of Lkb1-defificient lung adenocarcinoma through downstream regulation of survivin[J].Cancer Res,2015, 75(21):4450-4457.
[14] Kim W,Cho YS,Wang X,et al.Hippo signaling is intrinsically regulated during cell cycle progression by APC/CCdh1[J]. Proc Natl Acad Sci USA,2019,116(19):9423-9432.
[15] Lau AN,Curtis SJ,Fillmore CM,et al.Tumor-propagating cells and Yap/Taz activity contribute to lung tumor progression and metastasis[J].EMBO J,2014,33(5):468-481.
(收稿日期:2021-08-18)

