菊芋根系分泌物改良滨海盐土的微生物机制
杨 敏, 李 帅, 曹慧翔, 黄 婷, 李 媛, 谢军伟, 赵耕毛
(南京农业大学 资源与环境科学学院/江苏省海洋生物学重点实验室, 江苏 南京 210095)
在过去几十年里,土壤盐碱化导致全球主要粮食作物减产超过50%[1-3]。据预测,到2050年,地球上1/2的可耕地将受到土壤盐碱化的影响[4]。江苏滩涂面积76.7万hm2,占全国总面积的1/7,滩涂的开发和利用对江苏乃至中国都具有重大意义[5-7]。因此,合理开发利用与有效改良盐碱地,增加作物种植面积是我国农业可持续发展的重中之重,是解决粮食供需矛盾的根本途径之一。
盐碱地改良主要包括水利、物理、化学和生物等措施[8-9]。种植耐盐植物,是一项行之有效的盐土生态改良方法,而且还可以获得一定的经济效益[10]。植物根系作为联系地上和地下生态系统的主要媒介,能够感应外界胁迫,并通过产生不同的分泌物进行自身调节。根系分泌物为微生物提供重要的营养和能量物质,其成分和数量影响根际微生物的种类和繁殖;根际微生物的代谢作用,直接促进根的营养吸收和生长,也影响着根际土壤中的物质转化[11]。甜菜、玉米、大豆的根系分泌物中氨基酸、有机酸等成分使作物土壤微生物数量、微生物量碳氮、土壤酶活性均显著增加,且不同植物分泌物含量不同,微生物活性也存在一定的差异[12]。在抗盐碱牧草星星草的根系分泌物中含有有机酸,星星草通过根系分泌物中有机酸的作用,调节了外部土壤环境的pH值,以此来适应环境的变化[13]。在小麦的生长发育过程中,根系分泌物的增加,为根际土壤中反硝化细菌的发育创造了良好的生态环境,使根际环境中反硝化细菌数明显增加;同时根系分泌物还能刺激反硝化细菌的代谢活动[14]。研究显示,根系分泌物在抑制病原菌的生长方面也具有重要的作用,如番茄根系分泌物中咖啡酸增强了生物炭对青枯菌的吸附,抑制了青枯菌的泳动能力,减少了青枯菌数量,降低了发病率[15]。菊芋作为广受学界关注的耐盐植物,近年来它的生态功能及其应用价值突显了出来,主要表现在生态适应性强,耐贫瘠,耐寒,耐旱,耐盐碱,抗风沙能力强,其作为能源植物应用潜力巨大[16]。在莱州湾滨海盐碱地进行“南芋1号”连作种植试验,连作5 a后,土壤有机质含量呈增加态势,全盐含量下降,还原糖与纤维素含量达到最大值,表明种植菊芋在盐碱地改良方面具有重要的作用[17]。但是,随着连作年限的增长,土壤性质有所下降,盐碱地改良效果不佳。目前关于菊芋改良盐碱地的研究多集中在其生物量和生理特性等方面[18-19],鲜有人对菊芋改良盐碱地的生物机制进行研究。为此,本研究通过菊芋种植与原生植物碱蓬对比,试图通过研究菊芋根系分泌物,阐明植物与土壤微生物的关系,揭示菊芋根系分泌物介导的盐土改良的生态学机制,为盐土改良与生境改良提供理论依据。
1 材料与方法
1.1 样品采集及及保存
试验地点为南京农业大学大丰滩涂农牧化试验与成果转化基地,位于江苏省盐城市大丰区大丰港王港新闸附近(120°45′E,33°19′N)。该地区四季分明,气温适中,雨量充沛,年平均气温为14.1 ℃,无霜期213 d,常年降水量1 042.2 mm,日照2 238.9 h。研究区土壤类型为滨海盐土。供试土壤基本理化性质详见表1。
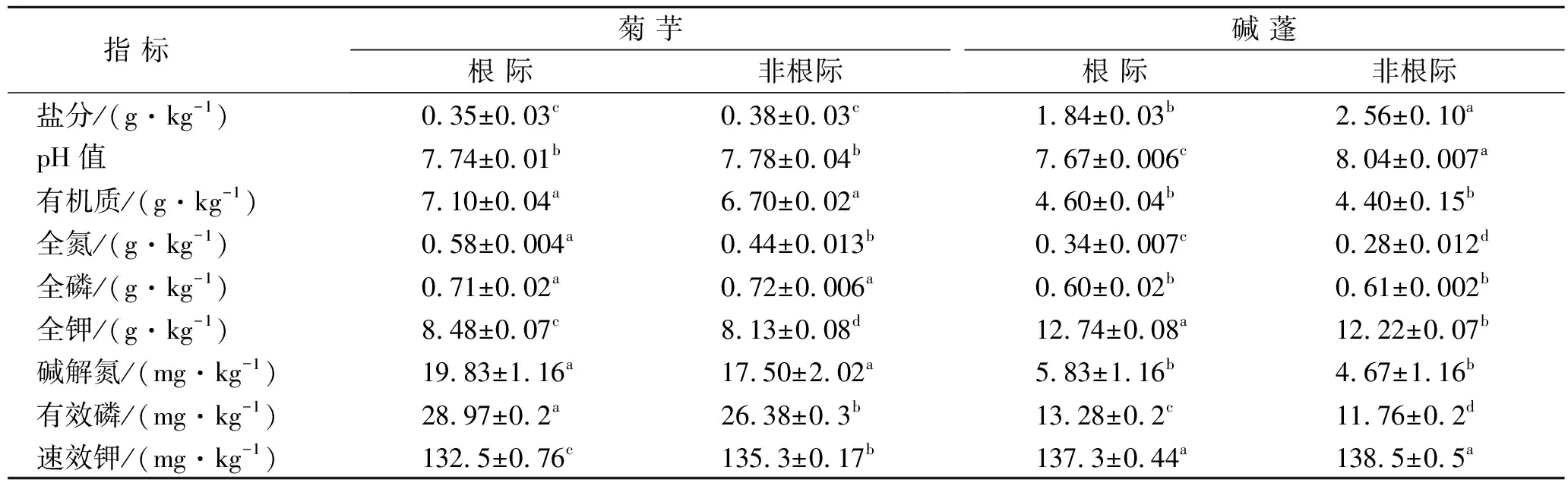
表1 供试土壤基本理化性质
2019年10月,以菊芋和碱蓬为采样对象,二者生长时间相同,均在10月下旬收获,初始菊芋种植样地与碱蓬原生样地一致。野外试验样地设置3个重复,每个处理样地面积60 m2(10 m×6 m),长方形样地上S形5个点上随机取样。去除表层土,收集距离根1—2 mm的土壤和根表面及其黏附的土壤作为根际土,距离根1—5 cm的土壤作为非根际土[20-21]。将5个样本的根际土和非根际土各自混匀后,采用四分法取1~2 kg土样,去除杂质。一部分土壤样品置于-80 ℃冷冻保存,用于随后的脱氧核糖核酸提取和分析。剩余土壤样品放置阴凉处风干后,分别过1和0.25 mm筛,用于土壤理化性质分析。
1.2 根系分泌物的组成成分的测定
(1) 土壤中单糖及低聚果糖。按照Zheng等[22]的方法配置单糖和低聚果糖的标准储备液,然后用60%乙腈逐级稀释,配成标准品浓度为2,1,0.5,0.25,0.1,0.01 mg/L的混合标准溶液,于4 ℃冰箱贮存,备用。
称取5 g样品(精确至0.01 g)置于50 ml离心管中,分别加入水20 ml,涡旋混匀,超声提取40 min后,得到浸提液。准确移取浸提液5 ml于10 ml容量瓶中,用60%乙腈定容,涡旋混匀后,5 000 rpm转速离心10 min,吸取上清液过0.2 μm的滤膜,供液相色谱串联质谱仪分析[23]。
(2) 土壤中烷烃、烯烃、芳烃、酯、醇、酮、醛、有机酸等。利用乙酸乙酯(比例1∶10)对土样进行浸提,所得提取液过滤,经旋转蒸发仪浓缩,过0.22 μm滤膜后,GC-MS测定分析,色谱和质谱分析条件参考Wang等[24]的方法。
1.3 土壤微生物的测定
采用稀释平板法计数测定土壤中微生物的数量[25]。土壤微生物量碳氮的测定参考Brookes等[26]的方法。土壤微生物多样性的分析,首先称取0.3 g土进行基因组DNA抽提,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。利用引物338 F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806 R(5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增,采用20 μL扩增体系,PCR反应退火温度55 ℃。
PCR产物用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,构建Miseq文库。Miseq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析。基于OTU及其聚类分析结果,可以对OTU进行多种多样性指数以及群落结构的进行统计分析。
1.4 土壤酶活性测定
使用北京索莱宝科技有限公司的土壤过氧化氢酶(Soil-catalase,S-CAT)、土壤脲酶(soil-urease,S-UE)、土壤蔗糖酶(soil-sucrase,S-SC)、土壤碱性磷酸酶(soil alkaline phosphatase,S-AKP/ALP)试剂盒测定土壤酶的活性。
1.5 数据统计分析
试验数据使用SPSS 22及Agilent Mass Hunter Quantitative Analysis软件进行处理、统计,以平均值(Mean)表示,采用Duncan新复极差法进行显著性分析,最终描述性统计值使用平均值±标准差。并利用Microsoft Excel 2010,Origin 2020,Qiime 1.9.1软件等软件进行分析作图。
2 结果与分析
2.1 菊芋根系分泌物的组成
试验确定果糖(FRU)、葡萄糖(GLU)、蔗糖(SUC)、蔗果三糖(DP3)、蔗果四糖(DP4)和蔗果五糖(DP5)的分子量分别为178.9,178.8,341.0,503.4,665.3和827.3 m/z,以该分子离子峰为母离子,对其子离子进行全扫描,获得二级质谱响应较强的子离子(图1)。
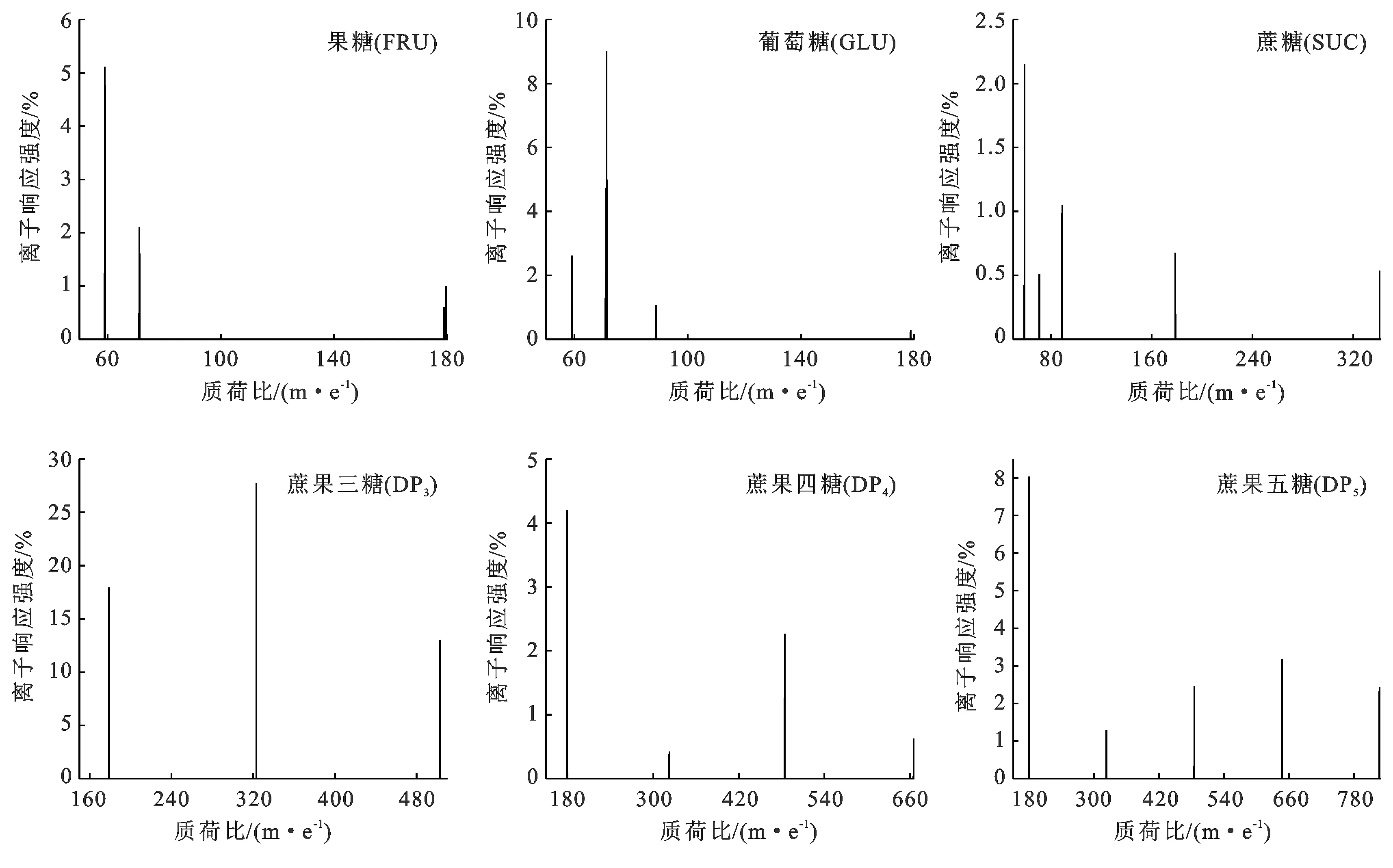
图1 FRU,GLU,SUC,DP3,DP4,DP5标准品的二级扫描质谱图
对每种糖的二级质谱参数如碎裂电压和碰撞能量等进行优化,使每种糖的定性和定量离子产生的离子对强度比例达到最大值时为最佳,得到FRU,GLU,SUC,DP3,DP4和DP5的质谱参数(表2)。

表2 果糖、葡萄糖、蔗糖、聚合度3~5的菊糖的质谱参数
不同糖类的碎裂电压和碰撞能量不同,离子响应强度存在差异,一般碎裂离子稳定好,离子响应强度也会比较高。通过与标品中定性离子进行对比,结果发现FRU,GLU,SUC,DP3,DP4,DP5的碎片离子在菊芋根际土壤中均存在,菊芋非根际和碱蓬土壤中仅含有FRU,GLU和SUC的碎片离子(图2)。因此,在菊芋根际土壤中存在果糖、葡萄糖、蔗糖以及低聚果糖,但是在菊芋非根际和碱蓬土壤中仅存在果糖、葡萄糖和蔗糖,并没有低聚果糖。

图2 菊芋根际、菊芋非根际、碱蓬根际、碱蓬非根际的二级扫描质谱图
土壤中DP3—5的含量低于0.01 mg/L,此时仪器不能自动积分,手动积分获得的峰面积误差较大,本试验选取含量大于0.01 mg/L的FRU,GLU及SUC进行定量。以峰面积为横坐标,浓度为纵坐标,进行线性回归,得回归方程(表3)。

表3 FRU,GLU和SUC峰面积和浓度的线性回归方程及相关系数
结果显示,菊芋土壤中的FRU,GLU和SUC含量分别为2.343,4.235和2.67 mg/kg,均显著高于碱蓬土壤中的含量,且菊芋根际中的糖含量显著高于非根际(p<0.05)(表4)。其中,以FRU含量的变化最明显,菊芋根际土壤中的FRU含量高达2.163 mg/kg,约为非根际中FRU含量的12倍;在碱蓬土壤中,根际和非根际的FRU含量也存在显著性差异(p<0.05)非根际中FRU含量为根际的2.15倍。

表4 菊芋和碱蓬根际和非根际土壤中FRU,GLU和SUC的含量 mg/kg
菊芋根系分泌物除了含有各种糖类,还有一些小分子、易挥发的化合物,这些物质在菊芋、碱蓬土壤中分布不均,菊芋根际土壤相较于碱蓬土壤,分泌物较多,有32种,包括醇(6种)、酚(1种)、醛(3种)、酮(2种)、酸(2种)、烃(11种)、酰胺(2种)、酯(5种),菊芋非根际土壤中有25种,碱蓬根际有8种,非根际有17种(表5)。菊芋土壤中特有的分泌物有23种,分别为1-氯—十八烷、正十六烷酸、2-甲基-Z-4-十四碳烯、十二酮、(Z)-9-十八碳酰胺、苯丙酸十六烷基酯等;菊芋和碱蓬共有的有6种,包括1-庚四醇、1,54-二溴四环十二烷、五氟丙酸四三烷基酯等。除9,9-二甲氧基双环[3.3.1]壬烷-2,4-二酮外,碱蓬根系分泌物在菊芋土壤中均存在,无特有的根系分泌物。

表5 菊芋和碱蓬土壤中根系分泌物的种类变化
2.2 根系分泌物对土壤微生物生物量的影响
菊芋土壤的微生物量碳、氮明显高于碱蓬土壤,其值分别是碱蓬土壤的1.95和1.6倍,且菊芋根际的微生物量碳、氮约为非根际的1.69和1.50倍(表6)。菊芋根际土壤的微生物量碳氮比约为碱蓬土壤的1.11倍,但是并无显著性差异。

表6 土壤微生物生物量碳氮和碳氮比
2.3 根系分泌物对土壤微生物数量的影响
菊芋土壤中微生物数量均显著高于碱蓬(p<0.05),约为碱蓬土壤的102~103倍,其中以土壤细菌数量占优势(表7)。在菊芋根际土壤中细菌、真菌、放线菌数量显著高于非根际(p<0.05),其数量约为非根际的1.13和2.24倍。

表7 菊芋和碱蓬根际土壤中的微生物数量
2.4 根系分泌物对土壤微生物群落结构的影响
菊芋和碱蓬根际土壤的微生物组成相似,相对丰度前10的优势种群分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、Patescibacteria等,但是每种菌群的分布存在差异,在菊芋土壤中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)丰富度明显高于碱蓬,所占比重达90%(图3)。在这4个优势种群中,菊芋土壤中的放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)的相对丰度显著高于碱蓬(p<0.05),变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)无显著性差异(表8)。在菊芋土壤中存在一些特有的物种,包括硝棘菌门(Nitrospinae)、盐厌氧菌门(Halanaerobiaeota)、柔膜菌门(Tenericutes)、达达菌门(Dadabacteria)、螺旋体门(Spirochaetes)(图4)。

图4 门水平下的物种Heatmap图

表8 菊芋和碱蓬土壤中优势功能菌群的差异显著性分析
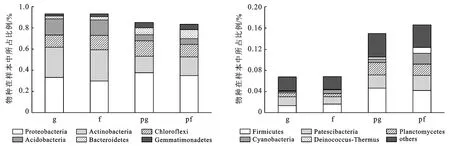
图3 菊芋和碱蓬根际土壤的微生物门水平下的相对物种丰富度
2.5 根系分泌物对土壤酶活性的影响
菊芋土壤的蔗糖酶、脲酶及碱性磷酸酶活性均显著高于碱蓬土壤(p<0.05),其中菊芋根际土壤约为碱蓬土壤的1.97,1.86和2.44倍,非根际较碱蓬土壤增加了0.69,0.92和3.80倍,但菊芋土壤过氧化氢酶活性降低,根际和非根际土壤分别降低1.03和1.02倍(图5)。菊芋根际土壤的脲酶和蔗糖酶活性较非根际显著增加,分别为非根际土壤的1.06和1.18倍。可见连续种植6 a菊芋部分土壤酶活性显著增加。
3 讨 论
土壤中微生物数量巨大、种类繁多,微生物多样性影响着土壤的结构、肥力及植物的生长发育等,而植物主要通过根际分泌物影响根际的微生物群落结构,进而提高养分利用率,改善土壤性质[27]。本研究明确了菊芋根系分泌物的组成成分,在菊芋根际土壤中含有果糖,葡萄糖,蔗糖,蔗果三糖,蔗果四糖及蔗果五糖,菊芋非根际和碱蓬土壤中只含有果糖,葡萄糖和蔗糖,没有低聚果糖。菊芋根际土壤中,以果糖含量变化最明显,约为碱蓬土壤的12倍,这是因为低聚果糖是由果糖分子聚合而成,经根系分泌到土壤中,不会长期存在,而是在各种酶(内切和外切)的作用下,会被进一步分解生成单糖,供植物微生物利用[28-29]。在菊芋根系分泌物中还发现了正十六烷酸,十八烷酸等各种有机酸类物质,与杨慧等的试验结果一致[30]。除此之外,低聚果糖作为钙、镁、铁等矿物质和微量元素的活化因子,在微生物菌群(乳酸菌等)的作用下发酵也会生成有机酸[31]。这些存在于土壤中的有机酸能够与Ca,Fe,A1等金属元素形成内络盐,导致周围土壤内的难溶性磷等营养物质释放,活化与稳固植物根际潜在的营养成分[32-33]。

注:图中不同字母表示处理间差异显著p<0.05)。
菊芋根系分泌物种类多、含量高,分泌物中的糖类(果糖、葡萄糖、低聚果糖等)、氨基酸等,为土壤微生物提供了丰富的营养物质。分泌物经根系进入土壤中,被土壤中微生物分解利用,为根际微生物的生长和繁殖提供充足的碳源、氮源和其他一些营养元素,例如芽孢杆菌,一类好氧或兼性厌氧的革兰氏阳性细菌,能分泌多种胞外产物,包括蛋白酶、淀粉酶和脂肪酶,还包括一些对碳水化合物有较强的消化能力的酶,帮助分解土壤中低聚糖类,供植物和土壤微生物利用[34-35]。
根际分泌物的种类和数量影响土壤微生物的数量、种类以及在土壤中的分布[36]。在根系分泌物的作用下,菊芋土壤中微生物数量及微生物生物量显著高于碱蓬,功能菌如放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)的相对丰度显著高于碱蓬。已知放线菌门大部分为腐生菌,促使土壤中的动物和植物遗骸腐烂,在自然界的氮素循环中也起着一定的作用[37];酸杆菌门,为嗜酸菌,是土壤中最丰富的细菌菌群之一,丰度与土壤碳含量密切相关[38]。根系分泌物中十六烷、十三醇、苯酚等类物质,均被看作具有一定程度的化感作用,十六烷分子量较小,化学结构并不复杂,可能是菊芋根系中十六酸的还原产物,具有很强的化感作用,能够抑制病原菌的生长;苯丙酸十六烷基酯,属于酚酸类物质,它能够抑制微生物产生气体以及挥发性脂肪酸,有效的减少微生物对其生长介质的消耗[39-40]。
土壤微生物数量的增加及生物活性的提高等,让更多的胞外酶释放到土壤中,使土壤酶活性增加。土壤酶是土壤中具有生物活性的蛋白质,它与微生物一起推动着土壤的生物化学过程,同时在物质转化过程中起重要的作用,土壤酶活性高低是土壤肥力的重要指标之一。本研究中菊芋土壤的蔗糖酶、脲酶及碱性磷酸酶活性均显著高于碱蓬,与杨生伟的研究结果一致[41],土壤酶活性的增加促进了土壤有机化合物的分解和矿化作用,使土壤中有效养分的含量提高,促进了植物对养分的吸收利用。过氧化氢酶活性低于碱蓬,这是因为菊芋土壤的盐分含量低于碱蓬,抑制了一些活性氧物质(过氧化物和丙二醛)的产生,使土壤的过氧化氢酶活性降低[42]。
土壤底层和地下水中易溶性盐类随着土壤毛管水位的上升,在土壤表层逐渐积聚起来,造成盐分堆积,使土壤出现盐渍化现象[43]。种植菊芋使土壤微生物大量繁殖,提高了土壤有机质、速效磷、碱解氮等的含量,降低了土壤pH值,改善了土壤结构,从而使毛细管水运动的速度降低和减少了水分的无效蒸发,加速淋盐、抑制返盐,降低了土壤表层盐分含量。此外,微生物分解有机物质产生的有机酸也能使土壤吸附的钙活化,加强了对土壤吸附性钠的置换作用,导致脱盐。综上所述,菊芋通过根系分泌物(低聚果糖,有机酸,酚酸等)的作用,使土壤中微生物数量、生物量显著增加,且土壤有益菌数量增多,改善了土壤微生物群落结构与功能,增加了土壤酶活性,提升了土壤生物活力,降低了土壤含盐量,达到了改良盐土的目的。
4 结 论
(1) 菊芋根系分泌物较碱蓬土壤更为复杂,种类多、含量高,且含有特有的分泌物如低聚果糖(蔗果三糖、蔗果四糖和蔗果五糖)、十八烷酸、十六烷等,为土壤微生物提供了丰富的营养物质。
(2) 连年种植菊芋后,在根系分泌物的介导下土壤微生物大量繁殖,微生物总数量显著增加,生物活性明显提高,土壤有益菌群(Actinomarinales,Acidobacteria)相对丰度显著增加(p<0.05),土壤微生物群落结构得到优化。
(3) 菊芋根系分泌物使土壤微生物活跃,促进了脲酶、蔗糖酶、碱性磷酸酶的活性显著增加(p<0.05),酶活性的提高加速了土壤中有机化合物的分解和矿化作用,提高了土壤有效养分含量,改善了盐渍土壤性质。

