猪δ冠状病毒的分离鉴定及其遗传进化分析
方谱县,刘康,张蕙畅,夏思进,张健淞,任杰,肖少波,方六荣
华中农业大学农业微生物学国家重点实验室/华中农业大学动物医学院/湖北省生猪健康养殖协同创新中心,武汉 430070
猪δ冠状病毒(porcine deltacoronavirus,PDCoV)是近年来新发现的一种猪肠道致病性冠状病毒,主要感染新生仔猪,临床症状与猪流行性腹泻(porcine epidemic diarrhea,PED)和猪传染性胃肠炎(porcine transmissible gastroenteritis,TGE)相似,以腹泻、呕吐、脱水为主要特征[1-3]。自2014年初在美国暴发后,加拿大、韩国、中国、泰国、越南、老挝、日本等国家也相继从猪腹泻样品中检测到PDCoV,给养猪业造成了较大的经济损失[4]。临床上PDCoV常与其他病毒混合感染,比如PEDV、TGEV以及PRRSV[5-6]。最近研究表明PEDV和PDCoV混合感染比单一病毒感染具有更严重的临床症状,这给肠道病毒的防控带来很大的挑战[7]。目前,尚无商品化的疫苗可用,病毒的分离培养对PDCoV诊断方法的建立和疫苗的研制及致病机制的研究具有十分重要的意义。
PDCoV为单股正链RNA病毒,基因组大小约为25.4 kb,属于冠状病毒科、δ冠状病毒属成员,具有其他冠状病毒类似的基因分布(5′ UTR-ORF1a-ORF1b-S-E-M-NS6-N-NS7-NS7a-3′ UTR)。其中,ORF1a和ORF1b编码2个多聚蛋白pp1a、pp1ab,被自身编码的木瓜样蛋白酶(nsp3)和3C样蛋白酶(nsp5)加工成15个非结构蛋白;3′端基因组编码4个结构蛋白[刺突蛋白(S),小膜蛋白(E),膜蛋白(M),核衣壳蛋白(N)]以及3个辅助蛋白(NS6,NS7,NS7a)[8-10]。目前,PDCoV是唯一通过体外细胞培养成功分离的δ冠状病毒属成员,是研究δ冠状病毒属病毒的良好模型。研究发现PDCoV具有非常广泛的宿主嗜性[11],对牛、鸡、小鼠以及火鸡易感,甚至还可以感染人[12-15],提示该病毒具有跨种传播的能力,给动物和人类健康带来危险。
PDCoV和PEDV都属于不容易分离培养的病毒,在体外培养中往往需要添加外源性胰蛋白酶[16]。相对于PEDV,可在体外培养传代的PDCoV毒株仍然很少,尽管近年来PDCoV生物学功能等基础研究获得较多的研究进展[17-19],但是对该病毒的起源、进化以及具有广泛的宿主嗜性的机制尚不清楚。因此,加大其流行病学调查、临床上毒株的分离以及免疫致病机制的研究具有重要意义。本研究采集了河北省某2个猪场发生腹泻的仔猪小肠内容物,经过病毒分离、鉴定和培养,获得2株PDCoV,分别命名为PDCoV CHN-HeB-A1株和CHN-HeB-B2株,对其体外增殖能力、全基因组测序和遗传进化进行了分析,以期为后续疫苗的研发和诊断试剂的研制奠定基础。
1 材料与方法
1.1 病料、细胞及主要试剂
病料为河北省某2个猪场发生腹泻仔猪的小肠内容物,其中有3份样品采自A猪场,2份样品采自B猪场。肾小管上皮细胞LLC-PK1由笔者所在实验室保存。抗PDCoV M蛋白单克隆抗体为笔者所在实验室自制保存。FITC标记的羊抗鼠IgG购自上海碧云天生物技术有限公司。RNA反转录试剂、限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶、高保真DNA聚合酶、DNA Marker、pGEM-T Easy克隆载体等购自大连宝生物公司。Trizol总RNA提取试剂盒为Omega公司产品。
1.2 病料处理
采集的小肠内容物中加入3~5倍体积的MEM培养液、青霉素200 U/mL和链霉素200 μg/mL,经搅拌混匀,在-20 ℃冻融3次,于4 ℃ 12 000 r/min离心10 min,收集上清,-80 ℃保存备用。
1.3 RNA提取与RT-PCR分析
根据PDCoV CHN-HN-2014株(GenBank登录号:KT336560)、PEDV AJ1102株(GenBank登录号:JX188454)、TGEV WH-1株(GenBank登录号:HQ462571)全基因组序列,设计特异性引物分别检测PDCoV M基因、PEDV N基因和TGEV N基因(表1)。提取处理后的病料总RNA,经反转录获得cDNA,以cDNA为模板,利用各引物对进行PCR扩增,产物经DNA试剂盒回收,克隆至pGEM-T Easy载体中进行测序鉴定。

表1 PEDV、PDCoV和TGEV检测引物序列 Table 1 Primer sequences for detection of PEDV,PDCoV and TGEV
1.4 病毒的分离
取2 mL上述RT-PCR检测为PDCoV阳性的样品悬液,用0.22 μm滤器过滤除菌后,接种至长满单层的LLC-PK1细胞,在37 ℃ 5% CO2的条件下吸附2~3 h后,弃去培养基,加入10 mL维持液(含7.5 μg/mL胰酶的MEM培养液),于37 ℃ 5% CO2培养箱中培养2~3 d后收毒,若未观察到细胞病变,则于-20 ℃冻融2~3次后再接种LLC-PK1细胞进行盲传,并对收集的每代病毒液进行RT-PCR检测,若传到第5代(F5)仍无细胞病变则弃掉。
1.5 病毒的鉴定
1)间接免疫荧光分析。将PDCoV接种24孔细胞培养板中的LLC-PK1细胞,同时,设立不接毒对照组。待细胞出现病变后,PBS洗涤3次,室温下4%多聚甲醛固定15 min;再用预冷的甲醇透化10 min,PBS洗涤3次,5%牛血清封闭45 min,PDCoV M单克隆抗体37 ℃孵育1 h。PBS洗涤3次,加入FITC标记的山羊抗鼠IgG,37 ℃孵育45 min,PBS洗涤3次,加入1∶2 000稀释的DAPI(4′,6-二脒基-2-苯基吲哚)进行核染色15 min,PBS洗3次,通过荧光显微镜观察并拍照。
2)Western blot分析。将PDCoV感染LLC-PK1细胞,待细胞出现明显的病变后收集细胞样品,同时设立不接毒细胞对照组。将细胞样品进行SDS-PAGE电泳分析,将凝胶中的蛋白转印至硝酸纤维素膜上,经过10%的脱脂奶粉封闭2 h、PDCoV M单克隆抗体室温孵育2 h、HRP标记的山羊抗鼠IgG室温作用1 h,最后,通过BIO-RAD化学发光成像仪进行显色分析。
3)PDCoV病毒粒子的超离纯化与电镜观察。病毒液经过离心和0.45 μm滤器过滤去除细胞碎片,加入终浓度为0.5 mol/L的NaCl和质量分数为5%的PEG6000,充分混匀后置于4 ℃沉淀24 h,8 000 r/min离心1.5 h,弃去上清,沉淀中加入少量Tris-EDTA-氯化钠缓冲液(TEN/STE),于4 ℃溶解过夜;上述溶液经30%、45%和60%梯度蔗糖溶液离心,在30%~45%分层处和45%~60%分层处分别取样;30 000 r/min离心4 h弃去上清去除蔗糖,在沉淀中加入少量STE于4 ℃溶解过夜。将获得的病毒悬液样品分别滴到铜网上吸附5 min,用滤纸轻轻吸取病毒悬液,待干燥后滴加20 g/L的磷钨酸进行负染1 min,弃掉磷钨酸,待干燥后在日立H-7000FA电子显微镜下观察并拍照。
1.6 病毒的TCID50测定
将病毒用含7.5 μg/mL胰酶的MEM培养液在1.5 mL EP管中作10倍系列稀释,将每个稀释度的病毒液接种到单层LLC-PK1的96孔细胞培养板中,每个稀释度接种8孔,每孔接种100 μL。同时,设立MEM培养液作阴性对照。将96孔细胞培养板置于37 ℃ 5% CO2培养箱中培养,12 h后开始观察,记录细胞产生CPE孔数,直至细胞病变稳定。以上实验重复3次,按Reed-Muench法计算病毒的TCID50。
1.7 PDCoV全基因组序列测定与分析
参照文献[20]和PDCoV全基因组序列,设计16对扩增引物将PDCoV全基因组序列分为16个1 500~1 900 bp的基因片段进行扩增,所用引物序列见表2。将各片段克隆至pGEM-T Easy载体中,并送至武汉擎科生物公司测序。使用SeqMan软件将16个基因片段序列拼接为完整的PDCoV全基因组序列。使用MegAlign软件对PDCoV全基因组序列进行分析,利用MEGA 7.0软件对全基因组序列进行遗传进化分析。
2 结果与分析
2.1 病料的RT-PCR检测
利用合成的特异性引物(表2)通过RT-PCR对临床上常见的3种猪肠道冠状病毒(PEDV、 TGEV和PDCoV)进行检测,核酸凝胶电泳分析结果显示5份样品经RT-PCR分析均获得大小约437 bp的PDCoV M基因特异性条带,而对PEDV和TGEV检测均为阴性(图1),说明腹泻样品为PDCoV阳性。

表2 PDCoV全基因组引物序列 Table 2 Primer sequences used to generate the full-length genome of PDCoV

M:代表DNA Marker; 1~7:RT-PCR检测PEDV; 8~14:RT-PCR检测TGEV; 15-21:RT-PCR检测PDCoV; 3-7、10-14、17-21:代表5份腹泻样品; 1、8、15:阳性对照; 2、9、16:阴性对照; M:DNA Marker; 1-7:Detection of PEDV by RT-PCR; 8-14:Detection of TGEV by RT-PCR; 15-21:Detection of PDCoV by RT-PCR; 3-7,10-14,17-21:Five diarrhea samples; 1,8,15:Positive control; 2,9,16:Negative control.
2.2 PDCoV的分离
将处理好的5份PDCoV阳性样品接种长满单层的LLC-PK1细胞,发现接种后第3天有2份样品(分别来源于2个猪场)接种的细胞产生病变,主要表现为细胞变圆、聚集、裂解、脱落,与PDCoV所致的病变一致,收集细胞培养物。将此2份细胞培养物在LLC-PK1细胞上传至F5,结果每代都能稳定地引起细胞病变。提取每代病毒的RNA,通过RT-PCR方法扩增PDCoV的M基因,结果均能获得大小约437 bp的特异性条带(图2)。说明所获得的2株病毒均能在细胞上稳定传代,分别命名为CHN-HeB-A1和CHN-HeB-B2株。

M:代表DNA Marker; 1:阳性对照; 2:阴性对照; 3-7:第1代至第5代CHN-HeB-A1株; 8-12:第1代至第5代CHN-HeB-B2株。M:DNA 2000 Marker; 1:Positive control; 2:Negative control;3-7:CHN-HeB-A1 strain from F1 to F5; 8-12:CHN-HeB-B2 strain from F1 to F5.
2.3 PDCoV分离株的鉴定
将PDCoV CHN-HeB-A1和CHN-HeB-B2株分别接种于24孔板培养的LLC-PK1细胞,待细胞出现病变时,收获细胞样品进行IFA和Western blot分析。IFA结果显示2株病毒感染的细胞均可观察到特异性绿色荧光,而对照组没有绿色荧光(图3A);Western blot结果表明PDCoV M单克隆抗体特异性识别病毒表达的M蛋白条带(图3B)。进一步通过超离纯化和电镜观察,结果显示采集30%、45%蔗糖分层处的样品可以观察到病毒粒子,病毒粒子成球型,直径100~150 nm,表面有囊膜和纤突,完整的病毒粒子呈典型的皇冠状(图3C)。这些结果证实这2株病毒均为PDCoV。
2.4 PDCoV感染细胞的动力学分析
为了分析2株病毒在LLC-PK1细胞上的增殖情况,将PDCoV CHN-HeB-A1株和CHN-HeB-B2株分别以感染复数(multiplicity of infection,MOI)为0.1的剂量接种LLC-PK1细胞,于接种后6、12、18和24 h收取培养物,进行间接免疫荧光实验,结果如图4A所示,PDCoV CHN-HeB-A1株和CHN-HeB-B2株感染细胞6 h时均可观察到少量的特异性绿色荧光,随着感染时间的延长,含有绿色荧光的细胞逐渐增多,24 h后由于细胞出现脱落,绿色荧光数量减少,整个实验中对照组细胞均无特异性绿色荧光。
同时,将2株病毒分别以相同剂量(0.1 MOI)接种LLC-PK1细胞,于接种后4、8、12、16、20、24 h分别收取细胞培养物进行TCID50检测,绘制病毒的一步生长曲线。结果如图4B所示,感染后4 h,即可检测到较低滴度的病毒,随着感染时间的延长,病毒滴度也逐渐升高。在感染24 h后,两分离株具有相当的病毒滴度。这些结果表明2株PDCoV具有相似的体外增殖曲线。
2.5 PDCoV全基因组测序与序列分析
提取病毒RNA,反转录成cDNA,以cDNA为模板,利用16对引物进行PCR扩增,结果显示分别扩增出覆盖PDCoV CHN-HeB-A1(图5A)和CHN-HeB-B2株(图5B)全基因组的16个片段,与预期片段大小相符。将各片段克隆至pGEM-T Easy克隆载体,送至武汉擎科生物技术有限公司测序,利用SeqMan软件对所获得的序列进行拼接,最终获得2株PDCoV的全基因组序列。由于2毒株核苷酸相似性极高,达99.95%,提交了其中1个毒株(CHN-HeB-A1)全基因序列至GenBank,核酸序列号为MG242062。

A:IFA检测PDCoV; B:Western blot检测PDCoV; C:电镜观察PDCoV。 A:PDCoV detection via IFA; B:PDCoV detection via Western blot; C:PDCoV detection via electron micrograph.
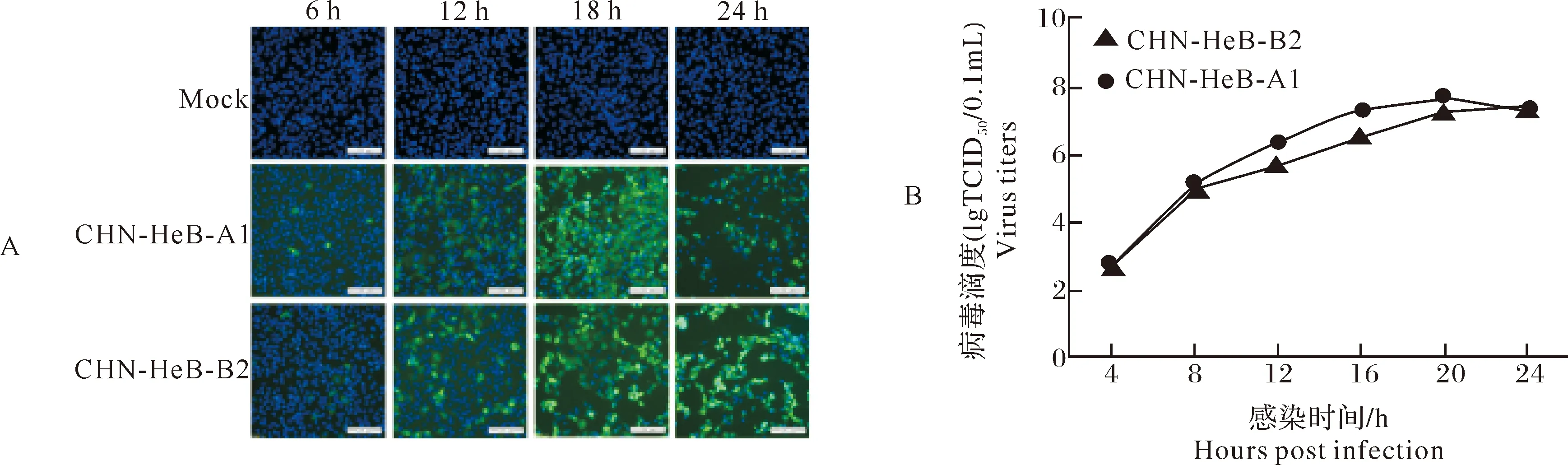
A:IFA检测PDCoV感染; B:PDCoV在LLC-PK1细胞上的一步生长曲线。 A:Detection of PDCoV infection via IFA; B:One-step growth curve of PDCoV in LLC-PK1 cells.

M:代表DNA Marker; A:扩增的PDCoV CHN-HeB-A1株16个基因片段; B:扩增的PDCoV CHN-HeB-B2株16个基因片段。M:DNA 2000 Marker; A:16 gene fragments amplified from PDCoV CHN-HeB-A1 strain; B:16 gene fragments amplified from PDCoV CHN-HeB-B2 strain.
利用MegAlign软件对已报道的28株代表性毒株全基因组进行序列分析,结果显示所有毒株相似性在97.0~99.9%,且PDCoV CHN-HeB-A1株和CHN-HeB-B2株序列与国内部分地区报道的毒株序列相似性相对较高,为98.7%~99.1%;与美日韩毒株的相似性为98.3%~98.8%,与东南亚毒株相距最远,相似性为97.4%~97.7%(表3)。利用MEGA 7.0软件对PDCoV CHN-HeB-A1和CHN-HeB-B2株与其他GenBank已发表的102株PDCoV全基因组序列进行全基因组的遗传进化分析,并利用ITOL网站(http://itol.embl.de/)对树形图进行美化,结果显示中国大陆毒株(包括分离的CHN-HeB-A1株和CHN-HeB-B2株)与中国香港毒株处于同一簇;美国、韩国、日本毒株处于一簇;东南亚毒株单独成簇(图6)。

图6 PDCoV全基因组序列的系统发育树分析Fig.6 Phylogenetic tree analysis of the genomic sequences of PDCoVs
3 讨 论
由于PDCoV在LLC-PK1细胞上增殖的病毒滴度要高于在ST细胞上的增殖滴度,本研究选用了LLC-PK1细胞进行病毒的分离和培养,成功分离获得了2株可以稳定传代的PDCoV,并进一步通过IFA、Western blot分析和电镜观察得到全面鉴定。为了获得增殖滴度高的病毒,对PDCoV CHN-HeB-A1与PDCoV CHN-HeB-B2株进行了克隆纯化。同时为了尽量减少病毒的传代次数,选择了F3代病毒用于空斑纯化,经过3轮空斑纯化,获得了病毒滴度较高(108.0TCID50/mL以上)的F6代病毒,用于后续研究。已有研究报道PDCoV分离株主要分为3个大的分支,包括东南亚(泰国、老挝、越南)毒株、中国毒株、美日韩(美国、日本、韩国)毒株[21-22]。本研究中PDCoV分离株CHN-HeB-A1与CHN-HeB-B2属于中国毒株这一分支,全基因组进化分析表明这2个毒株与中国香港毒株处于同一簇。我们也对S基因序列进行了进化树分析,结果与全基因组进化树基本一致。
通过IFA和Western blot分析表明本研究分离到的2株PDCoV与笔者所在实验室前期利用PDCoV CHN-HN-2014株M蛋白制备的单克隆抗体有很好的免疫反应,其致病性和免疫原性有待进一步研究。

