嗜水气单胞菌双组分系统EnvZ/OmpR功能探究
马世林,李继红,马倩倩,吴志豪,陈愿,张永安,3,4,周洋,3
1.华中农业大学水产学院,武汉430070; 2.中国科学院水生生物研究所,武汉430072; 3.岭南现代农业科学与技术广东省实验室,广州 510642;4.长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉430070
嗜水气单胞菌(Aeromonashydrophila)属于革兰氏阴性菌,是一种重要的条件致病菌[1]。该菌在自然界广泛分布,由其引起的鱼类出血性败血症(MAS)给水产养殖业带来了严重的经济损失[2]。嗜水气单胞菌的主要毒力因子包括胞外毒素(气溶素、溶血素、肠毒素等)、胞外蛋白酶(金属蛋白酶和丝氨酸蛋白酶等)和黏附因子(S蛋白、菌毛、外膜蛋白等)等[3-4]。研究表明,嗜水气单胞菌致病过程包含多个毒力因子的协同作用[5],因此,解析嗜水气单胞菌毒力因子的协同和调控机制显得尤为重要。
双组分系统(two-component system,TCS)是细菌感受、响应和适应环境改变或自身胞内状态的一种信号转导机制,细菌感应的信号包括细菌细胞自身的氧化还原状态、营养状况、外界环境的渗透压和抗生素浓度等[6-7]。EnvZ/OmpR系统是经典的双组分系统之一,可响应外界渗透压的变化,其中EnvZ是定位于细胞膜上的组氨酸蛋白激酶,OmpR是位于细胞质中具有转录活性的反应调控因子,EnvZ感应到外界信号后,通过磷酸基团转移将信号传递给OmpR,进而调节下游外膜孔蛋白OmpF和OmpC的转录[8]。有研究者发现鲍曼不动杆菌(Acinetobacterbaumannii)EnvZ/OmpR双组分系统在细菌渗透压调节、运动和毒力调控上发挥关键作用[9]。致病性大肠杆菌(pathogenicEscherichiacoli)双组份系统EnvZ/OmpR下游基因ompF和ompC缺失后显著影响细菌对宿主的侵袭、定植和黏附能力[10]。目前,嗜水气单胞菌中双组分系统EnvZ/OmpR的功能未知,本研究通过同源重组的方法构建了双基因缺失株ΔenvZ/ompR,探究双组分系统EnvZ/OmpR是否影响嗜水气单胞菌生物被膜形成、抗血液杀伤、全身性侵袭性扩散等过程,旨在为阐明EnvZ/OmpR在嗜水气单胞菌致病过程中发挥的功能提供科学依据。
1 材料与方法
1.1 菌株和实验试剂
嗜水气单胞菌野生株ZYAH72于2014年分离自湖北荆州某渔场患病鲫,由笔者所在实验室保存,NCBI序列号为NZ_CP016989.1。大肠杆菌χ7213感受态及自杀质粒pRE112均为笔者所在实验室保存。草鱼肾细胞CIK细胞系(grass carp kidney cell line,CVCL_CV32)由笔者所在实验室保存并传代,在含10%胎牛血清(FBS)和1%青霉素-链霉素双抗的M199培养基中培养。
胎牛血清和M199培养基购自Gibco公司;PrimeSTAR Max DNA聚合酶、限制性内切酶、DNA Marker购自诺唯赞公司;所有抗生素(青霉素-链霉素双抗和氯霉素)均购自海博生物试剂公司;逆转录试剂盒GoScriptTMReverse Transcription System购自美国Promega公司;荧光定量PCR检测试剂盒(SYBR Green PCR master mix)购自美国Bio-Rad公司;试验中使用的引物(表1),均由擎科生物技术有限公司合成。

表1 引物信息 Table 1 Primers information
1.2 ΔenvZ/ompR缺失株的构建
ΔenvZ/ompR缺失株构建策略如图1所示,以嗜水气单胞菌ZYAH72全基因组为模板,用P1/P2和P3/P4引物分别进行PCR以扩增上下游同源臂,再用P1/P4引物经融合PCR连接上下游同源臂。经XbaⅠ和SacⅠ双酶切后连接到自杀性质粒pRE112对应多克隆位点,然后转化至大肠杆菌χ7213。将构建的χ7213-pRE112-envZ/ompR作为供体菌,嗜水气单胞菌ZYAH72作为受体菌,进行接合转移。具体操作如下:供体菌和受体菌分别培养至对数生长期,用无菌PBS洗涤2次后混合均匀。将混合液小心加到提前放置在无抗LA平板上的无菌硝酸纤维素膜上,28 ℃静置6 h后用LB培养基冲洗,适当梯度稀释后涂布于氯霉素抗性平板上。28 ℃培养待结合子长出后,用P1/P4引物进行PCR验证。验证为阳性的单交换子在7%蔗糖LB培养基中连续传代后检测氯霉素抗性。对于氯霉素敏感菌株用P5/P6引物进行PCR验证,PCR鉴定结果为阴性即表明ΔenvZ/ompR缺失株构建成功。

图1 ΔenvZ/ompR缺失株构建策略Fig.1 Construction strategy of ΔenvZ/ompR
1.3 NaCl胁迫实验
分别配制含有0.25%、1.00%、2.00% NaCl的培养基,将嗜水气单胞菌以体积比1∶100转接到盐胁迫培养基中,混匀后转接至96孔板,每孔200 μL,每个样品3个重复。28 ℃条件下培养,每0.5 h测OD600 nm值,连续培养30 h。实验独立重复3次。
1.4 qRT-PCR检测相关基因表达
使用TaKaRa反转录试剂盒(PrimeScript TMRT Kit)进行反转录,2×TSINGKE Master qPCR Mix-SYBR进行荧光定量PCR。其中嗜水气单胞菌ZYAH72的内参为16S rRNA,草鱼的内参为β-actin。实验独立重复3次,分析方法采用2-ΔΔCt法[11]。
1.5 生物被膜生成量检测
取10 μL菌液和100 μL LB至96孔板中,28 ℃培养36 h。吸出菌液并用无菌水洗去未附着菌体,用100 μL 0.2%结晶紫染色5 min。无菌水洗涤后放置于37 ℃培养箱烘干,用33%冰醋酸溶解生物被膜,分光光度计测定每孔的OD600 nm值。实验独立重复3次。
1.6 全血杀伤实验
采集健康成年草鱼血液,用EDTA作抗凝处理,调节菌浓度为105CFU/mL,菌和血液以体积1∶9比例混匀置于28 ℃培养箱静置培养。作用1 h后取100 μL菌-血液混合物,使用无菌PBS进行10倍梯度稀释后涂布平板,28 ℃培养箱中过夜培养,第2天进行菌落计数。
1.7 斑马鱼攻毒实验
斑马鱼购自武汉东湖生态旅游风景区万物生水族经营部,于华中农业大学水产基地暂养1周后进行攻毒实验。根据菌落计数的结果,用PBS将生长至对数生长期的嗜水气单胞菌洗涤2次,置于冰上备用。注射感染组斑马鱼用无菌注射器经腹腔注射,设置6个攻毒浓度,每组10尾斑马鱼,每尾10 μL,同时注射PBS组作为空白对照。浸泡感染组的斑马鱼背鳍前方小片鳞片用手术刀片刮掉,分别浸泡在6个浓度梯度菌液的鱼缸中,20 min后捞出并用曝气水清洗,放到干净水源的鱼缸中。设置刮伤后PBS浸泡组为空白对照组。所有斑马鱼感染后持续观察14 d,记录死亡数据,采用Karber法计算LD50[12]。
1.8 草鱼攻毒实验
试验用草鱼(体质量20±10 g、体长8~10 cm)购自湖北仙桃市某草鱼养殖基地,于华中农业大学水产基地暂养1周后进行攻毒实验。草鱼感染剂量为2.0×105CFU/尾。感染24 h后,解剖草鱼后取脾脏、头肾和体肾组织,分别称取其质量。向组织中加入1 mL的PBS,使用研磨棒研磨组织获得悬浮液,涂布平板进行菌落计数,最后计算出每克组织中的载菌量。
2 结果与分析
2.1 嗜水气单胞菌双组分系统envZ/ompR基因组分析及ΔenvZ/ompR缺失株构建
对嗜水气单胞菌ZYAH72全基因组序列分析,发现envZ/ompR的同源序列,将其命名为envZ/ompR(BFW97_22565/ BFW97_22560)。为进一步研究envZ/ompR功能,通过同源重组法构建envZ/ompR双基因缺失株,通过基因外部引物(P1/P4)PCR扩增,野生型获得3 080 bp产物,ΔenvZ/ompR产物为1 205 bp,通过基因内部引物(P5/P6)PCR扩增,野生型获得535 bp产物,ΔenvZ/ompR无对应片段因此无法获得扩增产物,结果均与预期一致,表明ΔenvZ/ompR缺失株构建成功(图2)。

泳道1、3为野生型ZYAH72扩增产物,泳道2,4为缺失株envZ/ompR扩增产物,泳道1、2引物为外引物P1/P4,泳道3、4引物为内引物P5/P6。Lanes 1 and 3 are the amplified products of wild-type ZYAH72,lanes 2 and 4 are the amplified products of ΔenvZ/ompR,the primers of lanes 1 and 2 are P1/P4,and the primers of lanes 3,4 are P5/P6.
2.2 双组分系统EnvZ/OmpR对ompF和ompC基因的转录调控
渗透胁迫实验结果显示,在低渗(0.25% NaCl)、等渗(1.00% NaCl)和高渗(2.00% NaCl)LB培养基中ΔenvZ/ompR与野生株生长速度无显著性差异(图3)。对下游ompF和ompC基因转录水平的检测结果显示,野生型菌株在低渗(0.25% NaCl)条件较等渗(1.00% NaCl)条件下ompF的转录水平上调了64.6%,envZ/ompR缺失后,ompF的转录水平显著被抑制(图4)。在高渗(2.00% NaCl)条件下,野生型菌株ompC的转录水平较等渗(1.00% NaCl)条件上调了48.2%,而envZ/ompR缺失后,ompC的上调表达被显著抑制(图5)。

A:0.25% NaCl; B:1.00% NaCl; C:2.00% NaCl.图3 细菌在不同NaCl质量分数LB培养条件下的生长曲线Fig.3 Growth curve of bacteria cultured in LB medium with different NaCl concentration
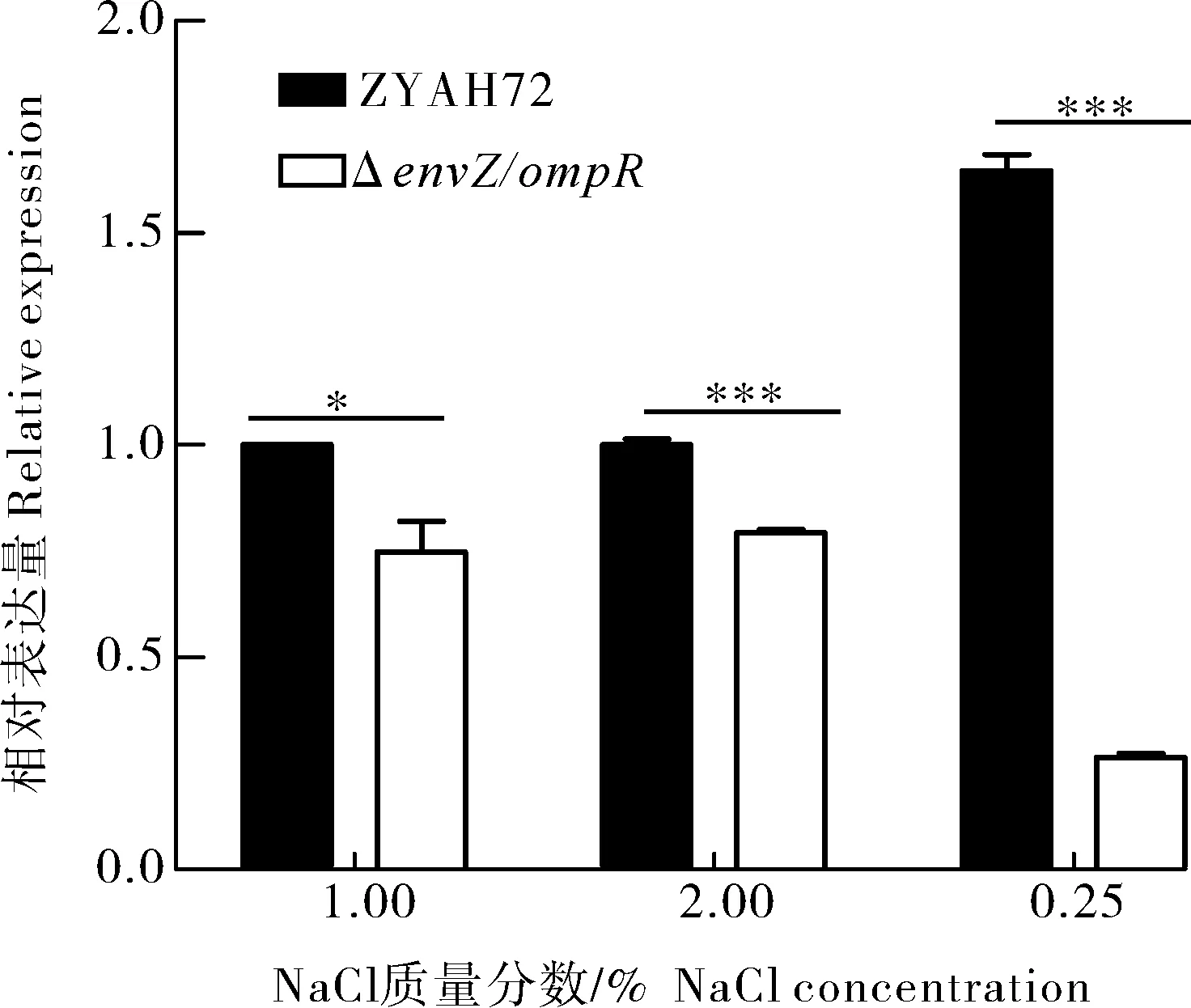
图4 ompF在不同NaCl质量分数LB培养条件下的转录水平Fig.4 Transcription level of ompF under differentNaCl concentration LB culture conditions
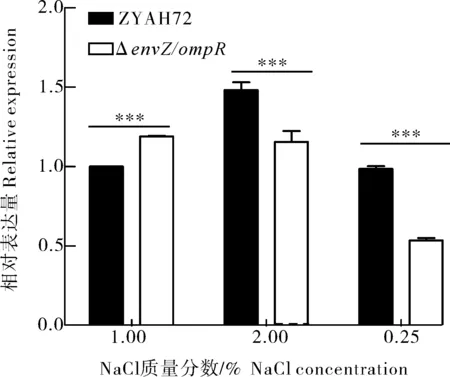
图5 ompC在不同NaCl质量分数LB培养条件下的转录水平Fig.5 Transcription level of ompC under different NaCl concentration LB culture conditions
2.3 双组分系统EnvZ/OmpR在嗜水气单胞菌生物被膜形成和抗全血杀伤中的作用
通过检测体外生成生物被膜的生成量,探究双组分系统EnvZ/OmpR是否参与嗜水气单胞菌生物被膜形成过程,结果显示ΔenvZ/ompR的生物被膜形成能力较野生型下调19.9%(图6)。此外,ΔenvZ/ompR在抗宿主免疫清除方面也表现出缺陷。野生型在与草鱼全血孵育1.0 h后,细菌数量为起始菌量的3.82倍,而ΔenvZ/ompR被草鱼全血有效杀伤,孵育1.0 h后菌量仅为起始菌量的90.1%(图7),表明envZ/ompR缺失后,细菌抗全血杀伤能力显著下降。
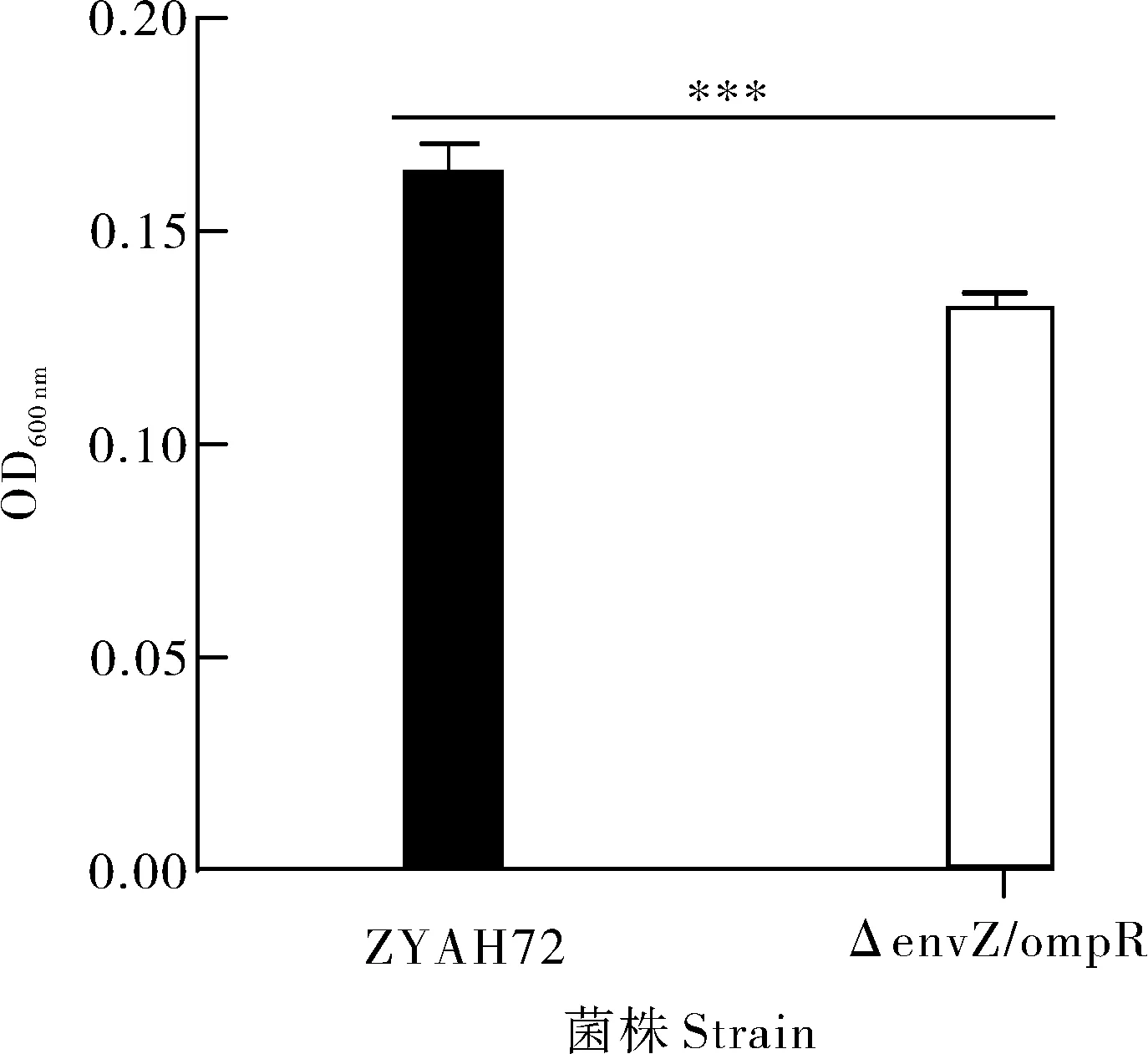
图6 生物被膜形成能力检测Fig.6 Biofilm formation test

图7 抗全血杀伤能力检测Fig.7 Capacity of anti-whole blood killing assay
2.4 双组分系统EnvZ/OmpR在嗜水气单胞菌感染过程中的作用
斑马鱼攻毒实验结果显示,腹腔注射感染方式下,ΔenvZ/ompR的LD50相较野生型增长了1.80倍,而在创伤感染方式下,ΔenvZ/ompR的LD50相较野生型增长了4.80倍(表2)。进一步检测野生株与ΔenvZ/ompR感染后分别在草鱼内脏组织载菌量上的差异,结果显示:在脾脏中,ΔenvZ/ompR的载菌量仅为野生株的5.5%;在体肾组织中,ΔenvZ/ompR的载菌量仅为野生株的11.3%;在头肾组织中,野生载菌量为103CFU/g,而ΔenvZ/ompR的载菌量为0(图8)。

表2 斑马鱼攻毒结果 Table 2 Zebrafish challenge results

图8 草鱼组织载菌量Fig.8 Bacterial loads in grass carp tissues
2.5 双组分系统EnvZ/OmpR对于促炎性细胞因子表达的影响
野生株感染草鱼后脾脏中TNF-α和IL-6的转录水平分别上调了154.6倍和84.5倍,而ΔenvZ/ompR感染组脾脏中,上述促炎细胞因子也上调表达,上调倍数分别为107.8倍和5.6倍;在肝脏中野生株感染后TNF-α和IL-6的转录水平分别上调了115.6倍和102.0倍,而缺失株感染组仅为52.6倍和24.6倍(图9)。上述结果说明野生株感染后能够引起草鱼强烈的炎症反应,而envZ/ompR基因缺失后降低了炎症反应程度。
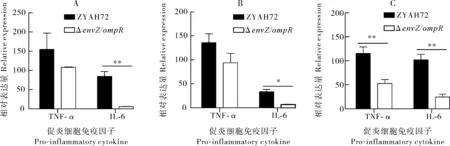
A:脾脏; B:肾脏; C:肝脏。A:Spleen; B:Kidney; C:Liver.图9 草鱼促炎细胞免疫因子的相对表达量Fig.9 Relative expression of pro-inflammatory cytokine of grass carp
3 讨 论
自20世纪80年代起,嗜水气单胞菌的流行病给全球水产养殖业造成了严重的经济损失[13]。嗜水气单胞菌的致病机制一直以来都是业内研究热点。本研究通过同源比对,将ZYAH72(NZ_CP016989.1)菌株BFW97_22565/ BFW97_22560基因命名为envZ/ompR,成功构建了基因缺失株ΔenvZ/ompR,并初步分析了该基因的功能。
根据功能域分析推测双组分系统EnvZ/OmpR可能和渗透胁迫有关,然而,实验结果显示缺失株渗透胁迫能力变化并不显著。在基因功能预测时发现ZYAH72基因组中共有4对双组分基因和渗透胁迫有关,推测envZ/ompR基因失活后其他双组分系统代偿了EnvZ/OmpR渗透胁迫的功能。为了验证这个猜想,用qRT-PCR的方法检测了下游渗透调控相关因子的表达变化,结果显示,低渗条件下,外膜孔蛋白基因ompF受双组分系统EnvZ/OmpR调控转录水平上调,而高渗条件下外膜孔蛋白基因ompC受双组分系统EnvZ/OmpR调控转录水平显著上调。上述结果与大肠杆菌中双组分系统EnvZ/OmpR对于下游蛋白的调控结果一致[14],表明嗜水气单胞菌中EnvZ/OmpR与渗透胁迫响应相关,但因为在ZYAH72菌株中还存在其他功能类似的双组分系统,这些双组分系统如何协调互作,具体调控机制还有待进一步研究。
生物被膜与细菌抗生素抗性和致病性密切相关,生物被膜还可以作为细菌对外的屏障,有效抵御宿主杀伤[15-17]。之前的研究发现嗜水气单胞菌QseB/C双组分系统正向调节泳动及涌动、溶血活性和负向调节生物膜的形成,影响细菌毒力[10]。本研究发现双组分系统EnvZ/OmpR正调控嗜水气单胞菌生物被膜的形成和抗血液杀伤能力。
研究表明,鲍曼不动杆菌EnvZ/OmpR双组分系统调控细菌的渗透压和毒力[9]。此外,大肠杆菌双组分系统下游基因ompF和ompC也被发现和细菌的定植、黏附能力及毒力有关[10]。本研究测算了ΔenvZ/ompR的斑马鱼LD50,发现腹腔感染后缺失株毒力和野生株毒力差异并不明显。然而刮伤感染结果显示ΔenvZ/ompR毒力有明显下降,提示EnvZ/OmpR在嗜水气单胞菌由皮肤创口向全身系统扩散过程发挥作用。为进一步验证这一结论,用草鱼构建感染模型检测了组织载菌量,ΔenvZ/ompR感染草鱼后各脏器的载菌量相比于野生株显著降低,表明EnvZ/OmpR促进细菌的全身侵袭能力。在实际生产中,鱼体体表伤口也是嗜水气单胞菌感染的途径之一。最后我们还发现,ΔenvZ/ompR感染引起的宿主促炎细胞因子TNF-α和IL-6表达量减少,过多的炎性细胞因子产生会导致组织损伤、器官衰竭甚至最终死亡。因此,上述结果也与ΔenvZ/ompR致病力的结果相一致。
综上,本研究初步探究了嗜水气单胞菌双组分系统EnvZ/OmpR的功能,发现其参与响应渗透胁迫,参与调控生物被膜形成,且在致病过程尤其是宿主体内系统扩散过程发挥重要作用,这一结果可为嗜水气单胞菌致病调控机制的研究提供科学依据。

