猪口腔液在猪病毒感染监测中的初步应用
王 雪,赵 静,阮 征,肖 冉,黎 巧,裴 洁,李婷婷,万 云,岳 龙,张四化*
(1.武汉市动物疫病预防控制中心,湖北武汉 430014;2.湖北省动物疫病预防控制中心,湖北武汉 430070)
猪口腔液是由猪口腔中的唾液和黏膜渗出液组成的混合液体[1-2],含有唾液腺、呼吸道和齿龈沟的分泌物如血清衍生抗体、激素、细菌、病毒等[3],是一种高效、方便的群体疫病监测样品。研究表明,猪口腔液含有感染机体的病原和抗体[4-5],很多病毒在感染机体后的窗口期,已经存在于猪的口腔分泌物中,可作为多种猪病的早期诊断样品[6],多项研究应用常规PCR检测口腔液中的病原核酸,如口蹄疫病毒(Foot-and-mouth disease virus,FMDV)[7-8]、猪瘟病毒(Classical swine fever virus,CSFV)[9]、非洲猪瘟病毒(African swine fever virus,ASFV)[10]、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)[11]、猪圆环病毒(Porcine circovirus,PCV)[12]、猪伪狂犬病病毒(Porcine pseudorabies virus,PRV)[13]、猪流感病毒(Swine influenza A virus,SIV)[14]、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)[15]等都可在猪口腔液中检出。猪口腔液样品采集较为简单,可通过吸附性材料如棉绳等收集,由于猪天生好奇和嗜咀嚼,会主动接近并咬湿绳子,挤压棉绳上的液体可获得猪口腔液样品[16-17]。相对于传统的活体组织、血液等个体样品,猪口腔液采集不需要保定动物,对动物无损伤、无应激,符合动物福利,对采样人员的技术要求低,且一个样品可覆盖多头猪、可连续重复采样,能减少人力物力,有利于早期发现及诊断疫情[18]。目前大部分口腔液研究是基于检测攻毒后的试验猪,应用于实际猪场检测病原的报道不多。为了解猪口腔液应用于猪场病原监测的效果及采样猪场主要猪病病毒的感染分布情况,在63家生猪养殖场以栏舍为单位采集猪口腔液样品,结合荧光定量PCR和常规PCR分别检测本地区常见的7种猪病病毒,即猪瘟病毒、口蹄疫病毒、猪繁殖与呼吸综合征病毒、高致病性猪繁殖与呼吸综合征病毒、猪圆环病毒1型和2型、猪伪狂犬病病毒,以初步探索利用猪口腔液开展猪场病原学监测的可行性。
1 材料与方法
1.1 材料
1.1.1 样品来源 猪口腔液样品来源于2018年1月—12月武汉市6个行政区(县)的63家猪场的325个猪栏,包含35个商品代养殖场的180个猪栏、19个种猪场的100个猪栏、4个养殖小区20个猪栏和5个猪散养户的25个猪栏。
1.1.2 试剂盒和主要仪器 磁珠法病毒总核酸抽提试剂盒,美基生物科技有限公司产品;猪瘟病毒通用型实时荧光RT-PCR检测试剂盒、口蹄疫病毒通用型实时荧光RT-PCR检测试剂盒、猪繁殖与呼吸综合征病毒通用型实时荧光RT-PCR检测试剂盒、猪繁殖与呼吸综合征病毒(Nsp2 1594-1680变异株)实时荧光RT-PCR检测试剂盒、猪圆环病毒1型和2型双重PCR检测试剂盒、猪伪狂犬病病毒实时荧光PCR检测试剂盒,世纪元亨动物防疫技术有限公司产品;Thermo KingFisher FLEX磁珠提取仪、ABI 7500型荧光PCR仪、Bio-Rad T100型PCR仪。
1.1.3 采样用品 剪取100%纯棉、直径1.6 cm、长度1.2 m的绳子,灭菌后转入无菌自封袋保存;剪刀、离心管使用前进行灭菌处理。
1.2 方法
1.2.1 样品采集 在全年4个季度、武汉市6个生猪养殖集中的行政区(县)分别采集不同类型猪场的猪口腔液样品。将棉绳悬挂于猪栏内相对干净的区域,远离饲喂、饮水和排便区,不接触墙壁和猪栏。棉绳上端打结固定,下端悬挂高度与猪身肩关节齐平,任猪自由啃咬30 min。戴上一次性无菌手套,将棉绳下端的湿润部分放入一次性无菌自封袋中,用力挤压袋内棉绳,释放口腔液至袋底。剪掉自封袋底部一角,将口腔液转移至离心管中,置于低温采样运输箱中运送。
1.2.2 样品预处理 样品送达实验室后,4 ℃条件下1 500 r/min离心10 min,去除杂质,将上清转移至另一无菌离心管中,做好标记。
1.2.3 病原检测 严格按照Magen磁珠法病毒总核酸抽提试剂盒对325份猪口腔液进行核酸提取,按各种病毒检测试剂盒操作说明加入核酸样品及相应试剂进行扩增。猪瘟病毒(CSFV)、口蹄疫病毒(FMDV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪繁殖与呼吸综合征病毒Nsp2 1594-1680变异株(HP-PRRSV)进行实时荧光RT-PCR扩增,猪伪狂犬病病毒(PRV)进行实时荧光PCR扩增,检测样品出现典型的S形扩增曲线且Ct值小于37.0时为阳性;猪圆环病毒1型和2型(PCV1和PCV2)进行PCR扩增,PCR产物用10 g/L琼脂糖凝胶电泳检测,在凝胶成像系统上观察,扩增产物片段大小与阳性对照片段一致为阳性。
2 结果
2.1 7种病毒检测结果
采用RT-PCR和常规PCR对所提取的猪口腔液核酸进行CSFV、FMDV、PRRSV、HP-PRRSV、PCV1、PCV2和PRV的检测,在325份猪口腔液中,检出CSFV、FMDV、PRRSV、HP-PRRSV、PCV1和PCV2,PCV的检出率最高,尤其是具有致病性的PCV2,共检出PCV2阳性样品83份,阳性率为25.54%,其次是PCV1,阳性样品为45份,阳性率是13.85%,PRRSV、FMDV、HP-PRRSV、CSFV的阳性率分别为7.38%、3.69%、0.92%和0.31%,PRV在口腔液的检出率为0。7种病毒的检测结果见图1。

图1 7种病毒检测阳性率
2.2 4个季度病毒检测结果
分别在全年的4个季度采集猪口腔液样品,4个季度采集的样品数量差异不大,第1季度采集85份,其他3个季度各80份。第1季度检出CSFV、FMDV、PRRSV、HP-PRRSV、PCV1、PCV2共6种病毒,第3季度检出FMDV、PRRSV、HP-PRRSV、PCV1、PCV2共5种病毒感染,第2季度、第4季度检出FMDV、PRRSV、PCV1、PCV2共4种病毒;CSFV仅在第1季度检出,阳性率为0.31%,FMDV、PRRSV、PCV1、PCV2在4个季度均有检出,HP-PRRSV仅在第1和第3季度检出,阳性率分别为2.35%和1.25%;PRRSV在第1季度的阳性率最高(14.12%),FMDV、PCV2在第2季度阳性率最高,阳性数分别为7份、36份,阳性率分别为8.75%和45.00%,PCV1在第3季度阳性率比PCV2高,为23.75%。4个季度各种病毒的检测结果见图2。
2.3 不同类型场点病毒检测结果
为了解不同类型场点的病毒感染情况,此次猪口腔液采集的场点包含商品代养殖场、种猪场、养殖小区和散养户,样品量占比见表1,所有样品经核酸检测后显示,商品代养殖场、种猪场检出的病毒种类比养殖小区、散养户多。CSFV、HP-PRRSV仅在商品代养殖场检出,FMDV在商品代养殖场和种猪场检出,散养户仅能检出PCV1和PCV2。不同类型场点PCV2检测阳性率均较高,散养户的阳性率最高,高达36.00%。不同类型场点的猪口腔液病毒检测结果见图3。

图2 不同季度病毒检测阳性率

表1 不同类型场点采集的样品量占比
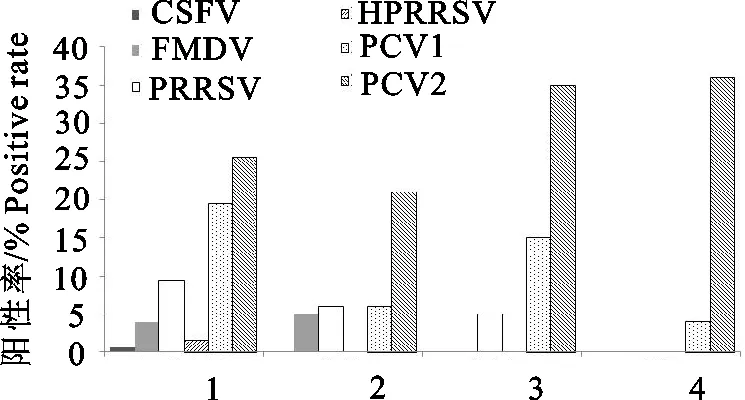
1.商品代养殖;2.种猪场;3.养殖小区;4.散养户
2.4 不同行政区病毒检测结果
为了解通过猪口腔液监测不同地域猪群病毒感染情况的可行性,此次样品按存栏比例分布在6个主要生猪集中的行政区(县),不同区的样品量占比见表2,样品采集后经病毒核酸检测,结果显示,6个区均存在PCV1和PCV2的感染,其中PCV1以A区和B区阳性率最高,阳性率分别为22.50%、45.00%,PCV2以A区和E区检测阳性率最高,分别为35.00%、33.33%,FMDV在A、D、E和F 4个区检出,HP-PRRSV仅在A区和C区检出,CSFV仅在C区检出(图4)。PCV1阳性场点占抽样场点的31.75%,PCV2阳性场点占抽样场点的53.97%,PCV1和PCV2混合感染占23.81%,说明养殖区普遍存在猪圆环病毒2型感染(表3)。
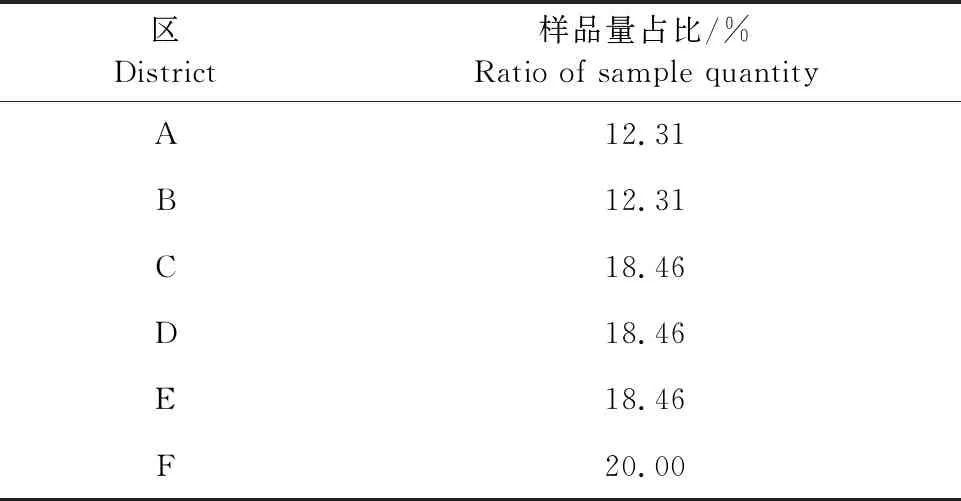
表2 不同区采集的样品量占比

图4 不同区病毒检测阳性率

表3 PCV1/PCV2阳性场占比
3 讨 论
早期病原监测是评估群体感染风险和动物疫病净化消除的有效手段,对减少动物疫病的传播和影响具有重要意义。动物分泌液作为监测动物健康和疫病的新兴递质,在疾病早期诊断中具有明显的作用[19]。猪口腔液作为一种动物分泌液,已广泛应用于多种猪病的病原检测或抗体测定。研究证实,多种猪传染性病原体通过口腔排毒,可能与口腔中病毒的定殖组织或循环系统经黏膜渗出的物质有关,因此口腔液中含有机体感染后的病原,甚至有些病毒优先于血液检出,如猪繁殖与呼吸综合征病毒[17]、非洲猪瘟病毒[20]、水疱性口炎病毒[21]等。本文采集的猪群均为临床正常猪,检出病原核酸提示猪可能处于感染后的排毒期或潜伏期,应用猪口腔液开展病毒早期监测具有可行性。口腔液是一种群体监测样品,一个样品可覆盖一个猪栏多头猪,一旦检出阳性则可作为早期诊断的证据,而血清学监测需采集猪栏中的每头猪才能达到相同效果。对周期性监控疫病来说,血清学监测对动物的刺激性较大,不易重复采样,对采集人员的技术要求也比较高,而猪口腔液样品易于开展后续多项试验,养殖业主可通过重复获取并检测猪口腔液持续监测猪群不同阶段的疫病状态[22]。据报道[12,23],PCR方法检测口腔液样品与检测血清样品相比,病原检出阳性率更高、检出时间更早。
以栏舍为单位悬挂棉绳由猪啃咬后收集猪口腔液样品,结合分子生物学方法监测猪群病毒感染情况,结果显示,在检测的生猪养殖场中,口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒及猪圆环病毒均能检出(图1),尤其在春季这几种病毒的检出率较高(图2),这可能与病毒在低温环境下更易存活有关,也可能与引种调运导致的病原输入相关;口蹄疫病毒、猪圆环病毒在春夏交替之际的检出率较高,昼夜温差大、湿度高可能是导致这两种病毒检出率高的原因。不同场点检测结果提示,规模化养殖场检出的病毒种类比养殖小区、散养户多,推测是受群体数量、种源及养殖密度影响,群体量大、种源复杂、养殖密集易造成病毒在群间传播,病毒感染风险也随之增加。另外,养殖小区和散养户的样本量少(6.15%和7.69%)也是导致散户病毒种类检出低的主要原因(表1)。
猪圆环病毒的检出率普遍较高,尤其是致病性更高的PCV2(图1),全年4个季度均能检出(图2),存在于不同区(图4),虽然散养户采集的样本量少,但PCV2的检测阳性率却最高(图3),提示本地区尤其是散养环节可能存在广泛的PCV2污染。猪圆环病毒主要通过鼻液、口腔液、粪便、尿液排毒,可在血清、组织(淋巴结、肺、扁桃体、肾、肝、心)等检出[22,24],可引起仔猪断奶后多系统衰弱综合征,一般情况下,感染PCV2仅引起亚临床表现,但可导致猪群产生严重的免疫抑制,从而继发或并发其他传染病。猪伪狂犬病病毒在试验中未检出,结合本地区gE抗体监测情况,理论上能检测到病毒,零检出的原因可能是,试验采集猪群主要为育肥猪、成年猪,感染PRV后一般症状较为轻微,耐过后可建立潜伏感染,此时并不向外界环境散发病毒[24],口腔液中检出病毒的概率较低。潜伏感染期猪伪狂犬病病毒DNA以附体的形式出现或插入感染部位(三叉神经节、嗅球和肺扁桃体等)的基因组中,但在应激因子的刺激下可重新产生感染性病毒粒子,并通过口、鼻及生殖道分泌物等途径向外排毒[25]。李段[26]用PCR检测猪伪狂犬病阳性猪场不同阶段猪群的鼻拭子、肛拭子、唾液等样品,鼻拭子、肛拭子和唾液样品PRV的阳性率分别为6.21%、5.65%和0.55%。Panyasing Y[13]用PCR检测PRV攻毒猪的口腔液,发现攻毒后3 d~21 d PRV阳性率在20%~100%之间。推测当猪处于排毒期时,口腔液可检测到病毒。猪繁殖与呼吸综合征病毒、猪瘟病毒、口蹄疫病毒虽然在试验中的检出率不高,但这几种病毒对养殖业的危害较大,通过猪口腔液对规模化猪场病原普检,可提前做出综合防控措施。
试验结果表明,猪口腔液可用于检测猪瘟病毒、口蹄疫病毒、猪繁殖与呼吸综合征病毒和猪圆环病毒,采集猪场存在普遍的猪圆环病毒感染,以栏舍为单位采集猪口腔液用于猪场病原监测具备可行性。

