IL-37、VEGF、LDH和β2-MG在多发性骨髓瘤中的表达及其临床意义*
费晓莉,陶 黎,熊 梅,何 东,林 娟,侯 铮
(成都市第一人民医院血液内科 610000)
多发性骨髓瘤(multiple myeloma,MM)是一种单克隆浆细胞恶性增殖性疾病,其发病占恶性肿瘤的1%,占血液系统肿瘤的13%[1]。即使靶向药物、免疫疗法、自体造血干细胞移植等多种治疗方案已经被广泛应用于临床[2-3],MM仍无法完全治愈,大部分患者最终仍会因疾病的进展、复发而治疗失败[4]。已有研究表明,血管新生在肿瘤发生、转移中发挥关键作用,血管内皮生长因子(VEGF)是调节血管新生细胞因子中的重要组成部分[5]。白细胞介素-37(IL-37)是近年研究的热点,它通过抑制肿瘤血管新生[6]、调节转导和转录激活因子3(STAT3)激活等发挥抗肿瘤作用。已有研究表明,IL-37在肝癌[7]、肺癌[8]、结肠癌[9]等实体肿瘤中通过抑制肿瘤血管新生发挥抗肿瘤作用。但目前有关IL-37是否参与MM发生、发展的相关研究很少。因此,本研究通过比较不同国际分期体系(ISS)分期MM患者,化疗前后血清IL-37、VEGF、乳酸脱氢酶(LDH)和β2微球蛋白(β2-MG)水平变化,以探讨其与MM发生、发展的关系,旨在为临床寻找简单易操作并且可靠的MM肿瘤负荷、病情分期及近期疗效评价指标。
1 资料与方法
1.1 一般资料
2015年1月至2019年7月本院收治的初诊MM患者62 例(MM组)纳入本研究,男38例,女24例;年龄36~76岁,中位年龄59岁;IgG型34例,IgA型17例,IgD型2例,轻链型9例,所有病例诊断均符合《中国多发性骨髓瘤诊治指南(2017修订)》诊断标准[10]。根据ISS进行分期[11]:Ⅰ期11例、Ⅱ期19例、Ⅲ期32例。MM组62例患者接受化疗,其中43例接受硼替佐米联合地塞米松(BD)方案化疗:硼替佐米1.3 mg/m2,第1、4、8、11天;地塞米松20 mg/d,第1~2、4~5、8~9、11~12天,每21天为1个疗程。另外19例MM患者接受长春新碱+阿霉素+地塞米松(VAD)方案化疗:长春新碱0.5 mg/d,第1~4天;阿霉素10 mg/d,第1~4天;地塞米松40 mg/d,第1~4、9~12、17~20天,每28天为1个疗程。经4个疗程化疗后参考国际骨髓瘤工作组(IMWG)疗效标准进行疗效评估(2016版)[12],其中完全缓解(CR)17例,非常好的部分缓解(VGPR)21例,部分缓解(PR)20例,疾病进展(PD)4例。另外,纳入性别、年龄相匹配的健康体检者28例(对照组),男15例,女13例;年龄38~72岁,中位年龄54岁。本研究通过本院医学伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1标本采集和制备
MM组患者采血时间为化疗前和化疗4个疗程后,对照组于体检当日采集血液标本。分别采集空腹外周静脉血10 mL(肝素抗凝),其中5 mL 经2 000 r/min离心处理10 min,提取的血清置于Eppendorf管中,标记编号后储存于-80 ℃冰箱冻存,待测定IL-37、VEGF水平,另外5 mL标本置于抗凝管中摇匀,经离心分离血清后当日完成血清LDH、β2-MG水平测定。
1.2.2检测方法
采用ELISA法检测血清IL-37、VEGF水平(试剂盒由上海生工生物工程有限公司提供),操作步骤:取出板条,留一空白孔,其余孔加入血清标本或不同浓度标准品50 μL,加入50 μL生物素标记的抗体;盖上模板后进行震荡混匀,经过37 ℃温育1 h后洗涤3次,加入80 μL酶结合物;37 ℃温育30 min后洗涤3次,加入100 μL底物;再37 ℃温育10 min,避光,最后取出酶标板,加入终止液,在450 nm波长处读取吸光度值(A值)。使用全自动生化检测仪(美国贝克曼库尔特公司生产)免疫比浊法测定血清LDH、β2-MG水平。
1.3 统计学处理

2 结 果
2.1 两组血清IL-37、VEGF、LDH及β2-MG水平比较
MM组血清IL-37水平低于对照组,VEGF、LDH、β2-MG水平均高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组血清IL-37、VEGF、LDH及β2-MG水平比较
2.2 不同ISS分期MM患者血清IL-37、VEGF、LDH及β2-MG水平比较
不同ISS分期MM患者血清IL-37、VEGF、LDH及β2-MG水平比较,差异均有统计学意义(P<0.05)。其中Ⅲ期MM患者血清IL-37水平低于Ⅰ期和Ⅱ期MM患者,血清VEGF、LDH、β2-MG水平高于Ⅰ期和Ⅱ期MM患者,差异有统计学意义(P<0.05);Ⅱ期MM患者血清IL-37水平低于Ⅰ期MM患者,血清VEGF、LDH、β2-MG水平高于Ⅰ期MM患者,差异有统计学意义(P<0.05),见表2。

表2 不同ISS分期MM患者血清IL-37、VEGF、LDH及β2-MG水平比较
2.3 MM患者化疗前后血清IL-37、VEGF、LDH及β2-MG水平比较
化疗后,MM患者血清IL-37水平高于化疗前,血清VEGF、LDH、β2-MG水平低于化疗前,差异有统计学意义(P<0.05),见表3。
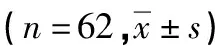
表3 MM患者化疗前后血清IL-37、VEGF、LDH及β2-MG水平比较
2.4 不同疗效MM患者血清IL-37、VEGF、LDH及β2-MG水平比较
对不同疗效MM患者血清IL-37、VEGF、LDH及β2-MG水平进行比较,其中PR、PD期MM患者血清IL-37水平明显低于CR患者,VEGF、LDH、β2-MG水平均明显高于CR患者(P<0.05);VGPR患者血清β2-MG水平明显高于CR患者(P<0.05),血清IL-37、VEGF、LDH水平与CR患者无明显差异(P>0.05),见表4。

表4 不同疗效 MM患者血清IL-37、VEGF、LDH及β2-MG水平比较
2.5 MM患者血清IL-37与β2-MG的相关性
将62例MM患者化疗前后血清IL-37和β2-MG进行Pearson相关分析,结果显示血清IL-37与β2-MG水平呈负相关(R2=0.737,P<0.05),见图1。

图1 MM患者化疗前后血清IL-37与β2-MG水平的相关性分析图
3 讨 论
MM是由于单克隆免疫球蛋白大量产生,进而导致的终末器官损伤性疾病。IL-37在模拟研究中被发现,是最新命名的白细胞介素-1(IL-1)家族细胞因子,属于IL-1家族的7号成员[13]。IL-37在浆细胞、单核细胞、巨噬细胞、树突状细胞、调节性T淋巴细胞等细胞中均有表达[14-15],能够抑制多种促炎因子,在自身免疫性疾病和感染性疾病中发挥作用[16-17]。近年来,研究还发现它参与肝癌[18]、宫颈癌[19]、胰腺癌[20]等多种实体肿瘤的发生、发展。在肿瘤中,IL-37可促进机体抗肿瘤免疫应答,抑制肿瘤血管新生和调节STAT3激活,通过抑制肿瘤增殖、迁移等多种方式发挥抗肿瘤作用。大量研究表明,血管新生在肿瘤发生、转移中发挥重要作用[21]。肿瘤血管随着正调控因素增强其生成不断增加,现有研究认为VEGF是促进血管生成能力最强的细胞因子,能够直接刺激内皮细胞(ECs)分裂增殖的血管ECs有丝分裂原,参与诱导肿瘤血管生成[22]。VEGF在实体肿瘤生长浸润和转移中的作用已得到广泛认可,血清VEGF水平升高提示肿瘤可能在短期内复发或转移[23]。同样也有研究显示,VEGF与血液系统肿瘤相关,在急性粒细胞白血病[24]、慢性淋巴细胞白血病[25]、骨髓增殖性肿瘤[26]等患者中也发现VEGF水平明显升高。因此,本研究通过检测不同分期、化疗前后MM患者血清IL-37、VEGF水平变化,探讨其与MM发生、发展的关系。
本研究中,MM患者体内IL-37呈低表达,采用ELISA法检测MM组和对照组血清IL-37水平,结果显示,初诊未治MM患者血清IL-37水平明显低于对照组;且Ⅲ期MM患者血清IL-37水平明显低于Ⅰ期和Ⅱ期。上述结果提示,IL-37水平与MM患者肿瘤负荷及疾病分期相关,与LI等[27]研究结果一致。本研究还分别检测了MM患者化疗前后IL-37水平,发现化疗后IL-37水平明显升高,化疗后CR期患者IL-37水平明显高于PR、PD期患者,提示可以通过检测血清IL-37水平变化预估MM患者近期化疗疗效。
VEGF是肿瘤生长和浸润的关键细胞因子,已有大量研究证实VEGF水平可以作为实体肿瘤病理分期、疗效评价、预后预测的重要指标之一。β2-MG是由机体有核细胞合成和分泌的小分子蛋白,代谢活跃的肿瘤细胞可以大量分泌β2-MG,国内外研究表明其能反映骨髓瘤细胞增殖活性,已经成为判断MM患者肿瘤负荷、疾病分期的重要指标之一[28]。血清LDH水平常与血液系统恶性肿瘤患者生存期相关,高水平LDH是MM患者的不良预后因素[29]。本研究同期检测了血清VEGF、LDH、β2-MG水平变化,结果显示,MM患者血清VEGF、LDH、β2-MG水平明显高于对照组,Ⅲ期MM患者VEGF、LDH、β2-MG水平明显高于Ⅰ期和Ⅱ期患者,提示血清VEGF、LDH可以和β2-MG一样作为MM患者评估肿瘤负荷及疾病分期的参考指标。本研究还分别测定了MM患者化疗前后VEGF、LDH、β2-MG水平,发现化疗后明显降低,且化疗后CR期MM患者VEGF、LDH、β2-MG水平明显低于PR、PD期MM患者,提示血清VEGF、LDH、β2-MG水平可以作为临床评估MM患者化疗疗效的指标,与金晓娜等[30]研究结果一致。
β2-MG能够反映骨髓瘤细胞增殖活性,是公认的MM肿瘤负荷、疾病分期、预后评估的可靠指标之一。本研究发现,MM患者血清IL-37水平明显低于对照组,在化疗后MM患者血清IL-37水平明显上升,疾病缓解程度越深,IL-37水平上升越明显,且血清IL-37水平与β2-MG水平呈负相关,提示IL-37和β2-MG一样,对MM诊断分期、病情变化和近期疗效的评估具有临床参考价值。
综上所述,血清IL-37、VEGF、LDH和β2-MG可能在MM发病机制中有重要作用,血清IL-37、VEGF、LDH和β2-MG水平变化与肿瘤负荷、疾病分期、近期疗效相关,并且上述指标检测简单快速、易操作,可能为临床诊疗工作提供有利的实验室依据。

