预后指数模型评价分化型胃癌根治术后辅助性化疗的应用价值研究*
敖栋基,明 艳,刘 奇,杨正益
(贵州省毕节市第一人民医院消化内科 551700)
胃癌为我国最常见的恶性肿瘤之一,全球范围每年新发胃癌近百万例,中国胃癌每年发病和死亡例数分别占全球胃癌发病和死亡例数的42.6%和45.0%,居全球胃癌发病率第5位,病死率第6位[1-3]。根据世界卫生组织(WHO)分型,将胃癌病理形态分为分化型(differentiated carcinoma,DCA)和未分化型(undifferentiated carcinoma,UCA),DCA胃癌的淋巴结转移及总体预后情况优于UCA[4],而无论是哪种类型的胃癌,胃癌根治性切除术仍是首选的治疗方法。胃癌预后较差,即使接受了根治性切除术,术后仍有50%~70%的患者发生胃癌复发或转移[4-5],因此正确有效的辅助性治疗对预防术后复发、转移具有非常重要的意义。术后辅助性化疗为目前胃癌术后应用最多的辅助手段,胃癌根治术后辅助性化疗的意义在于术后杀灭亚临床癌灶或脱落的癌细胞,以达到降低或避免术后复发和转移的目的[6]。但是,目前给予胃癌患者辅助性化疗仍存在较大争议,其主要困难在于特定患者的选择,是否胃癌患者术后均适合辅助性化疗,以及辅助性化疗是否会对不同患者的远期预后造成影响和使患者生存获益目前尚处于探索阶段,缺乏评估手段。本研究通过分析在本院接受胃癌根治术的178例DCA胃癌患者的临床病理资料,评估影响术后生存情况的独立预测因素,建立预测DCA胃癌根治术后5年生存情况的预后指数(PI)模型,以评价DCA胃癌根治术后辅助性化疗的应用价值,为改善手术疗效,以及术后辅助性治疗方法的选择与改进提供新思路。
1 资料与方法
1.1 一般资料
收集2010年1月至2013年12月在本院接受根治性手术治疗的178例DCA胃癌患者的临床病理资料。纳入标准:(1)年龄35~65岁,性别不限;(2)经影像和术后病理学证实为DCA胃癌;(3)初治患者且术前未经过任何抗肿瘤治疗;(4)按2010年美国癌症联合委员会(AJCC)胃癌TNM分期标准[6]分为Ⅰ~Ⅳ期(M0)。排除标准:(1)确诊时已有胃癌远处转移者;(2)合并其他恶性肿瘤者;(3)合并严重心、肺、肝、肾疾病者。178例患者中男110例(61.8%),女68例(38.2%);年龄35~68岁,平均(55±4)岁。本研究经本院伦理委员会批准,纳入的所有研究对象均知情同意。
1.2 方法
1.2.1治疗方法
本研究纳入患者的手术均由本院普通外科医师完成,严格遵循肿瘤根治原则,胃癌吻合方式包括毕Ⅰ式吻合、毕Ⅱ式吻合及Rouxen-Y吻合,根据术中淋巴结清扫范围分为标准术式的D2胃癌根治术、D3胃癌根治术、D1胃癌根治术及D0胃癌根治术。
1.2.2随访与资料收集
术后随访5年,随访终点为患者因胃癌死亡。收集患者临床病理资料,主要包括年龄、性别、癌胚抗原(CEA)、脉管侵犯、Borrmann分型、肿瘤位置和肿瘤最大径、术后病理T分期、术后病理N分期、网膜转移情况、手术方式及术后化疗情况等。
1.3 统计学处理
运用SPSS19.0统计软件进行统计分析,将纳入的所有患者根据临床病理特征进行分组,应用Kaplan-Meier生存分析中的寿命表法计算中位生存期和1、3、5年累积生存率;采用Log-rank法检验各组间差异,然后将单因素分析中有统计学意义的指标代入Cox模型进行多因素分析,获得影响患者术后5年生存情况的独立预后因素;根据独立预测因子结合其回归系数建立PI模型,运用受试者工作特征(ROC)曲线获得PI预测模型最佳诊断截点及ROC曲线下面积(AUC),根据PI预测模型最佳诊断截点将纳入的所有患者分为高、低危组;将PI值代入多因素Cox风险比例回归模型进行单因素分析和多因素校正,Kaplan-Meier生存分析曲线比较不同辅助性化疗情况分别在高、低危组的各阶段累计生存率变化情况,以P<0.05为差异有统计学意义。
2 结 果
2.1 患者随访结果
全组DCA胃癌患者术后年1、3、5年总生存率分别为84.1%、42.4%、21.5%,中位生存时间为27.8(9.4,44.5)个月。
2.2 单因素Kaplan-Meier生存分析
结果显示,不同年龄、T分期、N分期、网膜转移、肿瘤最大径、脉管侵犯、辅助化疗情况DCA胃癌患者术后1、3、5年累积生存率有明显差异(P<0.05),而不同性别、CEA水平、Borrmann分型、手术类型DCA胃癌患者术后生存率无明显差异(P>0.05),见表1。

表1 影响DCA胃癌患者术后5年生存情况的Kaplan-Meier单因素分析
2.3 多因素Cox回归分析
以DCA胃癌患者术后5年内死亡作为因变量,剔除辅助性化疗这一因素,将单因素分析中有统计学意义的指标作为自变量代入多因素Cox风险回归模型进行分析,校正和控制混杂变量后,筛选出对患者生存情况有明显影响的4个独立预后因素,即T分期(OR=2.08,95%CI:1.11~3.70)、N分期(OR=2.24,95%CI:1.86~2.97)、肿瘤最大径(OR=1.87,95%CI:1.61~3.34)、网膜转移(OR=2.68,95%CI:1.29~3.95)是增加患者5年死亡风险的独立危险因素,其中T分期每增加1个等级患者5年内死亡风险增加1.08倍,肿瘤最大径每增加1 cm患者5年内死亡风险增加0.87倍;而年龄、脉管侵犯2个单因素分析中有统计学意义的指标未进入校正Cox风险回归模型,见表2。

表2 影响DCA胃癌患者术后5年生存情况的Cox多因素分析
2.4 辅助性化疗的单因素分析和多因素校正
对辅助性化疗这一指标进行单因素分析及多因素校正(校正指标包括辅助性化疗和剔除多因素分析中有统计学意义的指标后剩余的8个指标),分析结果显示,在校正的Cox回归模型中,辅助性化疗进入到最后的模型,对生存预后具有明显影响,其校正后的OR=0.51,即术后未行辅助性化疗5年内死亡的风险约为行辅助性化疗的1.9倍(P<0.05),见表3。

表3 辅助性化疗的单因素分析和多因素校正
2.5 PI模型的建立和多因素校正
根据独立预测因子及其量化权重(β值)建立PI模型:PI=0.54×X1(T1~2=1,T3=2,T4=3)+0.64×X2(否=0,是=1)+0.42×X3(cm)+0.81×X4(否=0,是=1),方程中的变量X1、X2、X3、X0分别对应T分期、N分期、肿瘤最大径、网膜转移,PI值的范围为0.88~5.14,PI模型预测术后5年生存情况的ROC曲线见图1,AUC为0.835(0.713~0.943),PI模型最佳诊断截点为1.78,以PI值大于1.78作为判断患者5年内死亡的标志,记为高危组,PI值小于或等于1.78作为判断患者5年内存活的标志,记为低危组,将PI模型代入Cox风险回归模型进行单因素分析和多因素校正,最终PI模型成为独立预测因子,PI值每增加1个单位该类患者5年内死亡的风险将增加1.89倍(P<0.05),见表4。
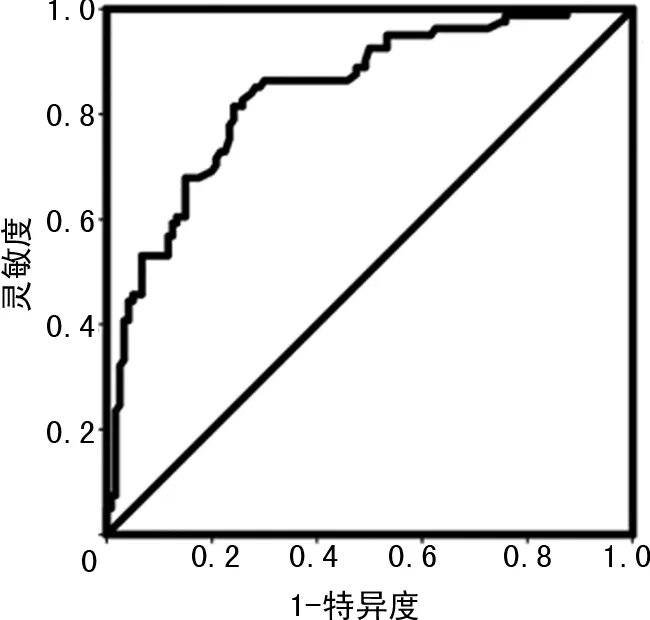
图1 PI模型判断术后5年生存预后的ROC曲线

表4 PI模型的单因素分析和多因素校正
2.6 Kaplan-Meier生存分析和Log-rank检验
Kaplan-Meier生存分析和Log-rank检验结果显示,低危组化疗患者1、3、5年累积生存率分别为100.0%、54.8%、31.5%,中位生存时间为38.4(16.7,53.5)个月;非化疗患者1、3、5年累积生存率分别为92.6%、47.1%、37.8%,中位生存时间为32.8(18.1,50.4)个月,化疗与非化疗患者1、3、5年累积生存率比较无明显差异(χ2=1.53,P>0.05)。高危组化疗患者1、3、5年累积生存率分别为85.4%、24.7%、7.9%,中位生存时间为22.4(8.4,41.3)个月;非化疗患者1、3、5年累积生存率分别为81.3%、0、0,中位生存时间为10.1(3.5,26.5)个月,化疗患者1、3、5年累积生存率明显高于非化疗患者(χ2=14.83,P<0.05),见图2。
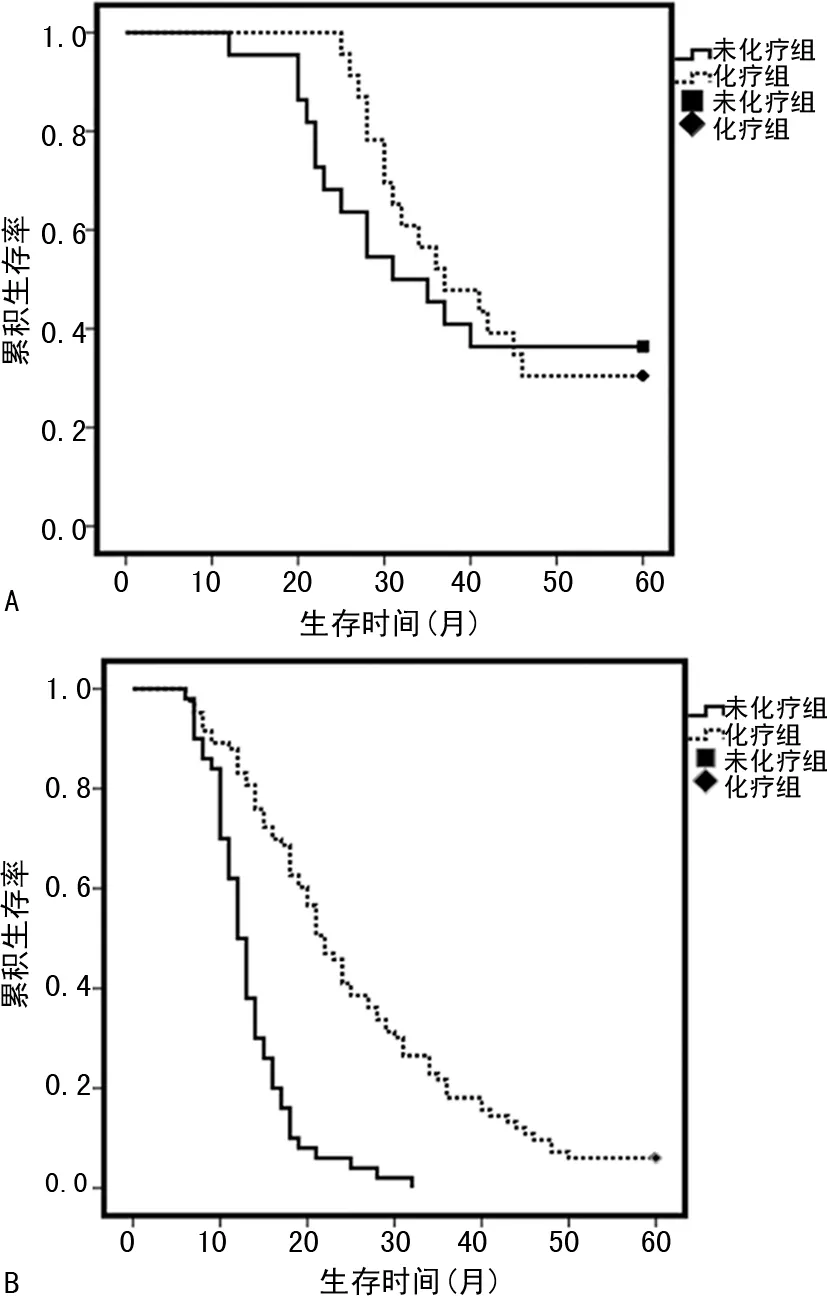
A:低危组;B:高危组。
3 讨 论
胃癌发病率和病死率高,预后差,目前分析影响胃癌预后的因素已成为研究热点。已有研究显示,胃癌预后与肿瘤大小、肿瘤部位、Borrmann 大体分型、病理类型、分化程度、脉管侵犯、辅助化疗、TNM分期、基因学特性等因素密切相关[7-10],但这些因素在疾病预后中的意义尚存在争议,可能与试验设计、样本量、各种偏倚等有关。无论早期胃癌还是进展期胃癌,根治性切除仍是首选的治疗方法,合理的淋巴结清扫联合辅助性化疗是胃癌根治性手术的关键,也是影响胃癌患者长期生存的因素[11-12]。
TNM分期包括肿瘤局部浸润深度和淋巴结转移情况,体现了肿瘤负荷、侵袭潜能及生物学特性,为国内外学者公认的影响胃癌患者术后生存情况的关键因素[13-15]。本研究多因素分析中,T分期和N分期均为影响DCA胃癌根治术后患者生存情况的独立预测因素,与以上文献报道一致。为了更好地反映预后因素与因变量的关系,并且使它们之间的关系量化,将T分期按照等级变量分为3个等级,结果显示,T分期每增加1个等级患者5年内死亡的风险将增加1.08倍。马海波等[16]分析了309例胃癌患者的临床病理资料,发现网膜转移和肿瘤大小也是影响胃癌全切患者术后生存情况的重要因素。本研究结果显示,肿瘤最大径每增加1 cm患者5年内死亡风险将增加0.87倍,网膜转移患者5年内死亡风险是非网膜转移患者的2.68倍,再次证实了以上观点。
术后辅助性化疗的目的在于消灭术后残癌灶或癌前病变组织,以达到预防余胃新生肿瘤的目的,降低术后肿瘤复发与转移的概率,进而改善手术疗效,延长患者生存期[6]。目前多数随机临床试验结果提示,术后辅助性化疗可使胃癌患者的生存获益[17-18]。本研究单因素分析结果显示,化疗患者5年累积生存率和中位生存时间均高于非化疗患者;多因素分析显示,辅助性化疗是影响患者5年生存预后的独立保护因素。然而,目前胃癌术后辅助性化疗仍缺乏明确的指征和合理使用的评判标准,如何选择术后辅助性化疗的适用人群,仍是目前亟待解决的问题。因此,本研究基于多因素分析得出的4个独立预后因素并结合其影响权重(β值)建立了PI模型,全面综合地反映了患者临床病理学特征(肿瘤负荷、侵袭潜能和生物学特性)。将PI模型代入Cox回归模型分析,结果显示,PI值每增加1个单位,患者术后5年内死亡风险将增加1.89倍,对胃癌术后患者的生存预后具有较强的指导意义,具有前瞻性。
根据PI模型最佳诊断截点,本研究将纳入的所有患者分为高危组与低危组,Kaplan-Meier生存分析和Log-rank检验结果显示,对于PI值小于或等于1.78的低危组患者,化疗者和非化疗者1、3、5年的累积生存率无明显差异,说明术后辅助性化疗并不能给这些患者带来明显的生存获益,推荐定期随访,不予以术后辅助性化疗;而对于PI值大于1.78的高危组患者,化疗者各阶段累积生存率明显高于非化疗者,提示术后辅助性化疗可明显提高5年生存率和生存时间,为患者带来明显的生存获益。
综上所述,临床上应依据胃癌患者具体情况选择辅助性化疗,制订个体化辅助性化疗方案,同时慎重考虑,有的放矢。本研究团队从临床病理角度建立PI模型,根据PI模型最佳诊断截点进行分组,以此判断术后辅助性化疗的适用人群,为术后实施辅助性化疗提供明确的指征和方向,有助于胃癌术后辅助性化疗在临床的合理应用,但仍需更大样本的临床研究和更多的循证医学证据来验证。

