高转化大豆异黄酮乳酸菌的筛选及在豆乳中的发酵特性
黄玉军,周帆,于俊娟,李颖华,顾瑞霞
(扬州大学江苏乳品生物技术与安全控制重点实验室,江苏 扬州 225127)
大豆异黄酮是大豆在生长过程中形成的一种次级代谢产物,又称植物雌激素,可以抗抑郁[1]、预防心血管疾病[2]、预防骨质疏松症[3-4]、预防并改善乳腺癌、前列腺癌[5]、缓解更年期综合症、神经保护作用[6]等。已发现的大豆异黄酮有12种,其中3种为游离型苷元结构(2%~3%),能被小肠上皮直接吸收,生物活性较高,是人体可以利用的有效形式,如大豆苷元、染料木素、黄豆苷等,剩余为结合型糖苷结构(97%~98%),不能被人体小肠有效吸收,生物利用度极低(<5%),如大豆苷、染料木苷、黄豆苷元等[7]。大豆异黄酮的形态结构是决定其生理活性和生物利用率的关键因素,因此,当前研究热点主要集中于将结合型糖苷转化为游离型苷元。
水解大豆异黄酮的酶有β-葡萄糖苷酶、α-半乳糖苷酶、葡萄糖酸酶、生物乳糖酶等,前人研究较多的是β-葡萄糖苷酶,可将外源糖苷转化为相应的苷元和葡萄糖[8]。酶水解大豆异黄酮反应条件温和,具有很强的专一性,但成本较高[9]。微生物繁殖周期不长,可以实现工业化,降低高额酶成本[10]。自然界中已发现的产β-葡萄糖苷酶的真菌有黑曲霉、红酵母、米曲霉等,其中产β-葡萄糖苷酶效率最高的是黑曲霉。然而,大部分霉菌如黑曲霉并不是食品安全级菌株,如果要将产β-葡萄糖苷酶菌株应用于食品中,乳酸菌更为合适。食品级的乳酸菌发酵能力和微生物转化是功能性代谢产物富集的关键。乳酸菌中β-葡萄糖苷酶活性较高的有干酪乳杆菌、加式乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌和植物乳杆菌等[11]。
传统乳产品销售正在逐年下降,而植物基饮料正在冲击市场[12],营养与口感兼备的豆乳或将成为素食主义和乳糖不耐受人群的首选代乳产品。豆乳经发酵后既能发挥大豆的营养及功能特性,又能利用乳酸菌的益生作用产生许多大豆中原本没有的营养物质,乳酸菌含有的β-葡萄糖苷酶还可以水解大豆异黄酮的糖苷结构向生物活性更高的游离型结构转化,大大提高了大豆异黄酮的生物利用率。
本研究旨在筛出高转化大豆异黄酮的乳酸菌,并研究其在豆乳中的发酵特性,实现大豆异黄酮糖苷向苷元的转化,以增加发酵豆乳中大豆异黄酮苷元含量,提高生物活性和利用度,为研制富含功能活性物质的发酵豆乳提供新思路。
1 材料与方法
1.1 材料试剂
140株乳酸菌:江苏省乳品生物技术与安全控制重点实验室保存;大豆、白砂糖:扬州市邗江区永辉超市;七叶苷、二甲亚砜:生工生物工程(上海)股份有限公司;染料木素、大豆苷元标准品:上海源叶生物科技有限公司;柠檬酸铁、甲醇、磷酸(色谱纯)、乙腈(色谱纯):国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器设备
恒温培养箱(DNP-9272型):上海精宏实验设备有限公司;高压均质机(APV1000型):美国SPX集团;离心机(H1650-W型):湖南湘仪实验室仪器开发有限公司;超纯水系统(milli-Q direct 8型):法国Millipore公司;高效液相色谱仪(1260 Infinity型):美国Agilent Technologies公司;酸度计(PHS-3E型):上海雷磁仪器厂;凝胶图像分析系统(3026型):法国VILBER公司;聚合酶链式反应(polymerase chain reaction,PCR)仪(Nexus+x2eco型):德国艾本德公司。
1.3 试验方法
1.3.1 乳酸菌的活化
将甘油保存的供试菌株接种至MRS液体培养基中,37℃培养18 h,活化传代2次,以保证使用前菌株的活力充分恢复。
1.3.2 产酶菌株筛选
配制七叶苷和柠檬酸铁的特殊琼脂培养基,在MRS液体培养基中添加质量分数0.3%的七叶苷和0.05%的柠檬酸铁,再加1.8%的琼脂,灭菌后在60℃左右趁热加注250 μL到96孔板的每个孔里。等平板凝固后取培养24 h的乳酸菌液10 μL按编号次序加到96孔板中。倒置48 h培养后孔洞变成黑色的则为产β-葡萄糖苷酶菌株[13]。
1.3.3 豆乳发酵工艺
除杂→清洗→浸泡[干豆∶水=1∶3(g/mL),4 ℃,14 h]→热烫(0.5% NaHCO3溶液,6 min)→磨浆[湿豆∶水=1∶7(g/mL)]→过滤(120目)→煮沸→均质(20 MPa)→灭菌(105℃,15 min)→冷却→接种(1.0×107CFU/mL)→发酵(37℃发酵至pH 4.50)→冷藏(4℃,24 h)
1.3.4 豆乳发酵特性
1.3.4.1 基本理化指标
豆乳pH值:使用pH计测定;豆乳酸度:参照GB 5009.239—2016《食品安全国家标准食品酸度的测定》[14];豆乳乳酸菌总数:参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》[15];
1.3.4.2 持水力测定
空白离心管质量记为W0,称取质量W1的发酵豆乳样品于离心管,4000r/min,离心10min,静置10min弃上清后质量记为W2,采用如下公式计算样品持水力[16]。

式中:W0为离心管质量,g;W1为离心前样品和离心管总质量,g;W2为离心后样品和离心管总质量,g。
1.3.4.3 大豆异黄酮测定
1)样品处理
取发酵豆乳5 mL于50 mL容量瓶中,加入80%甲醇溶液至接近刻度。超声波萃取20 min,用80%甲醇定容,摇匀取样品溶液置于离心管中,8 000 r/min离心15 min。取上清过0.45 μm滤膜,收集滤液进高效液相色谱(high performance liquid chromatography,HPLC)系统测定[17]。
2)色谱条件
色谱柱:C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈;磷酸水溶液(pH 3.0);流速:1.0 mL/min;紫外检测波长:260 nm;进样量:10 μL;柱温:30 ℃。梯度洗脱条件见表1。
1.3.5 乳酸菌的鉴定
将乳酸菌接种到MRS液体培养基中,37℃培养18 h,试剂盒提取乳酸菌的DNA。采用细菌鉴定的通用引物进行16S rDNA基因片段扩增,扩增完成后,用1%的琼脂糖凝胶电泳检测,得到目的条带后,扩增产物送去测序鉴定。将菌株测序结果登录美国生物技术信息中心(National Center for Biotechnology Information,NCBI)进行序列比对,并用MEGA-X软件绘制系统发育树。

表1 梯度洗脱条件Table 1 Conditions of gradient elution
1.4 数据分析
同一样品平行测定3次,试验结果为3次测定结果的平均值,采用SPSS19.0软件处理数据,运用ANOVA进行显著性分析,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 产酶菌株筛选结果
在β-葡萄糖苷酶作用下,七叶苷水解成葡萄糖和七叶素,七叶素可与Fe3+反应呈现棕黑色[18]。将实验室保存的140株供试菌株接种于添加七叶苷和柠檬酸铁的特殊固体培养基,培养48 h后变为棕黑色的孔,即为产酶目标菌株,根据颜色深浅初步判断酶活高低,结果表明产酶目标菌株一共有12株,菌株编号分别为11、39、54、58、117、128、m64、m91、m113、Y-5、A28 1-2、90-2-2。
2.2 高转化菌株复筛结果
2.2.1 发酵豆乳大豆异黄酮变化
分别将12株乳酸菌按1.0×107CFU/mL接种量接入豆乳,测定原豆乳和不同菌株发酵豆乳后大豆苷元、染料木素的含量。原豆乳、发酵豆乳高效液相色谱图分别见图1、图2。
图1 原豆乳高效液相色谱图Fig.1 The chromatogram of HPLC of soybean milk
乳酸菌发酵产大豆异黄酮苷元的能力以发酵后豆乳中大豆苷元和染料木素的总量来表示,不同菌株发酵豆乳大豆异黄酮苷元总量如图3所示。

图2 发酵豆乳高效液相色谱图Fig.2 The chromatogram of HPLC of fermented soybean milk
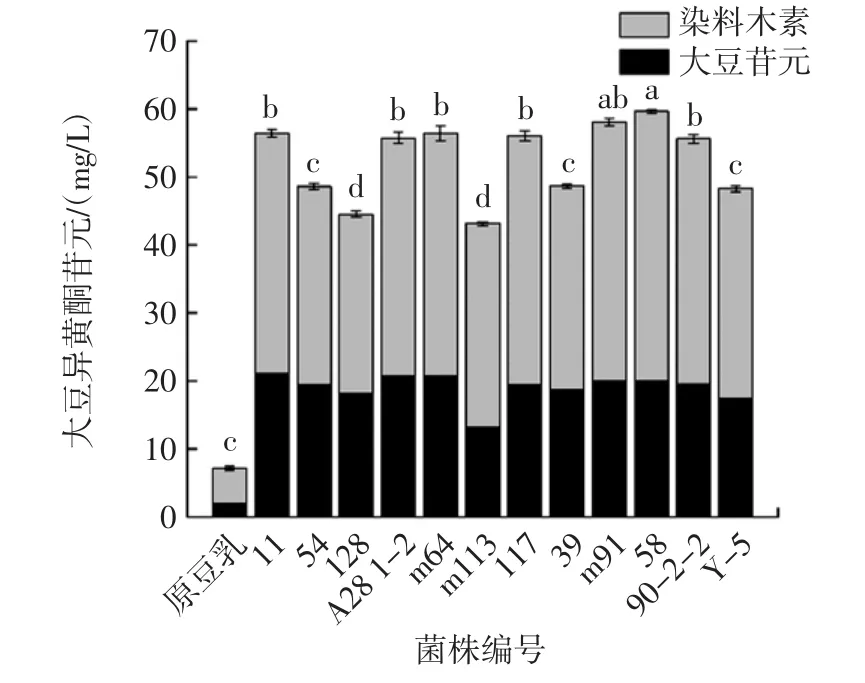
图3 不同菌株发酵豆乳大豆异黄酮苷元总量Fig.3 Content of isoflavone aglycone in soybean milk fermented by different bacteria
原豆乳中大豆异黄酮苷元总量为7.15 mg/L,豆乳经产酶目标菌株发酵后大豆异黄酮苷元总量均有显著提高(P<0.05)。翟清燕等[19]将不同菌株用于发酵豆乳,得到一株大豆异黄酮苷元产量最高的乳酸菌,约为原豆乳的8倍。本研究中,有7株乳酸菌发酵后大豆异黄酮苷元总量在55 mg/L以上,其中产大豆异黄酮苷元能力最强的是菌株58,显著高于除菌株m91外的10株菌。菌株58发酵后大豆异黄酮苷元总量达59.64 mg/L,约为原豆乳的8.25倍,菌株m91次之,总量达58.06 mg/L,约为原豆乳的8.12倍。菌株128、m113发酵产大豆异黄酮苷元能力最弱,发酵后大豆异黄酮苷元总量不到45.00 mg/L。
2.2.2 发酵豆乳基本特性
2.2.2.1 发酵豆乳pH值变化
以pH值降至4.50为发酵终点,12株乳酸菌发酵过程中pH值变化见图4。
如图4所示,菌株128、A28 1-2、m113和58发酵豆乳样品pH值下降趋势明显,到达发酵终点(pH 4.50)用时较短,均小于12 h,菌株11、54和39发酵豆乳样品到达发酵终点用时次之。菌株m64、117和m91发酵豆乳样品pH值下降速率缓慢,到达发酵终点均在18 h以后。乳酸菌营养要求苛刻,自身蛋白水解能力较弱,因此单独发酵时间较长是一种较普遍的现象[20-21]。
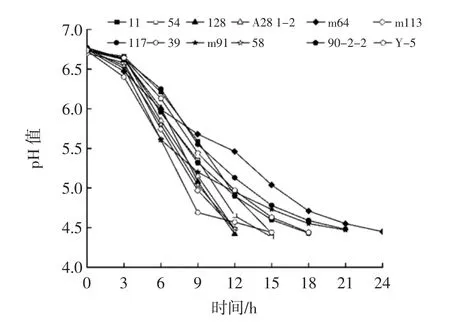
图4 不同菌株发酵豆乳pH值变化Fig.4 pH change of soybean milk fermented by different strains
2.2.2.2 发酵豆乳酸度变化
以pH值降至4.50为发酵终点,12株乳酸菌发酵过程中酸度变化见图5。

图5 不同菌株发酵豆乳酸度变化Fig.5 Acidity change of soybean milk fermented by different strains
可滴定酸度反应了包括肽段和游离氨基酸残基在内的所有酸性基团的总和[22]。如图5所示,除菌株54发酵豆乳样品外,另外11株乳酸菌的发酵豆乳样品酸度均为30.00°T以上,所有乳酸菌发酵豆乳样品的酸度在3 h后上升趋势明显。菌株58到达发酵终点的酸度最高,为35.01°T,菌株90-2-2、m91发酵豆乳样品的酸度稍低于菌株 58,分别为 34.38 °T,34.01 °T。菌株54发酵豆乳样品的酸度最低,为29.89°T。豆乳中糖类主要是水苏糖、棉子糖和蔗糖,缺少乳酸菌生长所需的乳糖,乳酸菌不能大量生长繁殖而产生足够乳酸,因此发酵豆乳酸度偏低[23]。
2.2.2.3 发酵豆乳活菌数
以pH值降至4.50为发酵终点,12株乳酸菌发酵前后豆乳活菌数变化见图6。

图6 不同菌株发酵豆乳活菌数变化Fig.6 Viable count of soybean milk fermented by different strains
发酵豆乳中乳酸菌活菌数在出厂期须达106CFU/mL以上[24],如图6所示,发酵初12株乳酸菌发酵豆乳样品活菌数无显著性差异,而发酵末活菌数都显著提高(P<0.05)。其中,菌株A28 1-2发酵豆乳样品活菌数变化值最大,发酵末活菌数最高,达8.84 lg(CFU/mL),菌株58发酵末活菌数为8.78 lg(CFU/mL),显著高于菌株 m91,菌株m91为8.55 lg(CFU/mL)。菌株m64发酵豆乳样品活菌数变化值最小,发酵末活菌数最低,仅8.39 lg(CFU/mL)。
2.2.2.4 发酵豆乳持水力
以pH值降至4.50为发酵终点,12株乳酸菌发酵豆乳持水力见图7。

图7 不同菌株发酵豆乳持水力Fig.7 Water holding capacity of soybean milk fermented by different strains
如图7所示,除菌株11、54、m64,另外9株菌的发酵豆乳样品持水力都达30.00%以上。其中,菌株58发酵豆乳样品的持水力显著高于除菌株A28 1-2的另外10株菌,持水力为35.10%,菌株A28 1-2次之,持水力为34.70%。菌株11发酵豆乳样品持水力最低,仅为29.17%。发酵豆乳持水力是由蛋白质三维网状结构的凝胶状态形成的,蛋白质是将流动性较好的豆乳转化为半固态发酵豆乳的微观物质基础[25]。持水力低可导致乳清析出,影响产品感官及风味残留。
2.3 优选乳酸菌鉴定结果
根据菌株发酵豆乳后大豆异黄酮苷元含量高低,并结合其发酵特性分析,故选用菌株58为高转化大豆异黄酮优选乳酸菌。将纯度符合要求的优选乳酸菌DNA进行PCR扩增,用1%琼脂糖凝胶电泳检测扩增产物浓度。检测结果如图8所示,菌株在1 500 bp左右出现非常清晰的条带,无特异性扩增,且亮带无弥散、拖尾现象。

图8 PCR扩增产物凝胶电泳图Fig.8 Gel electrophoresis for PCR
将菌株58的16S rDNA基因序列与GenBank种的序列进行比对,发现与乳杆菌属成员具有较高的序列相似性,用Neighbor Joining方法构建的系统发育树如图9所示。表明菌株58与植物乳杆菌种亲缘关系密切,序列相似性达100%,因此,根据16S rDNA基因序列和系统发育分析,将菌株58初步鉴定为植物乳杆菌。

图9 菌株58和相关细菌16S rDNA基因序列系统发育树Fig.9 Phylogenetic tree based on 16S rDNA sequence of strain 58 and related strains
3 结论
本研究在140株人源乳酸菌中筛出12株产β-葡萄糖苷酶菌株,利用12株产酶目标菌株发酵豆乳,比较不同菌株发酵豆乳产大豆异黄酮苷元的能力,得出2株高转化大豆异黄酮菌株58和m91,发酵后大豆异黄酮苷元含量均是原豆乳的8倍以上,分别为59.64、58.06 mg/L。对乳酸菌在豆乳中发酵特性的分析发现,菌株58无论是从产酸速率,发酵末活菌数[8.78 lg(CFU/mL)]和持水力(35.10%)方面均显著优于其余菌株。经16S rDNA测序鉴定,优选菌株58为植物乳杆菌。高转化大豆异黄酮乳酸菌的筛选及其应用可实现发酵豆乳中大豆异黄酮糖苷向高生物活性和利用度大豆异黄酮苷元的转化,对提高发酵豆乳功能营养特性具有重要的指导意义,其发酵转化大豆异黄酮最佳条件值得进一步探究并完善。

