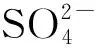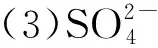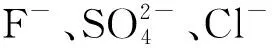埋葬土壤中阴离子含量分布特征及对金属文物的影响
乔嘉伟,张晓凤,杨耀贵,黄腾腾
(长安大学 水利与环境学院 旱区地下水与生态效应教育部重点实验室,陕西 西安 710064)

1 实验部分
1.1 材料与仪器
NaF、NaCl、KNO3、Na2SO4均为分析纯。
ICS2000离子色谱仪,配置RFIC-EGC II氢氧化钾淋洗液自动发生器;IonPac®AS11-SH阴离子分析柱;ASRS®ULTRAII阴离子抑制器;色谱工作站;0.45 μm微孔滤膜;On Guard II RP柱(C18柱);OnGuard®II P 柱;HZQ-C恒温振荡器;80-2B低速台式离心机。
1.2 色谱条件
阴离子设定压强约为13.28 MPa,氢氧化钾淋洗液的浓度为100 mmol/L。色谱柱温度为30 ℃,每次进样量25 μL。
1.3 实验土样的来源
土样取自甘肃省某墓地中的土壤。取样前将土壤表面的浮土去除后再挖去一定量的土样。从距地表0.3 m处开始取样,到地下7.05 m之间均匀取10个样,且每个样都往里推进0.5 m。各采样点分别标记为TY1-TY10。各采样点见图1。

图1 采样点Fig.1 Sampling point
1.4 土样预处理
土样经自然风干后,除去石块和动植物残体,过0.15 mm(100目)的土壤筛。每份土样分别准确称取2.000 0 g于离心管中,并加10.00 mL超纯水,振荡8 min后离心3 min,重复提取3次。上清液过0.45 μm微孔滤膜,收集提取液待进机测定。实验设置3个平行样,取平均值。
2 结果与讨论
2.1 色谱行为
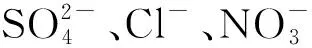
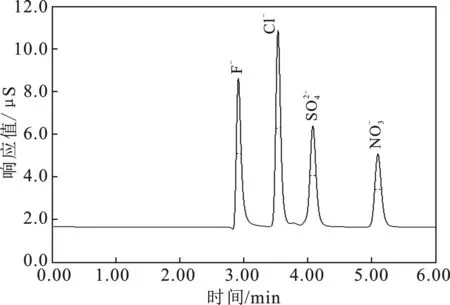
图2 混合标准溶液的色谱图Fig.2 Chromatographic diagram of mixing standard solution
由表1可知,4种阴离子线性回归方程的相关系数都>0.999。因此该标准曲线数据可用于测定土样中的阴离子含量。
若所测定土样的阴离子浓度不在标曲范围内时,将土样提取液进行适当稀释,重新在该标曲下进行测定离子含量。

表1 4种阴离子回归方程Table 1 Four anion regression equations
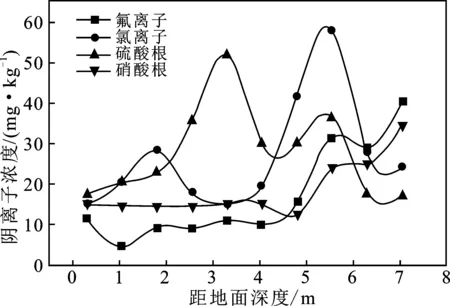
图3 四种阴离子随距地面深度的变化Fig.3 Variation of the four anions with thedepth from the ground
土壤中氟的主要来源于岩石的风化和废弃物中的氟间接地进入土壤环境[5]。由图3可知,氟离子浓度在近地面趋于稳定,维持在10 mg/kg左右。土壤中F-含量从地下4 m开始,F-含量随深度增加出现缓慢增加的趋势。在深度为7 m时,TY10中高达40.5 mg/kg,与大多数土壤剖面中F-含量变化规律吻合[6]。表层土壤(距地面0.3 m)的含氟量较高的原因可能是由于该墓地处于中国西北部,降水量小,土壤的淋溶作用较弱,蒸发作用较强而导致的[7]。
Cl-含量与土壤深度没有呈现出规律性的变化。在近地面处,Cl-含量在20 mg/kg之间波动,土壤中Cl-含量随着埋葬深度的增加呈现先增加后减小的趋势,并在距地面5.55 m处Cl-含量达到峰值,高达60 mg/kg,这可能是由于土壤水分蒸发作用变小,土壤质地黏重,Cl-移动缓慢,导致大量Cl-富集。从地下5.5 m处氯离子浓度在降低,这有可能是水的流动性较强,且氯离子的水溶性强[8],导致大量的氯离子流失。
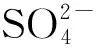
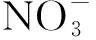
2.3 土壤中和对文物的影响机理研究
整体上看,随着深度的增加,埋葬土壤中四种阴离子的含量呈增大的趋势,而且通过对挖掘出来的金属文物腐蚀情况对比发现,越深处金属腐蚀越严重,这也间接地表明了土壤中阴离子会对金属文物造成一定的腐蚀。
铁器或青铜类文物受埋葬土壤中阴离子的影响较大。其原理主要是在环境条件变化下金属文物中的阳离子会与埋葬土壤中阴离子发生电化学反应,破坏了文物的结构,进而引起腐蚀。从电化学角度来讲,一方面,土壤中阴离子作为电解质参与导电过程;另一方面,一部分阴离子直接参与电化学反应,或是与金属离子结合生成次生产物,进而影响电化学反应过程[1],故土壤中阴离子对金属腐蚀较强。
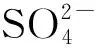
第一种是硫酸盐还原细菌(SRB菌)等微生物加剧了铁器的腐蚀:
2FeSO4+4NaOH+O2→
Fe2O3·H2O2+Na2SO4+H2O
第二种是硫酸根作为一种催化剂,加速了铁的氧化:
2H2O+O2+4e-+4Na+→ 4NaOH
这些阴离子不仅会对金属文物造成腐蚀,而且还会对石质和土质文物造成一定的影响[12]。硫酸钠在温度发生变化时会产生不同的结晶体,当温度低于32.4 ℃时,硫酸钠结晶析出,变成芒硝;当温度高于32.4 ℃时,芒硝脱水分解[13]。结晶与脱水过程的循环出现,变相的起到了“蒸发”溶剂的作用,进而使周围膨胀,最后导致石质和土质文物变疏松。而氯化钠的结晶压力过大,会造成土质文物表面起皮,甚至有片状脱落[14]。在距地面3 m处的土质疏松可以印证这个说法。
微观角度而言,NaCl和KCl等可溶性盐的溶解性较好,Cl-浓度大,离子半径小,能穿过金属表面的氧化膜,进而取代氧化物中的氧原子[15],使本来具有保护作用的氧化膜成为可溶性氯化物,从而向反应溶液提供了大量金属表面活性中心,导致了金属文物发生阳极氧化过程。Cl-在青铜的腐蚀中扮演着极其重要的角色,这是由于金属铜与土壤中的Cl-发生电化学作用,产生米白色的CuCl腐蚀产物,金属铜的腐蚀与土壤中Cl-浓度的影响较为显著[16]。地下潮湿的环境中,生成的CuCl会进一步发生转化:
2CuCl+H2O→Cu2O+2HCl
或2CuCl+H2O→CuO+Cu+2HCl
Cu2O和CuO与HCl之间可以发生交叉作用,一方面,反应生成的Cu2O和CuO会溶解于HCl中,促使上述反应正向进行;另一方面,在有氧的条件下,Cu会与生成物HCl发生反应:
4Cu+4HCl+O2→ 4CuCl+2H2O
通过腐蚀产物的交叉和转化的循环过程,从而加剧青铜器的腐蚀。另外,米白色的CuCl腐蚀产物,还可以转化为浅绿色的粉状腐蚀物,转化机理为:
4CuCl+4H2O+O2→CuCl2·3Cu(OH)2+2HCl
8CuCl+6H2O+O2→ 4CuCl·Cu(OH)2+4HCl
反应产生的盐酸,加速Cu2O和CuO的溶解,上述平衡体系中CuCl的减少同时又促使Cu发生电化学反应,生成CuCl,金属文物在循环作用下,变得更加腐蚀。其他条件相同时,Cl-浓度变大,自腐蚀电位(E0)负移,自腐蚀电流密度(i0)增大,耐蚀性能下降。铸铁和青铜的腐蚀速率也就越大[17]。
Cl-与铁器发生反应:
Fe+2Cl-→FeCl2+2e
2H2O+O2+4e→ 4OH-
4FeCl2+8OH-+O2→
2Fe2O3·H2O+8Cl-+2H2O
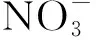
2.4 防护与保护
墓葬土壤中的阴离子对地下铁质文物和土质文物会有一定的腐蚀性,因此对于地下文物保护可以从阴离子方面入手。比如通过某种措施来减少土壤中的盐分或者控制地下温度来更好的保护地下文物。
3 结论