Vinculin促小鼠肝星型细胞活化作用
邹韵涵 崔慧情 丘颖琛 李筱迪 龙子昕 曹智铭 马宁芳 刘珊珊
病毒、寄生虫、酒精等均可对肝脏造成损伤并引起肝纤维化,其表现为细胞外基质过量沉积,汇管区纤维异常增生,继而假小叶和再生结节形成,是各种慢性肝病向肝硬化发展所共有的病理改变和必经途径[1-2]。肝星形细胞(hepatic stellate cells,HSC)活化是肝纤维化发生发展的关键环节[3-4]。HSC围绕在肝窦周围,正常状态下,HSC在肝内处于静息状态;在肝损伤因子刺激后,HSC活化为肌成纤维样或成纤维样细胞,活化的HSC增生并向损伤区域迁移,表达各种细胞外信号转导通路蛋白,并产生大量以胶原纤维为主的ECM,进而导致肝纤维化形成[4]。及时采取有效措施干预其活化过程对阻断肝纤维化进展至关重要。
细胞骨架蛋白纽蛋白(Vinculin)是一种黏着连接相关蛋白,存在于细胞-细胞及细胞-细胞外基质间的黏着部位,其作用是将纤维状肌动蛋白锚定于连接点胞膜上,通过与多种细胞骨架蛋白、黏着斑蛋白的相互作用,在细胞黏附、迁移、增殖等过程中发挥关键作用[5-6]。有研究发现在肺纤维化区域的肺泡上皮细胞及间质细胞中Vinculin表达增强[7],提示Vinculin蛋白可能参与了纤维化过程,但具体机制不清。本研究探讨Vinculin与HSC活化是否有关,深入解读肝纤维化分子机制,为优化临床治疗策略提供新思路。
材料与方法
一、实验材料
Vinculin-siRNA(广州市锐博生物科技公司),一抗稀释液(上海市碧云天生物技术有限公司),兔抗Vinculin单克隆抗体(英国abcom公司),兔抗α抗com多克隆抗体(中国BOSTER公司),鼠抗Desmin单克隆抗体(中国BOSTER公司),兔抗GAPDH 单克隆抗体(美国CST公司),羊抗兔二抗(美国Pierce公司),羊抗鼠二抗(美国Pierce公司)。
二、实验方法
(一)细胞培养及siRNA瞬时转染 人源性肝星形细胞株LX-2在10%胎牛血清和1%青霉素-链霉素的1640培养基37 ℃、体积分数为0.05的CO2、条件下培养。Vinculin siRNA序列如下,siRNA1:GCACAGCGGTGGATTGATA,siRNA2:CTCGTA-TCTTACTTAGGAA,Scramble:Vinculin无关序列。
(二)RT-qPCR检测 根据NCBI上Vinculin已知序列,用premier5设计引物,所用引物序列如下:Vinculin Forward AACCAGTATTGCTCGTCGGG,Vinculin Reverse GAGGCGGCGGGAAGTC;desmin Forward AGCCAACAAGAACAACGACG,desmin Reverse TTCCCGCATCTGCCTCAT;α-SMA Forward GGGGTGATGGTGGGAATG,α-SMA Reverse GCAG-GGTGGGATGCTCTT。
(三)蛋白质印迹检测 一抗稀释液稀释兔抗Vinculin 124 kDa(1∶10 000), 鼠抗DESMIN 50-55 kDa(1∶50),兔抗α-SMA 50-55kDa(1∶50),兔抗GAPDH 37 kDa(1∶2000),获取图片后以目标蛋白与内参蛋白GADPH的灰度比作为目标蛋白的相对表达值。
(四)ELISA检测 按照ELISA试剂盒操作说明书检测上清液人Ⅰ型胶原蛋白(Col Ⅰ)含量。以所测标准品A值为横坐标,标准品的浓度为纵坐标,用相关软件绘制曲线,并取得直线回归方程,将样品的A值代入方程,计算出样品待测指标浓度。
(五)小鼠肝纤维化模型 清洁级健康成年雄性昆明小鼠30只,体质量25~28 g,购于广东省动物中心。小鼠随机分为对照组(n=5)和实验组(n=15)。实验组皮下注射四氯化碳-粟米油混合液(6 mL/kg),2次/周,对照组皮下注射同等剂量的粟米油。于造模8周后取小鼠中叶肝组织,置预冷的4%多聚甲醛溶液中固定,常规石蜡包埋,制备蜡块、切片。
(六)DESMIN及Vinculin免疫组化检测 石蜡切片经加热融蜡、二甲苯脱蜡、常规梯度酒精水化、枸橼酸抗原修复、过氧化物酶封闭,山羊血清封闭后加入一抗(抗Vinculin 1∶50,鼠抗DESMIN1∶100或兔抗α-SMA1∶100)孵育过夜,PBS溶液洗3遍,二抗(山羊抗兔1∶200,山羊抗鼠1∶200)孵育30 min,DAB染色,苏木素复染,常规脱水透明,中性树胶封片镜检。
三、统计学处理
每个实验至少重复3次,采用 SPSS16.0软件进行统计学分析,数据均以均数±标准差表示。配对样本均数间的比较采用配对样本t检验,以P<0.05为差异有统计学意义。
结 果
一、小鼠肝脏组织病理学
HE染色结果显示对照组小鼠肝小叶内肝细胞形态正常,无坏死,炎症浸润等其他病理状态(图1A),CCL4处理组小鼠肝细胞出现空泡状,肝小叶周围出现大量炎性细胞浸润及纤维组织增生(图1B)。Masson染色结果显示对照组仅在中央静脉壁周围可见少量绿色纤维(图1C),CCL4组小鼠肝组织内及肝小叶间出现大量纤维增生,部分切片有纤维包绕分割肝小叶的趋势(图1D)。
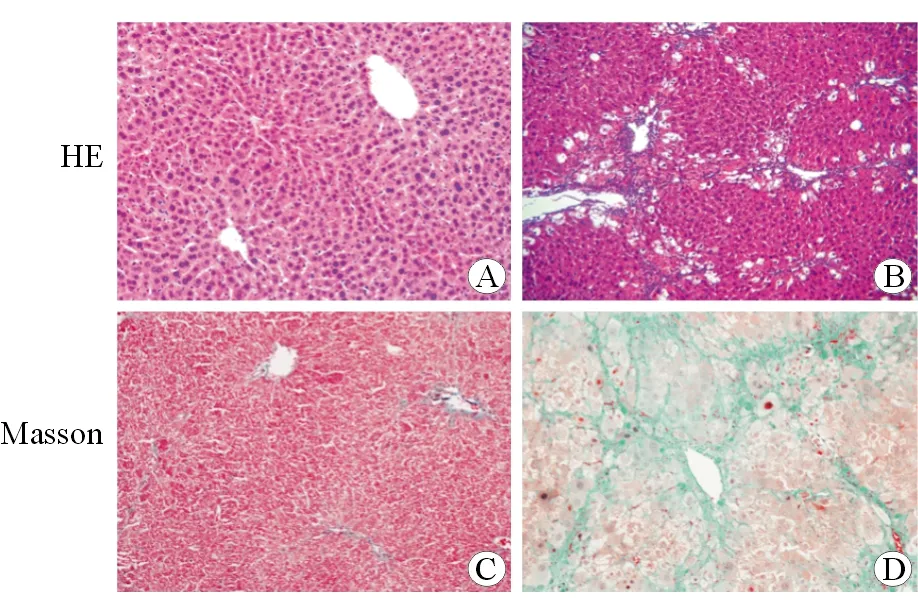
A.对照组小鼠肝组织HE染色;B.CCl4诱导8周小鼠肝组织HE染色;C.对照组小鼠肝组织Masson 染色;D.CCl4诱导8周组小鼠肝组织Masson 染色
二、Vinculin、DESMIN 及α-SMA免疫组化
对照组肝组织内可见散在的Vinculin阳性细胞,定位于肝星型细胞胞膜下,CCL4组Vinculin阳性细胞数明显高于对照组(图2A,2B)。免疫组化显示对照组DESMIN散在表达于肝血窦周围的肝星型细胞,CCL4组阳性表达细胞明显增多(图2C,2D)。对照组α-SMA为阴性表达,CCL4组阳性表达明显增加,弥漫于胞质(图2E,2F)。
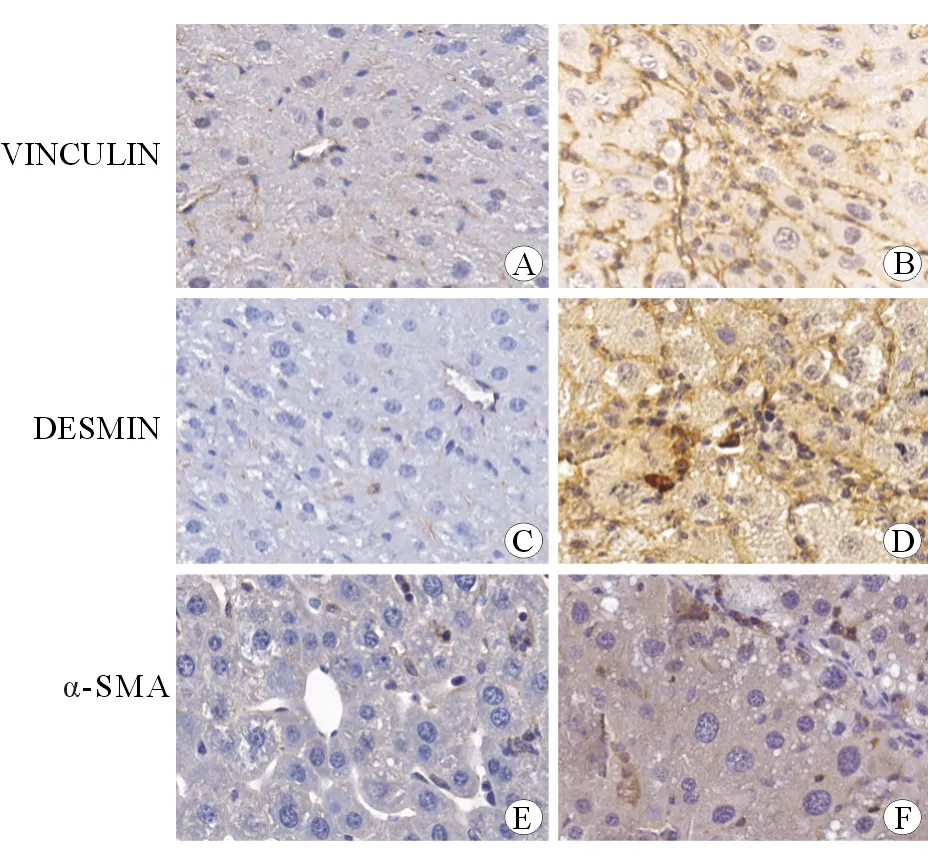
A、C、E:对照组小鼠肝组织;B、D、F:CCl4诱导8周小鼠肝组织
三、肝星形细胞系LX-2 desmin 及 α-SMA表达
人源性肝星形细胞系LX-2瞬转si Vinculin 48 h后提取细胞RNA,反转录cDNA后qPCR检测Vinculin、desmin 及 α-SMA,结果显示下调Vinculin后desmin与α-SMA mRNA表达随之下调(表1),与对照组相比差异有统计学意义(P<0.05)。蛋白质印迹检测结果显示,siRNA干扰Vinculin后其蛋白水平明显下调,DESMIN 与α-SMA表达水平也随之下降(图3)。
表1 qPCR法检测LX-2细胞Desmin 及α-SMA基因表达(2-CT,±s)
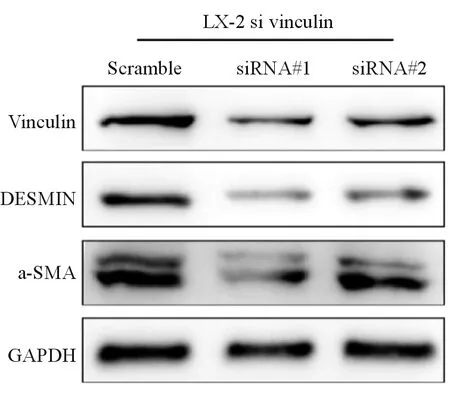
图3 肝星形细胞系LX-2 Desmin 及 α-SMA蛋白表达检测
四、ELISA检测Ⅰ型胶原蛋白
收集Vinculin及对照siRNA瞬转细胞培养上清液,ELISA检测Ⅰ型胶原蛋白含量,结果显示下调Vinculin后Ⅰ型胶原蛋白的分泌量[Vinculin siRNA1组(3.59±0.006)ng/mL,Vinculin siRNA2组(3.67±0.009)ng/mL]与对照组(3.48±0.03)ng/mL相比差异无统计学意义(P>0.05)。
讨 论
HSC激活并转化为肌成纤维细胞样细胞时,可发现门脉区域的扩增以及Vinculin的强阳性表达,也被证明可以作为门脉区域成纤维细胞被活化的标记[8]。本研究通过肝组织HE染色及Masson染色、HSC的标志性分子Desmin及HSC活化标记分子α-SMA免疫组化染色等方法证实腹腔注射CCl48周后成功诱导小鼠肝纤维化[9]。免疫组织化学染色发现纤维化肝组织中Vinculin表达量明显增高,定位于HSC细胞膜。用siRNA敲减小鼠HSC细胞株内Vinculin可导致Desmin与α-SMA的表达下调,表明Vinculin与HSC的活化有关。肝纤维化的病理机制是活化的HSC产生过量的胶原纤维。有研究表明,随着肝纤维化的进程至晚期,正常含非纤维形成胶原的低密度基底膜胶原(Ⅳ、Ⅴ型)转换为富含纤维形成胶原的高密度间质胶原(Ⅰ、Ⅲ型),Ⅰ型不溶性胶原纤维显著增加,取代Ⅲ型胶原纤维合成为肝内主要胶原,导致纤维化加重[10]。由此猜测Vinculin可能抑制Ⅰ型胶原纤维的生成,从而阻断肝纤维化进程。采用ELISA方法检测敲除Vinculin后细胞上清中Ⅰ型胶原纤维和Ⅳ型胶原纤维量,结果显示两种胶原纤维的表达量比值未产生明显改变,提示Vinculin介导的肝纤维化可能存在新机制。有研究发现Vinculin在神经元早期分化过程中高表达,与其他细胞骨架协同通过改变神经元形态而使其向不同方向分化[11-13]。在肝纤维化过程中,肝星形细胞的活化同样伴随着细胞形态发生变化,损伤刺激诱导的过表达Vinculin可能通过细胞形态变化介导肝星形细胞活化过程,但其分子机制需进一步探明。本研究结果表明Vinculin过表达与肝纤维化有关,下调Vinculin有望抑制肝纤维化进程。

