酶催化法制备烷基葡糖苷的研究进展
王晓季,张学松,陶娟
(江西科技师范大学生命科学学院,江西南昌330013)
烷基葡糖苷是一类可生物降解的非离子型表面活性剂,具有表面张力低、去污性好、配伍性好等特点,已广泛应用于化妆品、食品和医药等领域。此外烷基葡糖苷还可用于蛋白的溶解、重组及结晶,因其可快速分解且易于从蛋白提取液中去除,已成为洗涤剂的首选。
传统的苷化法均为化学过程,通常需对葡萄糖单元中1 位以外的羟基进行复杂的保护和去保护反应才能获得目标产物。此外,化学法合成烷基葡糖苷的反应条件比较苛刻,通常需要高温、高压或强酸作催化剂,并且得到的产物为α 型和β 型烷基葡糖苷的混合物,并含部分木糖苷。
随着可持续发展观念被全球的普遍认可,人们越来越重视酶参与的催化反应。因其对环境更友好,成本效益更高,更具可持续性,因此采用酶作催化剂将成为今后烷基葡糖苷生产的发展趋势。由于酶催化反应可在温和的条件下一步获得单一目标产物,同时催化剂酶源于可再生资源,因而过程更环保,成本更低廉。但酶催化法也面临着很多问题,首先酶的价格昂贵;对有机溶剂耐受性较差容易失活;另外,只有烷基碳链长度大于8 个碳的烷基葡糖苷才具有表面活性,而辛醇或更长碳链的脂肪醇参与糖醇反应时,两者的反应可及度较低阻碍了烷基葡糖苷的有效合成,难以实现规模化生产。目前国内外采用酶法制备烷基葡糖苷的研究报道比较少,本文主要对近年来酶催化法的研究进展进行综述,重点介绍了固定化酶技术在烷基葡糖苷制备中的应用。
1 酶催化作用机理
酶催化法制备烷基葡糖苷的糖苷酶大多采用了β-葡萄糖苷酶,其结构中起催化作用的是两个谷氨酸残基,分别为糖苷化反应中的质子供体和亲核基团(反应机理见图1)。首先一个谷氨酸残基Glu PD 脱去羧基上的质子,并转移到底物糖苷键-OR1 的氧原子上,促使-OR1 的离去;同时另一个谷氨酸残基Glu Nu 作为亲核基团进攻同侧的异头碳形成共价键,得到糖基-酶中间体;之后醇作为亲核试剂进攻上述糖基-酶的异头碳,形成烷基糖苷产物,并使酶回复成初始的质子化态[1]。
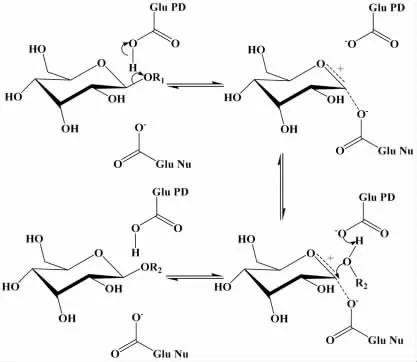
图1 β-葡萄糖苷酶催化作用机理
2 酶催化反应类型
酶催化法制备烷基葡糖苷主要有两种反应类型:
当底物为单糖时,醇作为亲核试剂,与糖直接缩合生成烷基葡糖苷,该反应类型是由热力学控制的逆水解反应,Gly-OH+R2OH→Gly-OR2+H2O,因此可通过增加反应物浓度、升高反应温度等热力学方法促使反应向产物生成方向进行。
当底物为活性糖基供体时,比如4-硝基苯基-D-吡喃葡糖苷(pNPG)、纤维素二糖、或短链糖苷等,糖基通过酶催化转移到长链醇上,发生转糖基化反应,Gly-OR1+R2OH→Gly-OR2+R1OH,同时生成的烷基糖苷也会发生水解反应,Gly-OR2+H2O→Gly-OH+R2OH。该反应类型受动力学控制,烷基糖苷的收率取决于糖基供体的转化速率与烷基糖苷的水解速率之间的平衡。
两种反应类型相比,逆水解法生产工艺相对简单,但糖醇的直接缩合反应较难进行;转糖基化法的反应速率较快,然而当采用糖苷作糖基供体时,需要通过化学法使其获得具有转糖基化反应的活性。两种酶催化反应类型中,糖苷酶的催化活性仍是制约烷基葡糖苷收率提高的瓶颈。
3 游离酶在烷基糖苷制备中的应用进展
采用游离酶催化制备烷基葡糖苷的研究重点为工艺条件的优化。首先不同来源的糖苷酶催化性能也有所不同,Yang 等从不同水果和蔬菜种子中提取出β-葡萄糖苷酶用于烷基葡糖苷的合成,研究发现李子β-葡萄糖苷酶的活性和稳定性均优于苹果或桃子种子中的糖苷酶,通过逆水解反应可制备得到78%、59%、53%和14%的乙基、丙基、丁基和辛基烷基葡糖苷。Zou 等在嗜热网球菌Dictyoglomus thermophilum 中克隆出一种新的β-葡萄糖苷酶(DtGH),该酶在水溶液中具有极佳的热稳定性,70℃下培养7d 仍能保持70%~80%的催化活性,以该DtGH 为催化剂采用逆水解法制备辛基葡糖苷时,将反应温度由50℃提高到70℃时,葡萄糖的转化率提高了27%,同时反应时间由7d 缩短到了3d。Winter 等首次采用纤维二糖磷酸化酶(CP)催化制备辛基葡糖苷可获得55%的收率,相比采用杏仁β 葡萄糖苷酶作催化剂仅4%的收率有了显著提高。
酶催化制备烷基葡糖苷的过程中水的活性(aw)是限制反应进行的一个重要因素,一方面aw对维持酶的活性非常必要,比如β-葡萄糖苷酶必需的aw 为0.6,另一方面高的aw 会促进产物的水解,因此选择合适的aw 值可提高的烷基葡糖苷收率。Mladenoska 采用杏仁β-葡萄糖苷酶催化制备辛基葡糖苷的研究中重点考察了aw 对转化率的影响。该反应中水既是糖基受体,又是反应溶媒,研究发现反应速率随aw 增大而增加,当aw为0.94 时反应速率达最大值,最终产物收率也最高。在相同aw 条件下,转糖基化反应优于逆水解反应。
酶催化反应中添加一定量的助溶剂,不仅有助于提高糖基供体的溶解度,同时还可维持一定的aw 从而有利于烷基糖苷的生成。助溶剂的选择需对酶的活性没有抑制作用。Ducret 等在制备辛基葡糖苷的过程中选择N,N-二甲基甲酰胺(DMF) 作为助溶剂添加到单相辛醇反应体系中,结果表明产物收率跟DMF 的添加量有很大关系,当DMF 含量为10%时辛基葡糖苷的收率达到最高值50%,但进一步提高DMF 的含量时产物收率反而逐渐降低,这是由于过量的DMF 会抑制酶的活性。Phongprathet 等以泰国汉尼松BC9 β-葡萄糖苷酶为催化剂制备己基葡糖苷时,添加15%(v/v)二甲基亚砜(DMSO)作助溶剂,反应24h 的收率可从6%提高到66%,特别是反应4h 时己基葡糖苷的收率已达62%。
逆水解反应是受热力学控制,理论上提高葡萄糖的浓度有利于反应向烷基葡糖苷的生成方向进行,但Ducret 等研究发现,高的葡萄糖浓度对来源于微生物的β-葡萄糖苷酶有抑制作用,从生物进化角度来分析,葡萄糖是微生物生长必需的碳源,但周围环境存在过量葡萄糖反而会被竞争菌株所利用,因此该微生物来源的糖苷酶参与烷基葡糖苷制备的过程中不能选择过高的葡萄糖浓度。
目前关于采用酶催化法制备烷基葡糖苷的报道中,糖基供体大多是可溶性的化合物,比如葡萄糖、pNPG、短链烷基葡糖苷等,Tao 等直接采用不溶性的纤维素为底物,与甲醇经纤维素酶催化得到了甲基葡糖苷,当甲醇含量为22%时,产物收率最高可达40%。该研究发现纤维素首先降解成纤维二糖,之后纤维二糖作为糖基供体与甲醇发生转糖基化反应生成甲基葡糖苷。
4 固定化酶在烷基葡糖苷制备中的应用进展
与游离酶相比,固定化酶具有稳定性高,易分离回收,可重复使用等优点,越来越多地应用于糖苷化反应的研究中,根据酶的固定化方式可分为以下几种。
4.1 吸附法
吸附法是酶通过物理或离子交换作用吸附在吸附剂表面而使酶固定,该方法操作简单、条件温和、不会引起酶变性或失活,且载体廉价易得。Gargouri 等采用吸附法将β-葡萄糖苷酶吸附到不同载体上制成固定化酶,并对负载量及催化活性进行了研究,结果表明β-葡萄糖苷酶固定在DEAE-琼脂糖上的负载量最高可达91%,并可保留83.2%的活性,将该固定化酶用于糖苷的转糖基化反应,可得22mM 的异戊基木糖苷和14mM异戊基木二糖苷。但该固定化酶并不能制备烷基葡糖苷。Lundemo 等采用吸附法制得了固定化糖苷酶,重点研究了后处理方式对酶在微水环境中催化活性的影响。研究发现将糖苷酶吸附到疏水载体Accurel MP-1000,并通过丙醇纯化制得的固定化酶,在较低的aw 中催化合成己基葡糖苷时,转糖基化反应速率明显优于产物的水解速率,进而有利于己基葡糖苷收率的提高;同时与游离酶相比,初始反应速度提高了17~70 倍。但最终酶催化反应收率相比经典的化学法仍有很大的改进空间[2]。
4.2 交联法
交联法是利用功能试剂与酶进行交联反应,形成共价键连接的固定化酶,常用的交联剂是戊二醛。Winter 等采用交联法对纤维二糖磷酸化酶(CP)进行固定制得交联酶聚体(CLEAs),相比游离酶,CLEAs 的稳定性显著提高,其在50℃的活性半衰期可由34h 增加到11d,另外采用辛醇分子印迹技术的CLEAs 催化辛基葡糖苷的效率可提高一倍,并且能连续三次循环使用,是一种理想的酶法制备烷基葡糖苷的酶催化剂。
4.3 载体结合法
采用载体结合法固定化酶时,最常用的是共价结合,即酶蛋白的非必需基团通过共价键与不溶性载体形成不可逆的连接,该固定化酶结合地非常牢固,即使高浓度溶液也不会导致酶的脱落,具有良好的稳定性及重复使用性。但固定化过程中反应条件比较苛刻,容易引起酶蛋白高级结构发生改变而使酶失活。张烜等采用硅酸盐黏土材质的纳米凹凸棒为载体,制备的固定化β-葡萄糖苷酶,在微水环境中催化葡萄糖和辛醇逆水解反应生成辛基葡糖苷,相比游离酶,固定化酶对有机溶剂的耐受性显著提高,反应达到平衡的时间也可缩短48h,最终可达20.4%的葡萄糖转化率。Wang 等将苦杏仁中提取的β-葡萄糖苷酶,固定在多胺微球上(PA-M),用以提高酶的热稳定性及对有机溶剂的耐受性,结果显示固定化酶在80℃下培养48h 后仍保持原酶活性的40%,而游离酶则完全失活。在添加10%的丁基醇作为助溶剂制备辛基葡糖苷时,产物收率提高了1.7 倍。另外该研究发现分批加料的方式可获得最高59.6%的产物收率,这是由于分批加入葡萄糖可控制葡萄糖的浓度,进而降低葡萄糖对酶活性的抑制作用[3]。
4.4 包埋法
包埋法首先将聚合物的单体与酶混合,再借助进剂的作用进行聚合,最终酶被包埋在聚合物中以达到固定化的目的。由于包埋法一般不需要与酶蛋白的氨基酸残基进行结合反应,很少改变酶的空间构象,酶活的回收率较高。周亚军等采用包埋法中的微球截留固定化技术,以海藻酸钠为壁材、戊二醛为交联剂、氯化钙为凝聚剂,将β-葡萄糖苷酶包埋制备成微胶囊固定化酶,与游离酶相比,固定化酶在葡萄糖和正丁醇的逆水解反应中具有显著的酶活力,同时该固定化酶可重复使用3 次。
4.5 酵母细胞表面展示技术
表面展示技术一种新的重组DNA 技术,可使表达的蛋白或多肽以融合蛋白形式展示在细胞表面,保持相对独立的空间结构和生物活性。酵母细胞表面展示技术因其较完善的蛋白质翻译后修饰和分泌机制、安全无毒等独特的优越性受到越来越多的关注。该技术首先将靶蛋白基因与特定的载体基因序列融合后导入酵母细胞,利用酵母细胞内蛋白转运到膜表面的机制,使得靶蛋白固定化表达在酵母细胞表面,从而制得全细胞催化剂。Wallecha 等将耐热酵母Pichia etchellsii 中发现的两种β-葡萄糖苷酶BglⅠ和BglⅡ,以母体细胞Pichia etchellsii 为载体,经纤维二糖诱导制备得到全细胞催化剂(BGLⅠ和BGLⅡ),在pH4~9 范围内具有良好的稳定性。该研究首次采用全细胞催化剂合成了长链烷基葡糖苷,比如辛基葡糖苷(收率约为12%)、癸基葡糖苷等。Rather 等采用Pichia etchellsii 全细胞结合的β-葡萄糖苷酶在微水环境下催化pNPG 与辛醇反应制备辛基葡糖苷,采用优化的初始水活度、糖基供体的浓度及酶的用量,最终产物的收率接近70%。2012 年Rather 课题组采用上述全细胞酶催化剂,以甲基葡糖苷为糖基供体进行转糖基化反应制备长链烷基葡糖苷,其中辛基葡糖苷,癸基葡糖苷及十二烷基葡糖苷的收率分别为53%、27%和13%。Ito 等采用酵母细胞展示技术制备了六种酿酒酵母展示的棘孢曲霉β-葡萄糖苷酶1 的全细胞催化剂,其中GRI-117-UK 为宿主菌时,酶的活性最高(简称GUK:BGL1), 可催化pNPG 与1-己醇得到27.3%的己基葡糖苷。Guo 等将木薯β-葡萄糖苷酶展示在毕赤酵母GS115 细胞表面,制备全细胞催化剂,并以pNPG 为底物通过转糖基化反应制备了辛基葡糖苷,最高可达52%的收率[4]。
5 展望
酶催化制备烷基葡糖苷的反应中,酶的催化活性对反应速率及产物收率起到了至关重要的作用。由于环境变化对酶活性有很大的影响,因此改良酶的稳定性是研究的关键。固定化酶对于提高酶的稳定性、重复利用性方面有着显著优势,但也存在着一些不足。比如,传统的固定化方法使得酶的活力有所损失,固定化酶与底物的亲和力较游离酶也显著降低。今后的研究重点将是选择性能优异的载体材料,并开发新的固定化酶技术,使得酶得以固定并保持较高的酶活性,同时为糖醇的催化反应提供反应空间,从而实现绿色高效制备烷基葡糖苷。

