流动注射-光度法自动测定多种植物样品中过氧化物酶活性
杜璞,李永生
(四川大学 化学工程学院,四川 成都 610065)
过氧化物酶(POD)是一种广泛存在于真菌、细菌、陆生生物中以血红素为辅基利用过氧化氢介导有机和无机底物氧化反应的氧化还原酶[1-2]。POD在多个领域应用广泛[3-5],商品POD多为辣根过氧化物酶(HRP),但HRP产量低,价格昂贵,多种植物中POD的含量也较为可观[6-9],POD活性的准确测定可以筛选富含POD的植物样品,对POD的提纯及应用有重要意义。
POD活性测定方法多基于手工操作[10-12],误差大、效率低。流动注射分析(FIA)技术具有分析速度快、精密度高等特点[13-14]。本文基于GA/POD/H2O2反应体系建立一种可快速测定POD的流动注射光度分析系统(FIA-SP),在反应非平衡态时准确、快速测定植物样品中POD活性。
1 实验部分
1.1 材料与仪器
愈创木酚(GA)、过氧化氢(30%)、磷酸二氢钠、磷酸氢二钠、浓盐酸(质量分数36%~38%)均为分析纯;辣根过氧化物酶(HRP,≥250 U/mg),Sigma公司;实验用水为脱气超纯水。
FIA-3110流动注射装置;傲艺紫外-可见分光光度计;SHZ-D(Ⅲ)循环/水式多用真空泵;艾柯KL-UP-IV-20超纯水仪;CP224S电子天平;800-1离心机;pXJ-1C+型离子活度计。
1.2 溶液配制
1.2.1 磷酸盐缓冲液(PBS,0.05 mol/L,pH=6.0) 用电子天平分别称取7.8 g的NaH2PO3·2H2O和17.8 g的Na2HPO3·12H2O,充分溶解后,分别移入1 L的容量瓶中,用超纯水定容得到0.05 mol/L的磷酸二氢钠溶液和磷酸氢二钠溶液。取123 mL的磷酸二氢钠溶液和877 mL的磷酸氢二钠溶液混合,得到pH为6.0,浓度为0.05 mol/L 的PBS。
1.2.2 GA母液(45 mmol/L) 使用移液枪准确移取446 μL的GA于100 mL的容量瓶中,用PBS定容。
1.2.3 H2O2母液(15 mmol/L) 使用移液枪准确移取165 μL的H2O2溶液(30%)于100 mL的容量瓶中,用PBS定容。
1.2.4 HRP母液(10 000 U/L) 使用万分之一的分析天平准确称取0.001 g的HRP,溶解后移入 25 mL 的容量瓶中,用PBS定容。
1.2.5 植物粗酶液 将新鲜的植物样品切成小块,用榨汁机榨汁,于4 000 r/min 的离心机中离心 15 min。取出上清液,过滤,得到植物粗酶液。于冰箱中4 ℃下保存。
1.3 测定原理
本实验基于H2O2/POD/GA的反应体系,在POD的催化下,H2O2和GA反应生成3,3′-二甲氧基-4,4′-联苯二醌(2-GA),该产物在470 nm处有最大吸收,反应方程式[15]见公式(1):
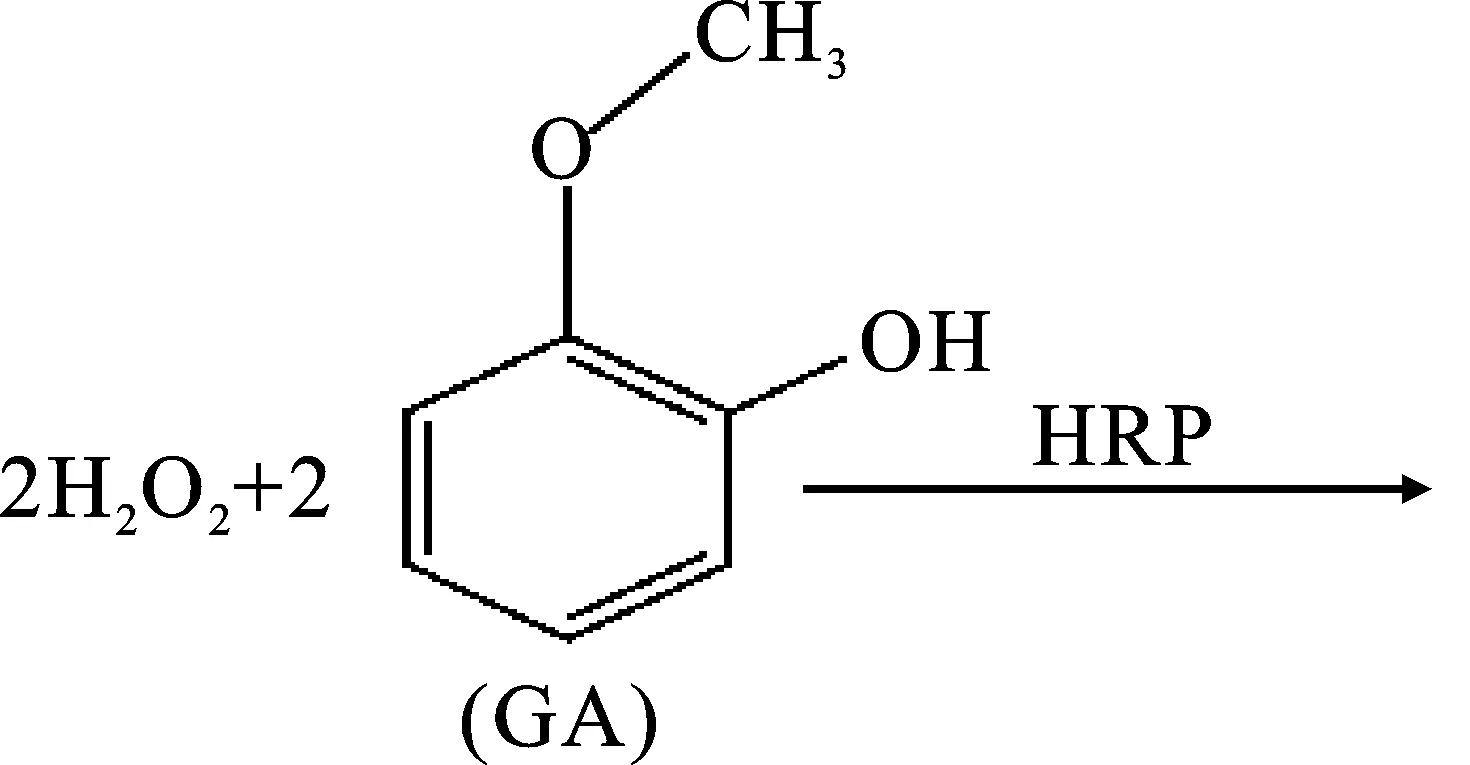

(1)
根据酶活性定义:每分钟消耗1 μmol底物需要的酶量为1个酶单位(U),得到测定酶活性浓度(cE,U/L)的计算公式(2):
(2)
式中 ΔA——在酶促反应一级阶段产物2-GA吸光度的变化值,在FLA系统中为峰高;
Δt——一级反应阶段所用时间,在FIA系统中,为从注样时间到最高峰出现的留存时间,0.67 min;
n——底物GA与反应产物2-GA的物质的量之比,即n=2;
L——流通池光程,1 cm;
V/v——样品的稀释体积,即FIA系统中样品分散度,5.921;
ε——反应产物2-GA的表观摩尔吸光系数,
0.006 4 L/(μmol·cm)。
因此,在其他参数均确定的情况下,cE的值仅与ΔA/Δt有关,cE测定公式简化为公式(3):
(3)
1.4 实验方法
FIA流路见图1。FIA系统由蠕动泵(P)、多功能阀(V)、流通式光度检测器和计算机组成。
当V处于“采样”位时,P1、P2同时运行,酶样和GA/H2O2混合试剂R在P2的抽吸作用下充满样品定量环(SL)和试剂定量环(RL),多余液体从W1和W2排废,PBS作为载流推动清洗剂定量环(CL)中的HCl清洗液塞,流经反应盘管(RC)和流通池清洗管路,得到一条基线,此时吸光度值为A0。
V转到“注入”位,P2停止运行,P1继续运行,PBS推动SL中的酶试样塞追赶RL中的GA/H2O2混合试剂塞,并与之合并,进入RC中反应,GA和H2O2在POD的催化作用下反应生成2-GA,流经流通池时,得到产物吸光度值(A),最后从W4流出,同时,清洗液HCl被注入CL中,多余液体从W3排废。ΔA=A-A0,从注入到最高峰出现的时间即留存时间Δt,将ΔA/Δt代入公式(3)中可求出cE。
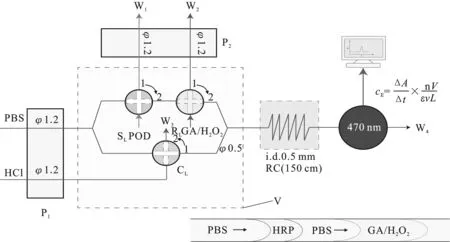
图1 测定POD的FIA-光度法系统(RC反应盘管)Fig.1 FIA-spectrophotometry system for determination of POD
2 结果与讨论
2.1 FIA系统参数的优选
基于前期手工法[9]将FIA系统初始参数设定如下:GA浓度为1.5 mmol/L,H2O2浓度为 0.5 mmol/L,两者等体积混合为混合试剂R;SL体积为40 μL,RL体积为150 μL,CL体积为100 μL;PBS浓度为0.05 mol/L,pH为5.5;清洗液HCl浓度为0.4 mol/L;RC长度为100 cm;系统流速为 1.64 mL/min。采用单因素法优选FIA系统的各参数。
2.1.1 FIA系统流速优选 蠕动泵为FIA系统的流体驱动装置,流速的大小影响反应进程和分析速度,用HRP标液作为样品,考察系统流速对ΔA的影响,结果见图2。
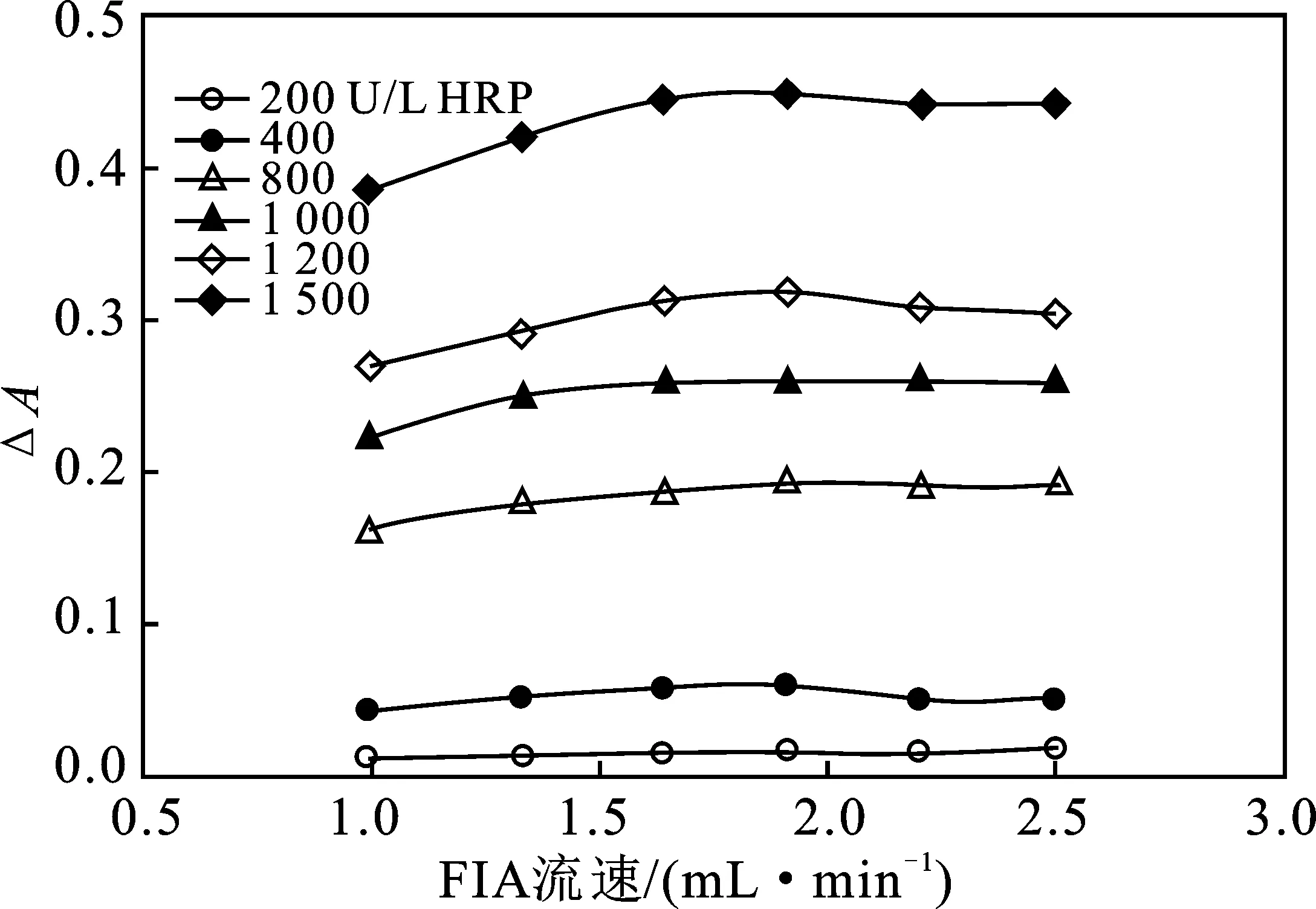
图2 FIA系统流速对产物吸光度的影响Fig.2 Effect of flow velocity of FIA system onabsorbance of product
由图2可知,ΔA随着流速的提高先增大后减小,流速为1.91 mL/min时,ΔA最大。其原因是流速较低时,随着流速的增加,样品塞追上试剂塞后能更快地融合反应,ΔA也增大,当流速过大,样品塞和试剂塞结合后的反应速度小于流动速度,未充分反应就从流通池流出。因此,优选系统流速为1.91 mL/min。
2.1.2 样品进样体积优选 FIA系统样品定量环SL即加入POD体积,不同体积POD会使酶促反应速率不同,影响系统灵敏度。用HRP标准溶液作为样品,考察不同体积SL对ΔA的影响,结果见图3。
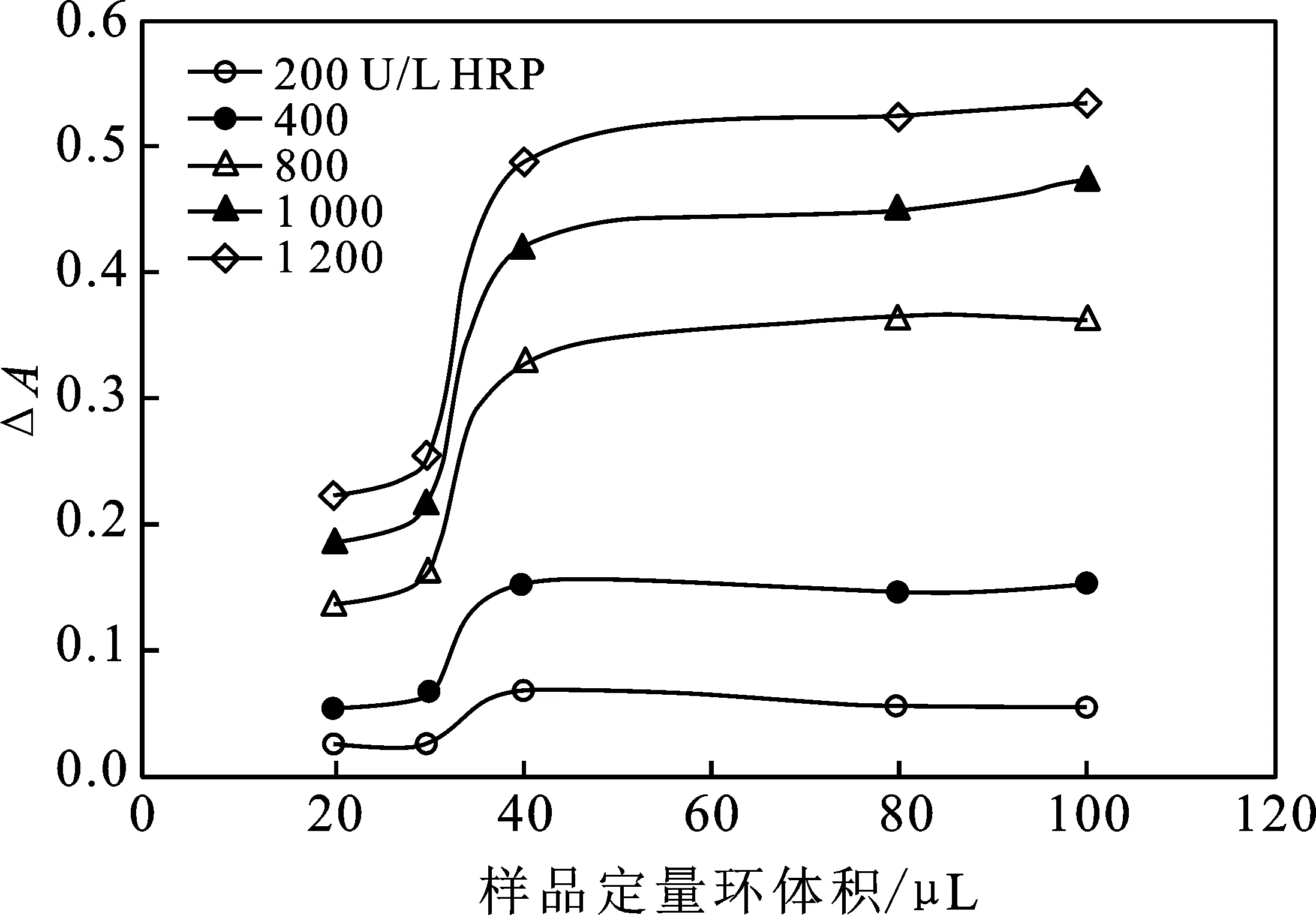
图3 样品进样体积对产物吸光度的影响Fig.3 Effect of sample injection volume onabsorbance of product
由图3可知,随着SL体积的增大,ΔA逐渐升高至稳定,当SL的体积超过40 μL,其对ΔA不再造成影响。原因是当SL体积过小时,随着酶液体积的增加,反应速率也增加,当SL体积超过40 μL后,酶液过量,GA和H2O2的反应已到达平衡。为节省试剂,优选SL体积为40 μL。
2.1.3 试剂进样体积优选 试剂定量环RL即加入GA/H2O2混合试剂体积,加入不同体积的底物会影响酶催化反应,从而影响产物的吸光度值。HRP标液作为样品,考察不同体积RL对ΔA的影响,结果见图4。
由图4可知,随着RL体积逐渐增大,ΔA先升高后降低,RL体积为150 μL时,ΔA最大。因此,优选RL体积为150 μL。
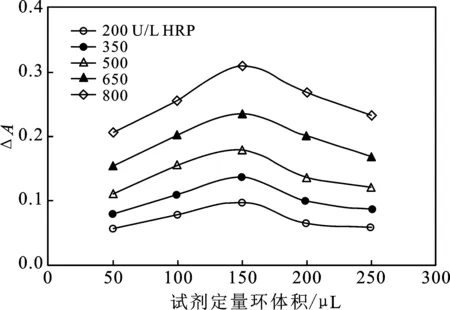
图4 试剂进样体积对产物吸光度的影响Fig.4 Effect of reagent injection volume onabsorbance of product
2.1.4 反应盘管长度优选 RC的长度影响反应进程和分析速度。HRP标液作为样品,考察RC对ΔA的影响。结果表明,ΔA随着RC长度增加先升高后降低,RC在200 cm时ΔA最大。原因是随着RC长度的增加,反应时间增加,ΔA也逐渐增加,当RC超过200 cm时,反应产物的稀释速率大于生成速率,导致ΔA下降。由于RC长度为150 cm时与200 cm时的ΔA相差不大,但HRP标液线性更好(ΔA=0.003 8x-0.242 2,r=0.999),为加快系统分析速度,优选RC长度为150 cm。
2.1.5 载流浓度及pH优选 PBS的pH值和浓度会影响酶促反应。因此在上述优选条件下,分别考察PBS的酸度和浓度对ΔA的影响,结果见图5。

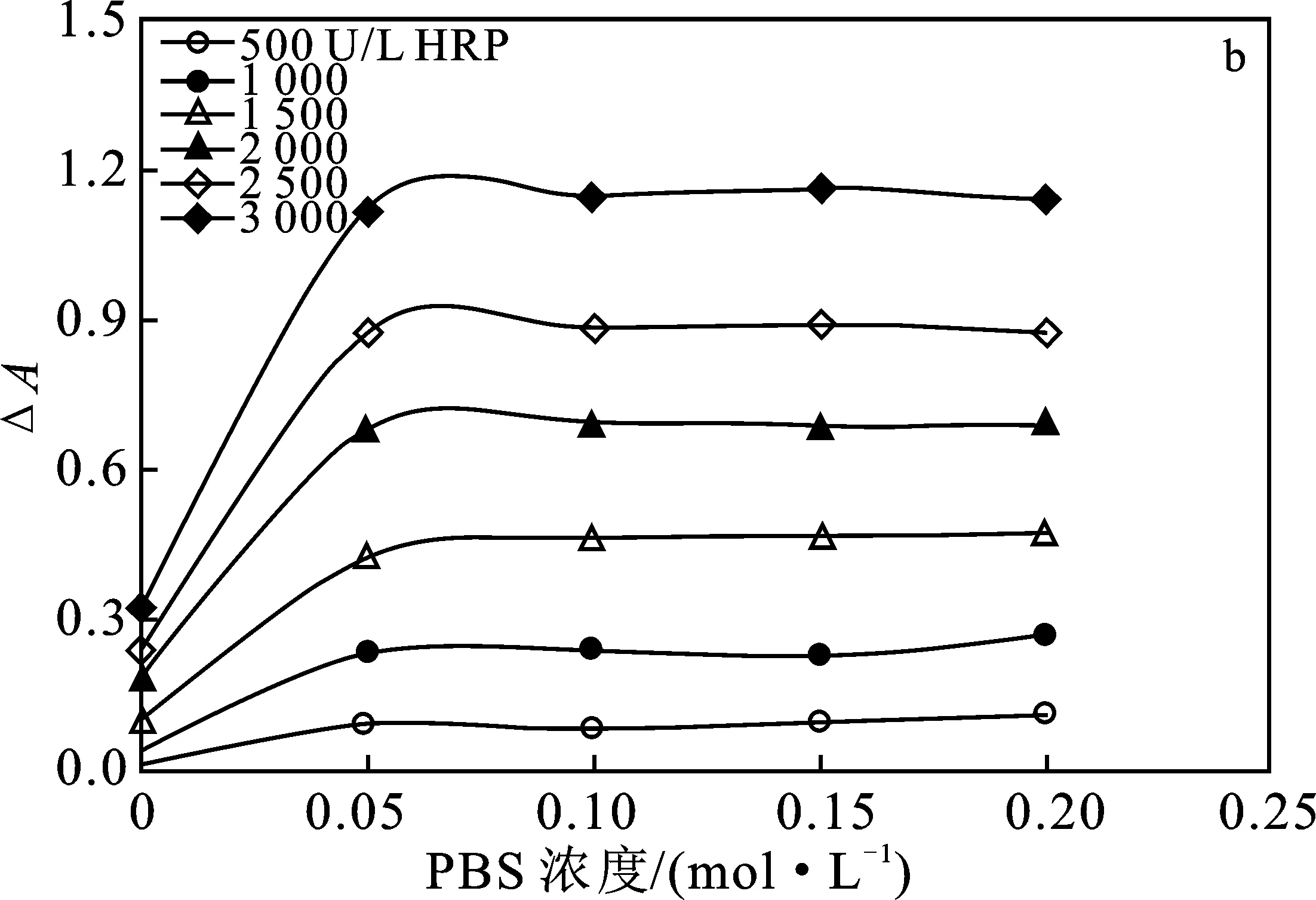
图5 PBS的pH值(a)和浓度(b)对产物吸光度的影响Fig.5 Effect of pH (a) and concentration (b) of PBS onabsorbance of product
由图5可知,ΔA随着PBS的pH增大而先增大再减小,pH为6.0时,产物吸光度值最大,而PBS的浓度对ΔA没有影响,这说明POD的最适pH值为6.0。因此,优选PBS的浓度为0.05 mol/L,pH为6.0。
2.1.6 清洗剂HCl浓度及进样体积优选 HCl作为清洗剂起到清洗残留在系统中的褐色产物2-GA,进而降低系统基线漂移率的作用,因此需要优选HCl的浓度和CL体积。在上述优选的条件下,分别考察HCl的浓度和CL体积对系统基线漂移率的影响。结果表明,随着HCl浓度和CL体积的增加,系统基线漂移率逐渐降低。进样体积一定时,HCl浓度超过 0.24 mol/L 后对基线漂移率的影响较小,而CL体积过大会影响溶液折射率进而影响产物吸光度值。因此,优选HCl浓度为0.24 mol/L,CL体积为150 μL。
2.1.7 底物浓度优选 在上述优选条件下考察H2O2浓度(0.1~2 mmol/L)和GA浓度(0.1~5.5 mmol/L)对酶催化反应的影响,结果见图6。
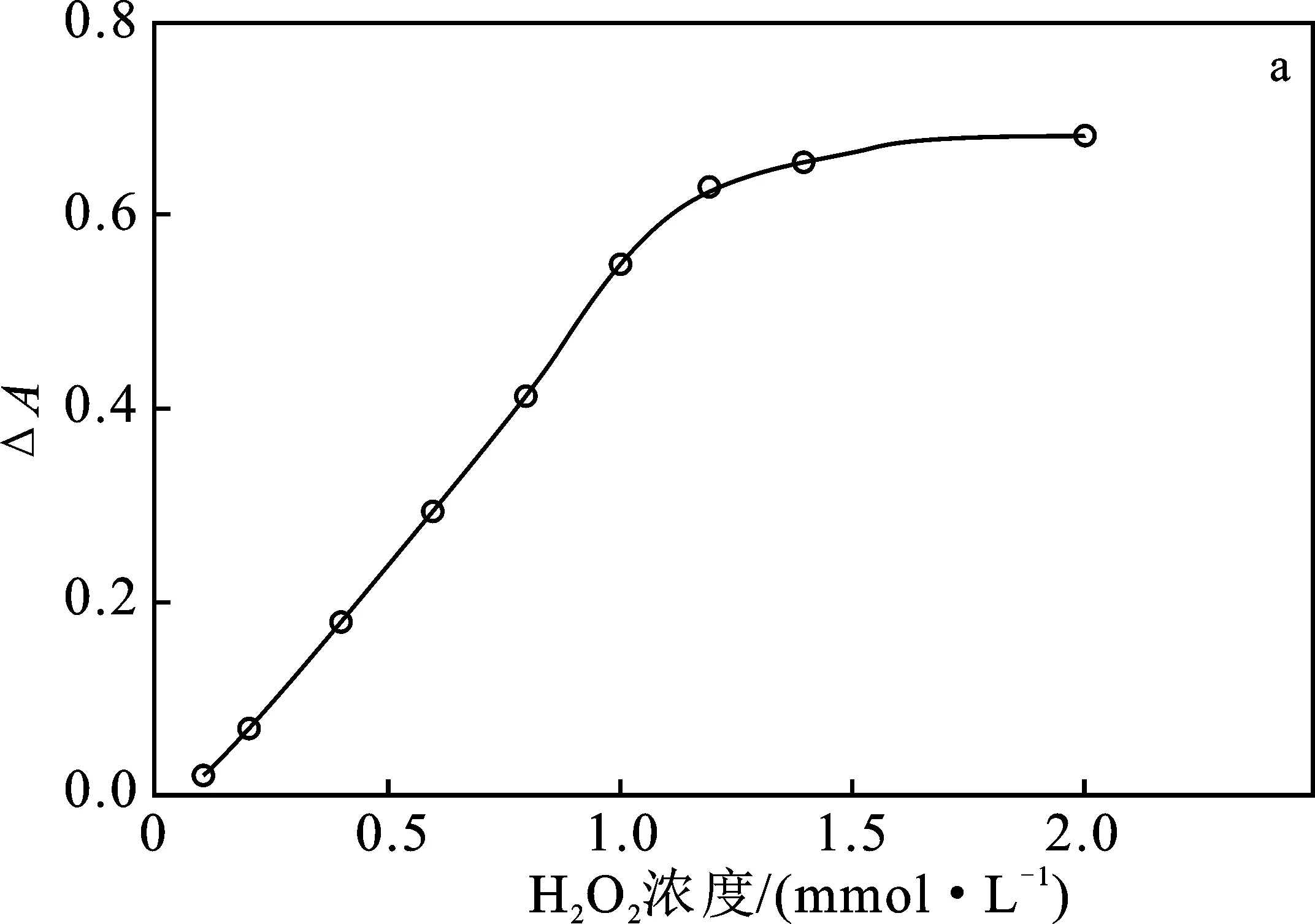
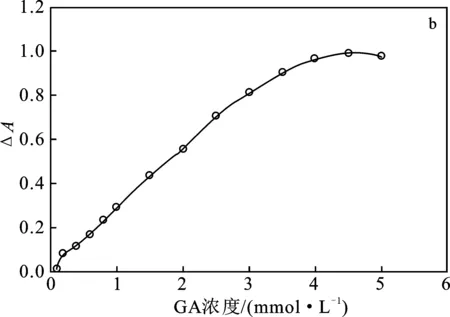
图6 H2O2浓度(a)和GA浓度(b)对产物吸光度的影响Fig.6 Effect of concentration of H2O2 (a) andGA (b) on absorbance of product
由图6可知,H2O2和GA对ΔA的影响趋势相同,随着H2O2和GA浓度的增大,ΔA逐渐增大至稳定,当H2O2浓度达到1.5 mmol/L,GA达到 4.5 mmol/L 时,ΔA不再变化。因此,优选底物浓度为H2O2浓度1.5 mmol/L,GA浓度4.5 mmol/L。分别以H2O2和GA为底物做Lineweaver-Burk双倒数图,得到以H2O2为底物时,HRP的米氏常数(Km)值为2.73 mmol/L,最大反应速率(Vm)为 2.84 mmol/(L·min)。以GA为底物时,HRP的Km为7.32 mmol/L,Vm为3.54 mmol/(L·min)。
2.2 2-GA表观摩尔吸光系数的测定
为计算POD的酶活性需要在给定条件下准确测定2-GA的表观摩尔吸光度值(ε)。由朗伯-比尔定律(A=εbc)可知,ε=A/bc,其中ε为表观摩尔吸光系数[L/(μmol·cm)],b为吸收光程(cm),c为物质浓度(mol/L),对于特定的有色物质,通过绘制浓度/吸光度的曲线,得到曲线斜率,可求出ε。由于反应产物2-GA不稳定,无法测得其浓度,由(1)式可知,通过增大H2O2和HRP的量,使化学平衡向右移动,使GA完全转化为2-GA,可以通过GA的浓度间接获得2-GA的浓度,再绘制2-GA浓度/吸光度曲线求出斜率,即ε2-GA。通过优选得到CH2O2/CGA>1.5,HRP浓度>800 U/L 时,GA可以完全转化为2-GA。配制出H2O2浓度恒为1.2 mmol/L、GA浓度在200~600 μmol/L范围内的混合试剂(CH2O2/CGA恒大于1.5),用800 U/L的HRP溶液作为样品,用FIA系统在温度分别为18,40,60 ℃的条件下测出2-GA的吸光度值,求出对应的ε2-GA分别为0.006 4,0.006,0.006 L/(μmol·cm),结果表明温度对ε2-GA的测定无影响。在优选条件下,在FIA系统中测得的ε2-GA为0.006 4 L/(μmol·cm),因此取ε2-GA为0.006 4 L/(μmol·cm)。
2.3 分析系统稳定性及工作曲线
在上述优选条件下,对本系统的稳定性及线性响应进行评价。对两种不同浓度的HRP溶液(555,1 770 U/L)连续测定11次,实测曲线见图7a,得到RSD分别为3.38%和1.40%,均小于5%,这说明FIA系统稳定性好、精密度高。
配制一系列HRP标准溶液作为样品,考察本系统的线性响应范围,实测曲线见图7b,通过数学回归处理,得到HRP浓度在153~2 752 U/L的范围内线性良好(ΔA=0.000 35CE(HRP)+0.007 16,R2=0.998 8)。另外计算得到系统分析速度为90样/h,检出限为25.7 U/L。


图7 FIA光度法系统重现性/线性响应评价Fig.7 Evoluation of repeatability and linearity forFIA-spectrophotometry system
2.4 实样测定
从商场购买长白萝卜、紫茄子、西胡瓜、嫩南瓜和大白菜,制备样品粗酶液,用本方法测定酶活性,结果见表1。为进一步评价系统的准确性,进行加标回收实验,在植物样品中按照1+1体积比例添加HRP标液,用本系统测出加标后酶活,每次实验前对HRP标准溶液的活性进行校正,结果表明回收率在95%~105%之间。
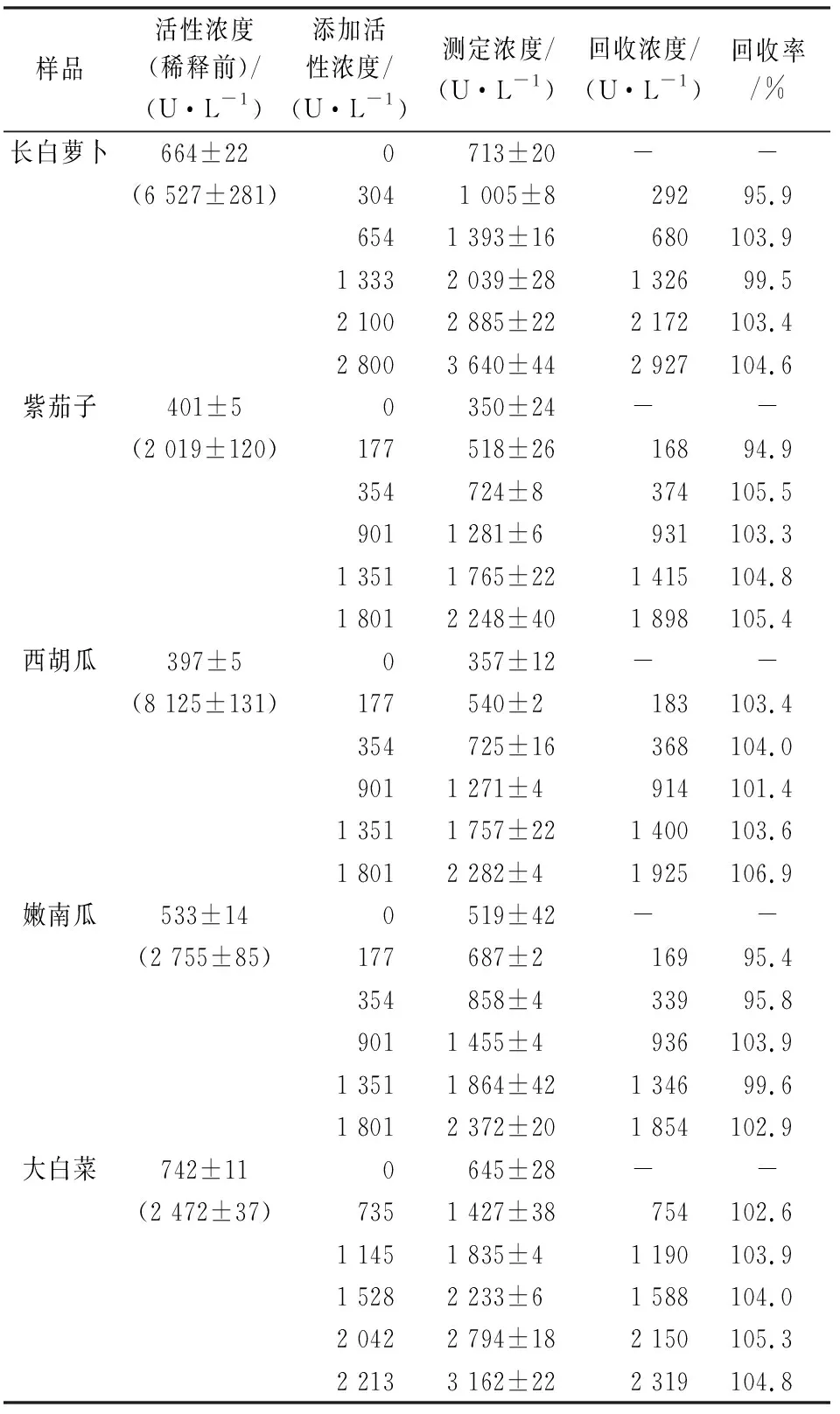
表1 植物样品POD测定及回收结果Table 1 Results for determination of the real plantsamples and the recovery test
3 结论
基于H2O2/POD/GA反应体系建立一种新的可快速测定多种植物所含POD的FIA分析流路,在优化条件下,该方法检测范围为153~2 752 U/L,RSD≤3.38%,检出限为25.7 U/L,分析速度为90样/h。本方法的优点是:操作简单、无人为误差、分析速度快、精密度高、对试剂和样品的消耗量小,可以快速筛选POD含量较高的植物样品,对过氧化物酶的提纯及应用有重要意义。

