聚氨酯基活性炭制备及吸附电镀废水中重金属离子研究
李茁,李维宁,陈坤,郭爱军
(中国石油大学(华东) 化学工程学院,山东 青岛 266580)
电镀行业产生的含重金属离子酸性废水[1],对土壤、地表水体等环境造成严重危害,并诱发生物体产生各种疾病[2-4]。目前对废液中的重金属离子处理方法主要有:膜分离、电解、离子交换树脂以及活性炭吸附法[5-7]。其中,活性炭吸附去除的方法成本较低。聚氨酯(PU)塑料广泛应用于电器、冶金、纺织、机械制造等领域[8-9]。由于其不会自然降解,废弃物会对环境保护造成重大负担[10]。
本实验以废弃PU为研究对象,制备得活性炭,对其进行表征,并揭示聚氨酯基活性炭对溶液中Zn2+的吸附特性和规律。加快废弃PU的资源化利用,变废为宝,具有重要的理论意义和实际社会价值。
1 实验部分
1.1 材料与仪器
七水合硫酸锌、浓硫酸、浓盐酸、氢氧化钾、碘、碘化钾、硫代硫酸钠、碘酸钾、无水碳酸钠均为分析纯;废弃聚氨酯塑料板(30 cm×30 cm×2 cm),由山东光大国际环保公司提供。
OTF-1200X-S型高温管式炉;ICPOES 730型电感耦合等离子体原子发射光谱仪;JSM-7500F型扫描电子显微镜;ASAP2020型全自动比表面积孔隙度分析仪;4800S型红外光谱仪。
1.2 聚氨酯基活性炭的制备
废弃聚氨酯塑料板经粉碎后,由标准筛网筛分100~150目,将筛分后的聚氨酯粉末于80 ℃条件下真空烘干。
取5 g已干燥的聚氨酯粉末于刚玉瓷舟,移至密闭管式炉里,通入氮气(流速50 mL/min),以 5 ℃/min 升温速率升温至600 ℃,炭化4 h。炭化结束冷却至室温,取出炭化产物,研磨至80~100目,将粉末置于管式炉中,使用二氧化碳为活化剂进行活化。二氧化碳流速控制为100 mL/min,以 3 ℃/min 升温到200 ℃,恒温2 h,随后以5 ℃/min的升温速率升温到800 ℃,恒温3 h。活化结束冷却至室温,即得聚氨酯基活性炭产物。
1.3 结构表征
聚氨酯基活性碳材料的比表面积、孔径分布、孔容等由氮气吸附分析仪得到。使用红外光谱和元素分析分别测定聚氨酯基活性炭的表面基团组成和元素组成。Zn(Ⅱ)的浓度由电感耦合等离子体原子发射光谱仪测得。
1.4 性能测试
1.4.1 Zn(Ⅱ)的吸附 在250 mL磨口锥形瓶中加入50 mL的Zn(Ⅱ)溶液和100 mg聚氨酯基活性炭,使用恒温振荡器振荡。 通过改变Zn(Ⅱ)溶液的初始pH值、初始浓度以及振荡时间来探究溶液pH值、浓度、吸附时间对Zn(Ⅱ)吸附容量的影响。Zn(Ⅱ)吸附容量根据式(1)得到。
qe=(c0-ce)V/m
(1)
式中qe——平衡时Zn(Ⅱ)的吸附量,mg/g;
c0——初始溶液浓度,mg/L;
ce——平衡时溶液浓度,mg/L;
V——溶液体积,mL;
m——活性炭用量,mg。
1.4.2 碘吸附值测试 采用GB/T 12496.8—2015国家标准《木质活性炭试验方法碘吸附值的测定》进行碘吸附值测定。
2 结果与讨论
2.1 聚氨酯基活性炭的表征
聚氨酯基活性炭的氮气等温吸附脱附曲线见图1。

图1 聚氨酯活性炭的氮气吸附-脱附曲线Fig.1 The nitrogen adsorption-desorption curve ofpolyurethane activated carbon
由图1可知,在较低相对压力0~0.1的区间内,聚氨酯基活性炭的氮气吸附量随着相对压力的升高急剧增加。这可能是由于微孔填充的存在,活性炭中的微孔与氮气之间吸附势能较大,导致相对压力在0~0.1的区间时,聚氨酯基活性炭吸附氮气的吸附量急剧升高。当相对压力>0.1后,吸附量较小并达到饱和。
聚氨酯基活性炭的孔径分布见图2。

图2 聚氨酯基活性炭的孔径分布Fig.2 The pore size distribution of polyurethane-basedactivated carbon
由图2可知,大部分孔径<1.0 nm,表现为微孔结构,与吸附脱附曲线结果一致。
聚氨酯基活性炭孔结构相关数据见表1。

表1 聚氨酯活性炭的孔隙和碘值数据Table 1 Textural properties of the samples
由表1可知,通过二氧化碳活化制备的聚氨酯活性炭比表面积较高,达到836.42 m2/g,微孔比表面积在总比面积中所占比例较大,微孔孔容占总孔容的比例较高。活性炭材料的碘值测定数据为 588 mg/g,达到商业活性炭水平。
聚氨酯基活性炭的红外光谱见图3。
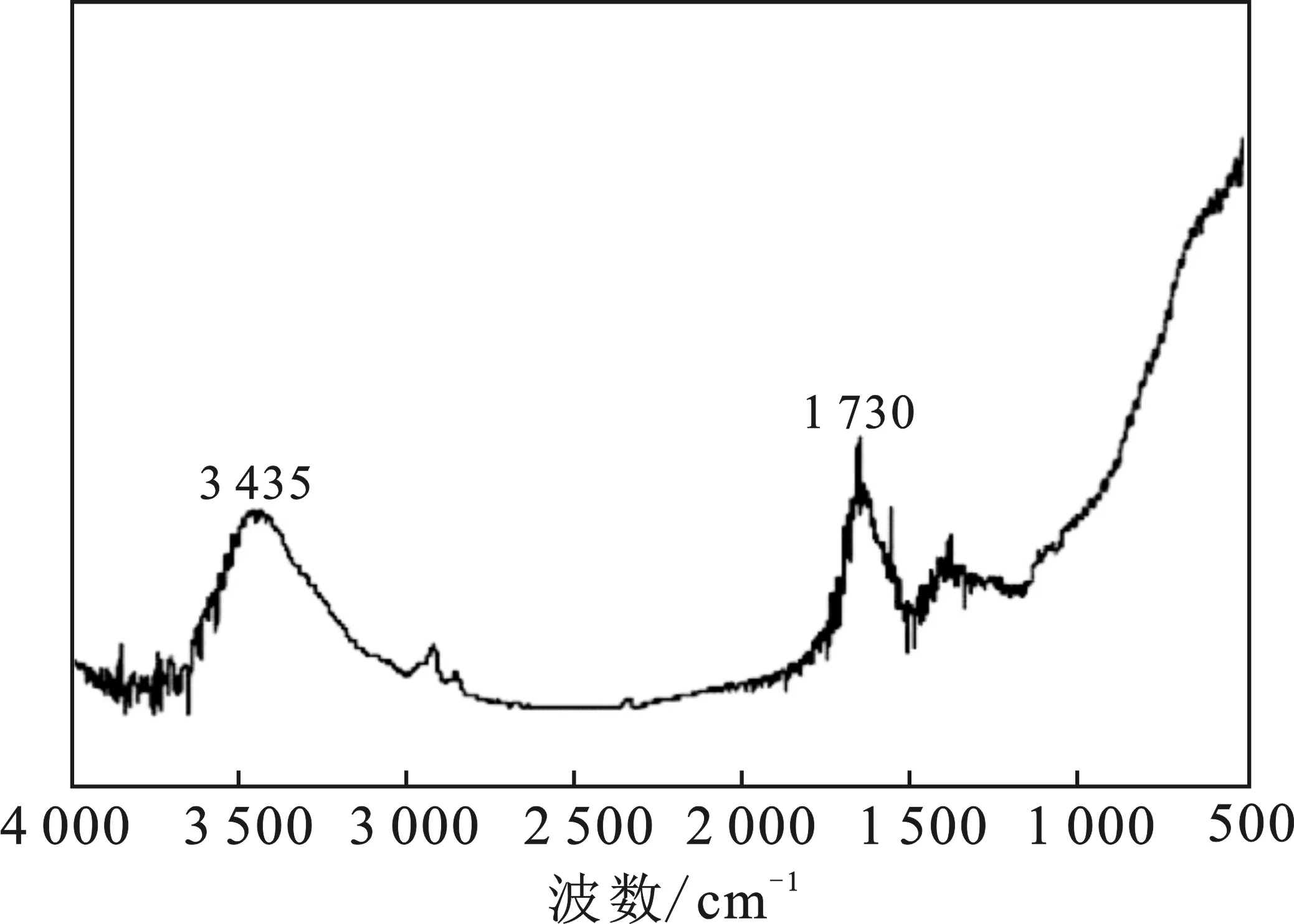
图3 聚氨酯基活性炭的红外光谱Fig.3 The FTIR spectra of polyurethane-basedactivated carbon

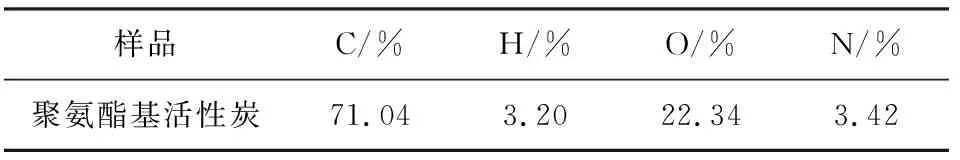
表2 聚氨酯基活性炭的元素组成Table 2 The elements analysis of polyurethane-basedactivated carbon
2.2 吸附时间对Zn2+吸附性能的影响
由图4可知,聚氨酯活性炭吸附Zn(Ⅱ)的量随着吸附时间的增加而增加,而增加幅度则随之趋于平稳。
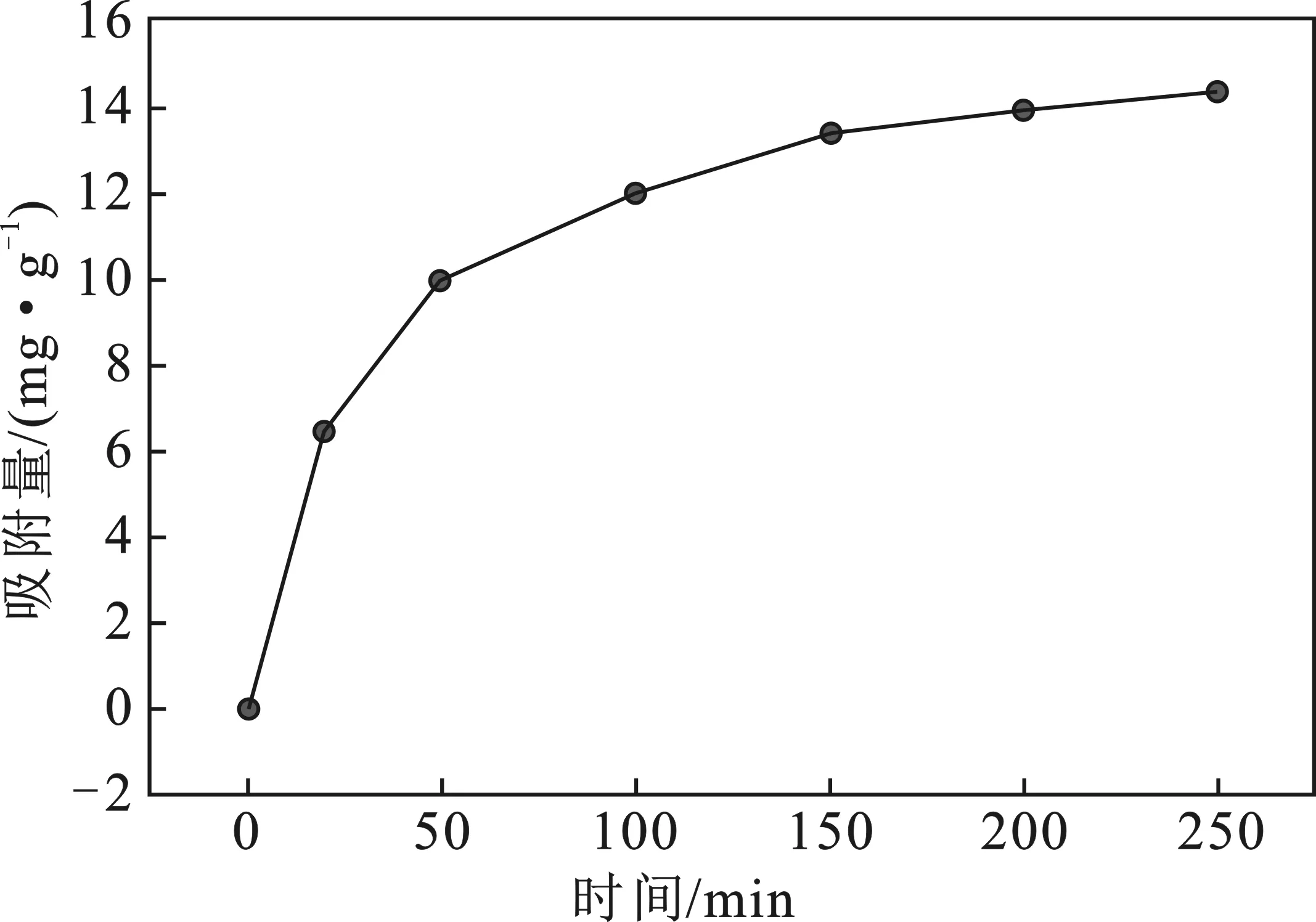
图4 不同吸附时间对吸附性能的影响(T=25 ℃,pH=6)Fig.4 The effect of different adsorption time onadsorption performance
在0~50 min的区间内,由于聚氨酯活性炭与溶液接触时间较短,聚氨酯活性炭孔道中剩余活性位点较多,同时活性炭形状不规则,表面自由能较高,同时还存在微孔填充的现象,导致在短时间内吸附Zn(Ⅱ)的含量极速上升,表现为曲线的斜率较大;当活性炭的吸附时间超过 50 min 时,聚氨酯基活性炭活性位点逐渐被 Zn(Ⅱ)占据,同时聚氨酯基活性炭与Zn(Ⅱ)之间的吸附作用逐渐降低,使得活性炭孔道外部溶液中的Zn(Ⅱ)难以进入,活性炭表面自由能也逐渐降低,因此曲线的斜率表现为逐渐降低;当吸附时间超过150 min时,活性炭对 Zn(Ⅱ)的吸附量缓慢增长,并在175 min左右聚氨酯基活性炭与溶液中Zn(Ⅱ)达到吸附平衡,平衡吸附量在14.00 mg/g上下基本处于平衡状态。
2.3 溶液pH值对Zn(Ⅱ)吸附性能的影响
由图5可知,聚氨酯基活性炭对溶液中的 Zn(Ⅱ)的吸附量随着pH的升高而逐渐增加。当溶液的pH为2时,聚氨酯基活性炭对Zn(Ⅱ)的吸附量最低,其吸附量为pH为3时吸附量的1/2。随着含Zn(Ⅱ)溶液pH的升高,聚氨酯基活性炭对 Zn(Ⅱ)的吸附量在pH为2~4之间的增加量较为明显,当pH变为4,5,6时,聚氨酯基活性炭对 Zn(Ⅱ)的吸附量逐渐增加,但增加量较为缓慢。推测在pH为2和3时,由于溶液中H+浓度较大,容易与聚氨酯基活性炭中的活性位点结合,与聚氨酯基活性炭吸附Zn(Ⅱ)形成竞争,因此吸附的含量较低。随着含 Zn(Ⅱ)溶液pH的升高,溶液中H+浓度大幅度降低,Zn(Ⅱ)在聚氨酯基活性炭的吸附中占据优势,使得溶液pH在4,5,6时,Zn(Ⅱ)占据聚氨酯基活性炭的大部分活性位,同时也使得聚氨酯基活性炭吸附Zn(Ⅱ)的增量较缓。

图5 不同pH对吸附性能的影响(T=25 ℃)Fig.5 The effect of different solution pH onadsorption performance
2.4 浓度对Zn(Ⅱ)吸附性能的影响
由图6可知,随着起始浓度的增加,聚氨酯基活性炭吸附量在最初阶段增加迅速,浓度增加到 100 mg/L 时,聚氨酯基活性炭的吸附量随着浓度的增加较为缓慢,在溶液浓度为200 mg/L时,聚氨酯基活性炭吸附量基本饱和,饱和吸附量在20 mg/g左右。推测在溶液浓度较低时,在吸附时间足够长的条件下,聚氨酯基活性炭达到平衡吸附,活性炭中还存在着大量未与Zn(Ⅱ) 结合的活性位点;随着溶液中Zn(Ⅱ)浓度的增加,Zn(Ⅱ)与聚氨酯基活性炭中多余的活性位点结合,最终在200 mg/L的溶液中,聚氨酯基活性炭的吸附量基本饱和。
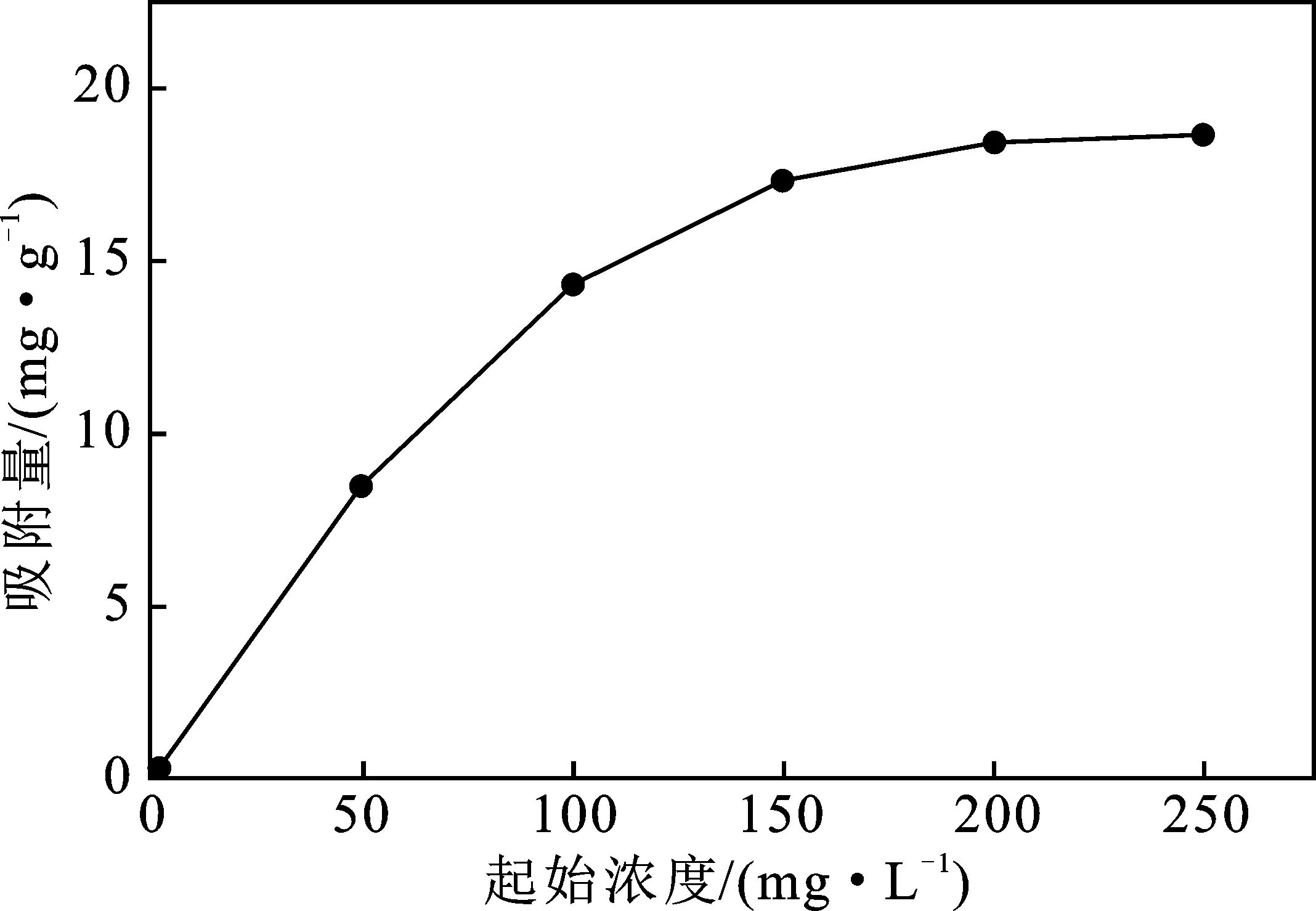
图6 不同浓度下对吸附性能的影响(T=25 ℃,pH=6)Fig.6 The effect of different solution concentrationson adsorption performance
2.5 吸附动力学研究
图7为依据准一级动力学(式2)与准二级动力学方程(式3)进行拟合得到的动力学曲线,具体拟合参数见表3。
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中qe——达到吸附平衡时吸附容量,mg/g;
k1——拟一阶速率常数,min-1;
qt——任意时刻的吸附容量,mg/g;
k2——拟二阶速率常数,g/(mg·min)。

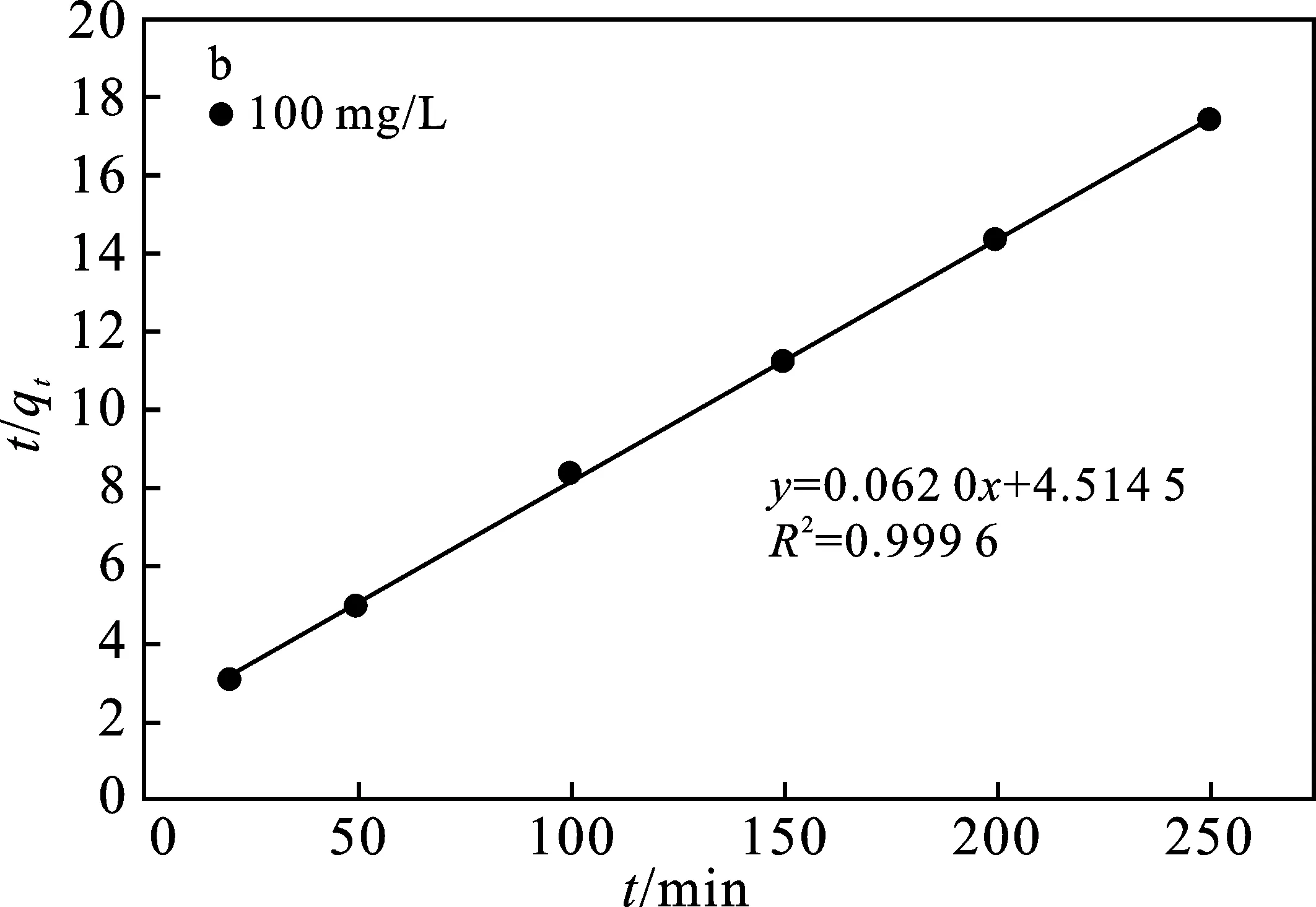
图7 准一级动力学模拟(a)和准二级动力学模拟(b)曲线Fig.7 Pseudo-first-order kinetics model(a) andpseudo-second-order kinetics model(b) curve

表3 动力学拟合参数Table 3 Kinetic parameters of kinetic fitting
由图7和表3可知,准二级动力学方程的R2大于准一级动力学方程R2,且准二级动力学模拟的平衡吸附量更接近实验中平衡吸附量,因此,聚氨酯基活性炭吸附Zn(Ⅱ)的动力学更倾向于准二级动力学方程。
2.6 吸附等温线
用吸附等温线研究了聚氨酯基活性炭对 Zn(Ⅱ)的吸附能力。对其进行Langmuir等温吸附(式4)和Freundlich等温吸附(式5)方程拟合,拟合结果见图8,具体拟合参数见表4。
(4)
(5)
式中qe——达到吸附平衡时吸附容量,mg/g;
ka——Langmuir常数;
qm——吸附剂的最大单层吸附能力,mg/g;
ce——达到吸附平衡时溶液的浓度,mg/L。
kf——表征吸附容量的等温线常数,L/mg;n——表征强度的等温线常数。
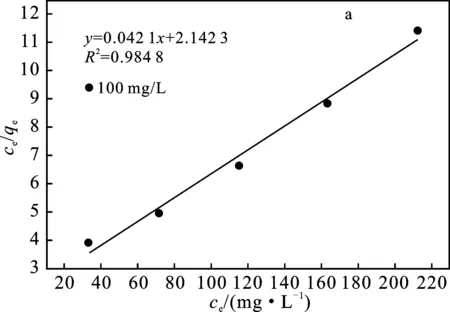
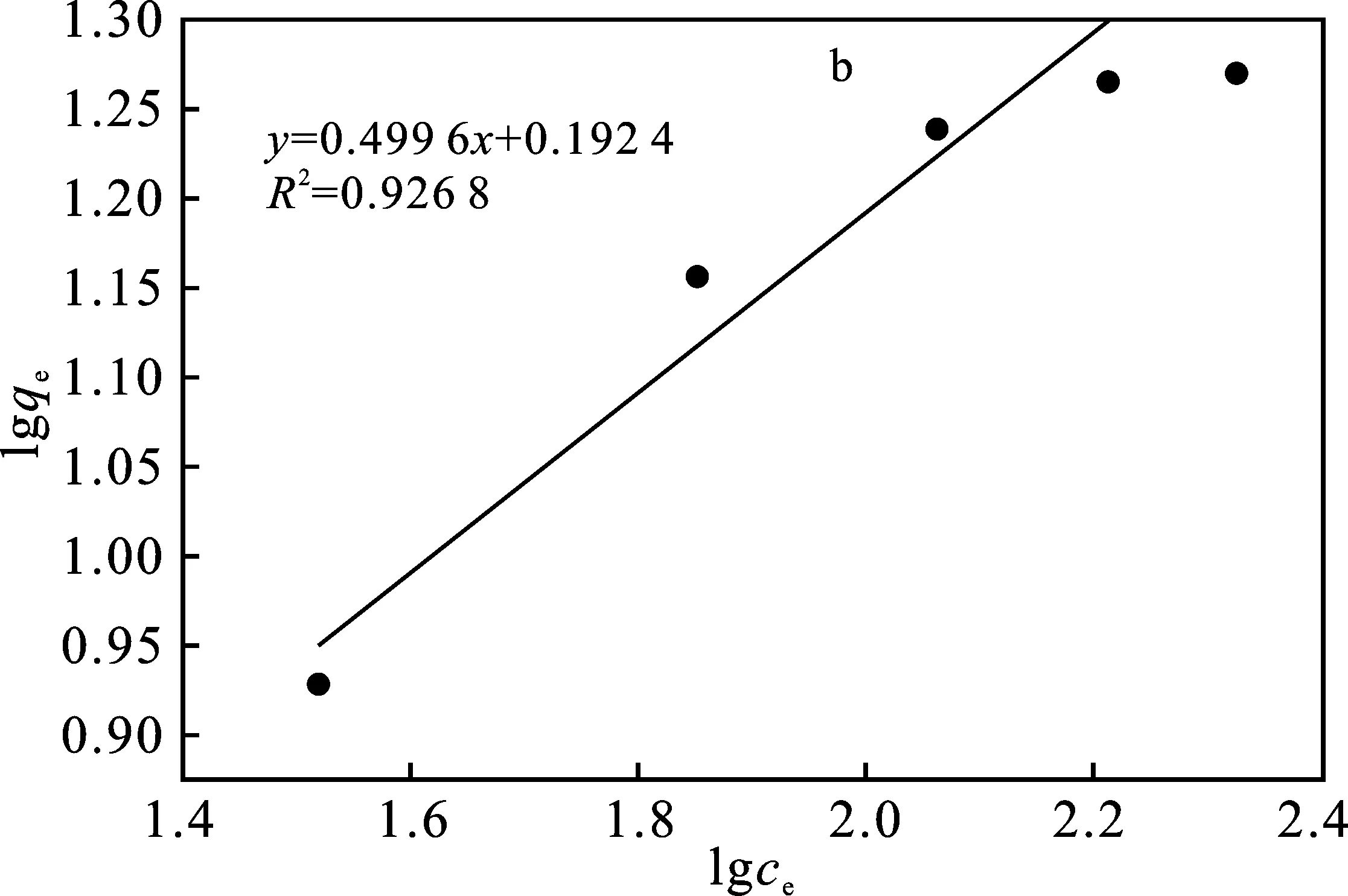
图8 Langmuir等温吸附方程拟合(a)和Freundlich等温吸附方程拟合(b)曲线Fig.8 Langmuir isotherm (a) and Freundlichisotherm(b) curve

表4 等温吸附拟合参数Table 4 Langmuir and Freundlich adsorption isotherm model parameters
由图8与表4可知,Langmuir方程对聚氨酯基活性炭的吸附过程模拟中,曲线拟合程度较好,其拟合所得R2为0.984 8,大于Freundlich方程拟合所得R2。符合Langmuir方程中的条件之一为单分子层吸附,而Freundlich方程为多分子层吸附,因此聚氨酯基活性炭吸附溶液中Zn(Ⅱ)的过程趋向于 Zn(Ⅱ)单分子层吸附,通过Langmuir方程得到的Zn(Ⅱ)最大吸附量为23.7 mg/g。
3 结论
本文采用废弃聚氨酯为碳源,经过炭化和二氧化碳活化,制备得废塑料基活性炭材料。其比表面积达到836.42 m2/g,且微观结构主要为微孔。聚氨酯基活性炭对Zn(II) 具有良好的吸附性能,最高吸附容量达到23.7 mg/g,其对Zn2+的吸附符合Langmuir等温吸附和准二级动力学方程。聚氨酯基活性炭材料可用于去除电镀废水中重金属离子的吸附剂。以期塑料废弃物为碳源,制备高附加值活性炭,达到废弃物减量资源化目的,同时用以解决电镀废水中重金属离子污染问题。

