微纳米气泡耦合Fe3O4催化氧化吸收烟气中的NO
卢洁,张荣梁,李登新,许士洪,林政友
(1.东华大学 环境科学与工程学院,上海 201620;2.东华大学 国家环境保护纺织污染防治工程技术中心,上海 201620;3.同济大学 环境科学与工程学院 污染控制与资源化研究国家重点实验室,上海 200082;4.上海污染控制与生态安全研究院,上海 200082;5.上海环安环境管理有限公司,上海 200333)
微纳米气泡因具有水中停留时间长、传质效率高以及能产生羟基自由基从而具有强氧化性等优点被广泛应用于各领域的研究[1]。Fe3O4是一种典型的过渡金属氧化物,在催化吸附、光催化降解等领域都有广泛的应用[2-5]。Fe3O4作为高效催化剂同时具有Fe2+和Fe3+两种价态,而Fe2+和Fe3+是常用的高效离子形态催化剂,因此以Fe3O4为催化剂的研究逐渐变多[6]。本文选用Fe3O4作为催化剂,研究其耦合微纳米气液体系在各种变化条件下催化氧化吸收烟气中的NO。并采用XRD、SEM、EDS和XPS手段对反应前后的Fe3O4进行了表征,研究得出Fe3O4最优使用条件并探究其反应机理。
1 实验部分
1.1 材料与仪器
四氧化三铁、浓硫酸、亚硝酸钠、硝酸钠、硫酸钠均为分析纯;空气、NO、SO2均购于南京特种气体有限公司。
XZCP-K-0.75型超微气泡发生器;ICS-1100型离子色谱仪;MODEL 6010便携式pH计;Seitron C600型烟气分析仪。
1.2 实验方法
微纳米气液体系发生及NO氧化与吸收装置图见图1。

图1 微纳米气泡耦合Fe3O4催化氧化吸收NO实验装置图Fig.1 Experimental device for NO absorption by catalyticoxidation of Fe3O4 coupled with micro-nano bubbles1.SO2钢瓶;2.NO钢瓶;3.空气钢瓶;4.气体流量计;5.气体缓冲瓶;6.微纳米气泡发生器;7.水箱;8.烟气分析仪;9.搅拌机;10.反应吸收塔;11.尾气吸收塔;12.离子色谱仪
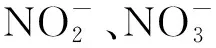
NO吸收效率计算公式(式1和式2):
(1)
(2)

q1——进水流量,L/min;
t——系统运行时间,min;
m1——进气NO的质量(以N计),mg;
cn——NO的质量浓度,mg/L;
P1——气体减压后的压力,Pa;
P0——大气压,Pa;
q2——气体流量,mL/min;
t——系统运行时间,min。

2 结果与讨论
2.1 pH对NO吸收效率的影响
图2是在吸收塔中加入5 g Fe3O4,设置一组不添加Fe3O4作为空白对照,其他几组在不同pH条件下NO的脱除情况。
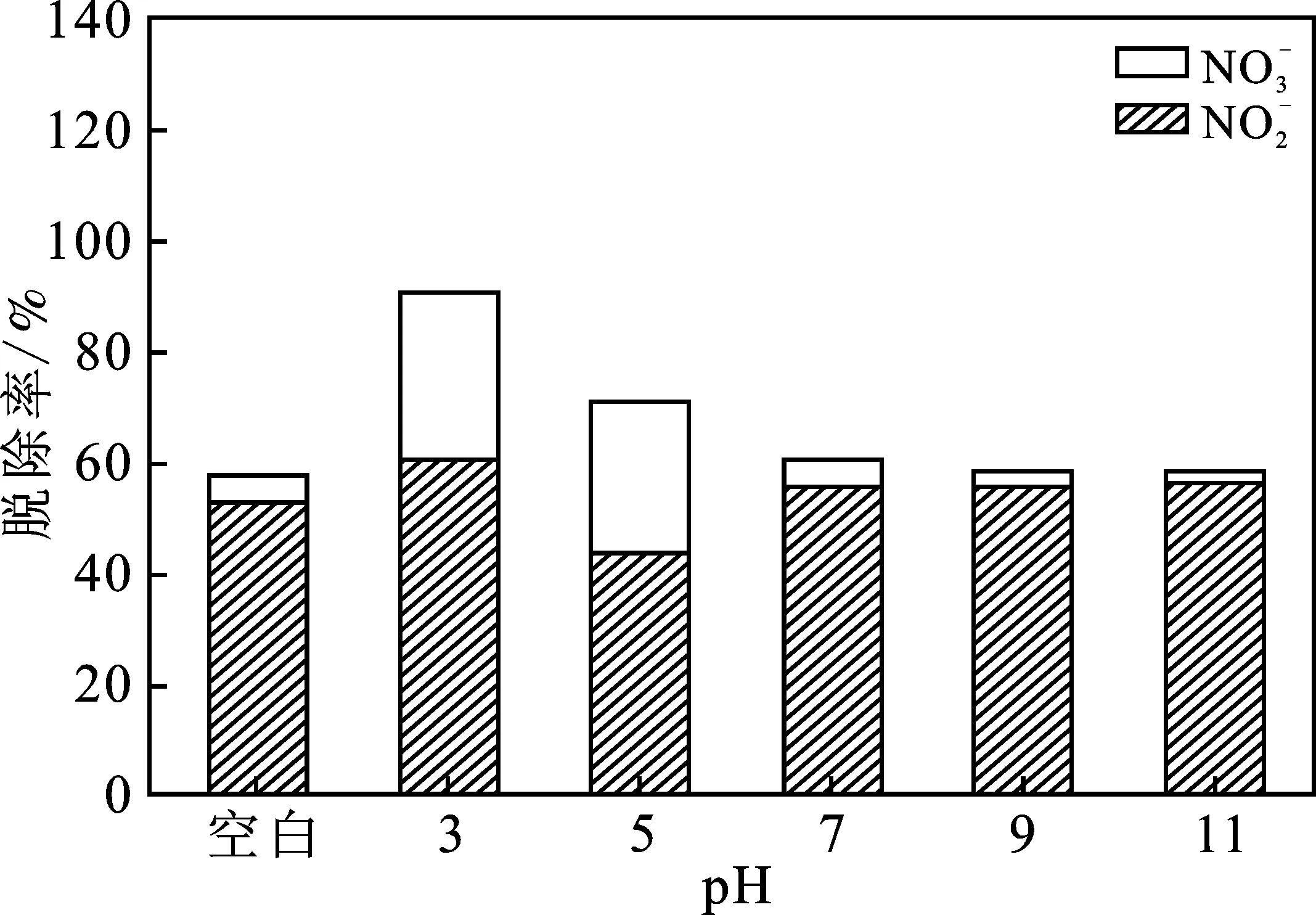
图2 pH对NO脱除率的影响Fig.2 Effect of pH on NO removal rate
由图2可知,随着pH的增加,NO的脱除率逐渐降低。表1是在不同pH条件下,吸收液中Fe元素的含量。
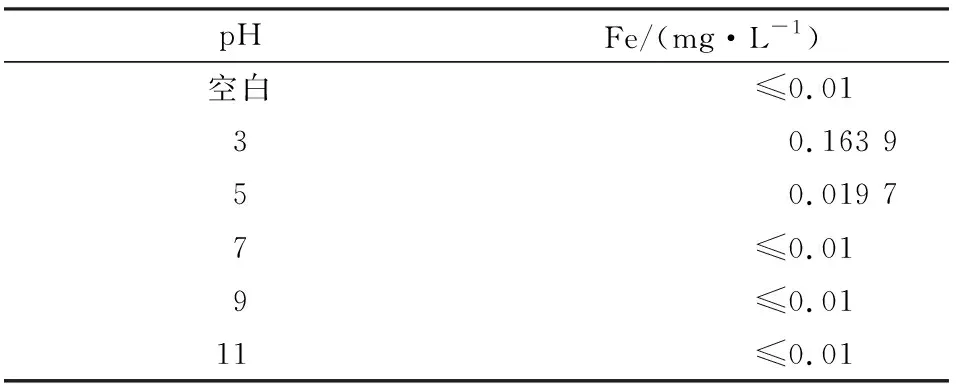
表1 不同pH条件下吸收液中Fe的含量Table 1 Fe content in absorbing solution underdifferent pH conditions
由表1可知,随着pH的逐渐增加,吸收液中的Fe含量逐渐降低。结合图2及表1可知,在酸性条件下,Fe3O4在吸收液中的溶解度大,吸收液中的Fe2+和Fe3+多;由于Fe2+和Fe3+可以促进微纳米气液体系氧化吸收NO,因此吸收液酸性越强,NO的脱除率越高。
2.2 Fe3O4投加量对NO吸收效率的影响
图3是在吸收液pH为3时,设置一组不添加Fe3O4作为空白对照,其它实验中改变Fe3O4投加量条件下NO的脱除情况。
由图3可知,随着Fe3O4投加量增加,NO脱除率呈现先增加后降低的趋势,当Fe3O4投加量为5 g时,NO脱除率最高,达到了81.1%。造成此现象是由于初期随着Fe3O4投加量的逐渐增加,Fe3O4能提供的活性反应位点数量逐渐增加,提高了催化微纳米气泡产生·OH的反应速率[8]。而Fe3O4投加量过多时,吸收液中固体颗粒物过多而影响了水质,使得微纳米气泡在水中的传质效率受到了影响,NO的吸收率降低。

图3 Fe3O4投加量对脱硝的影响Fig.3 Effect of Fe3O4 on denitrification
2.3 NO进气量对NO吸收效率的影响
图4是在吸收塔中加入5 g Fe3O4,吸收液pH为3,在不同的NO的进气量条件下NO的脱除情况。

图4 进气量对脱硝的影响Fig.4 Effect of flow rate on denitrification
由图4可知,随着NO气体进气量的增加,NO的脱除率逐渐降低。原因可能是随着进气量的逐渐增加,更多微纳米气泡中的NO没有被氧化就破裂释放,使得NO的吸收效率受到了影响。
2.4 Fe3O4的催化机理研究
图5是Fe3O4反应前后的XRD图谱。

图5 反应前后Fe3O4的XRD图谱Fig.5 XRD patterns of Fe3O4 before and after reaction
由图5可知,反应前后Fe3O4的特征峰没有发生明显变化,说明样品反应前后物相没有发生变化。
图6是反应前后的Fe3O4的Fe 2p XPS扫描图。


图6 反应前后的Fe3O4的Fe 2p XPS扫描图Fig.6 XPS scanning chart of Fe 2p before andafter Fe3O4 reaction
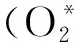
(3)
(4)
Fe2++·OH→Fe3++OH-
(5)
Fe3++HO2·→Fe2++O2+H+
(6)
·OH+NO→HONO
(7)
·OH+HONO→NO2+H2O
(8)
2HO2·+2NO→2HNO2+O2
(9)
(10)
(11)
(12)
图7是Fe3O4反应前后的SEM照片。
由图7可知,反应前后的表面形貌没有太大差异,样品晶型也没有变化。反应后样品表面略微粗糙,可能的原因是:①在NO的脱除过程中微量的Fe3O4溶于吸收液中;②由于微纳米气液体系的强氧化能力,表面微量的Fe3O4被氧化。


图7 反应前后Fe3O4的SEM图Fig.7 SEM images of Fe3O4 before and after reactiona.反应前;b.反应后
图8是反应前后Fe3O4的SEM-EDS图,表2是反应前后Fe3O4的元素含量表。
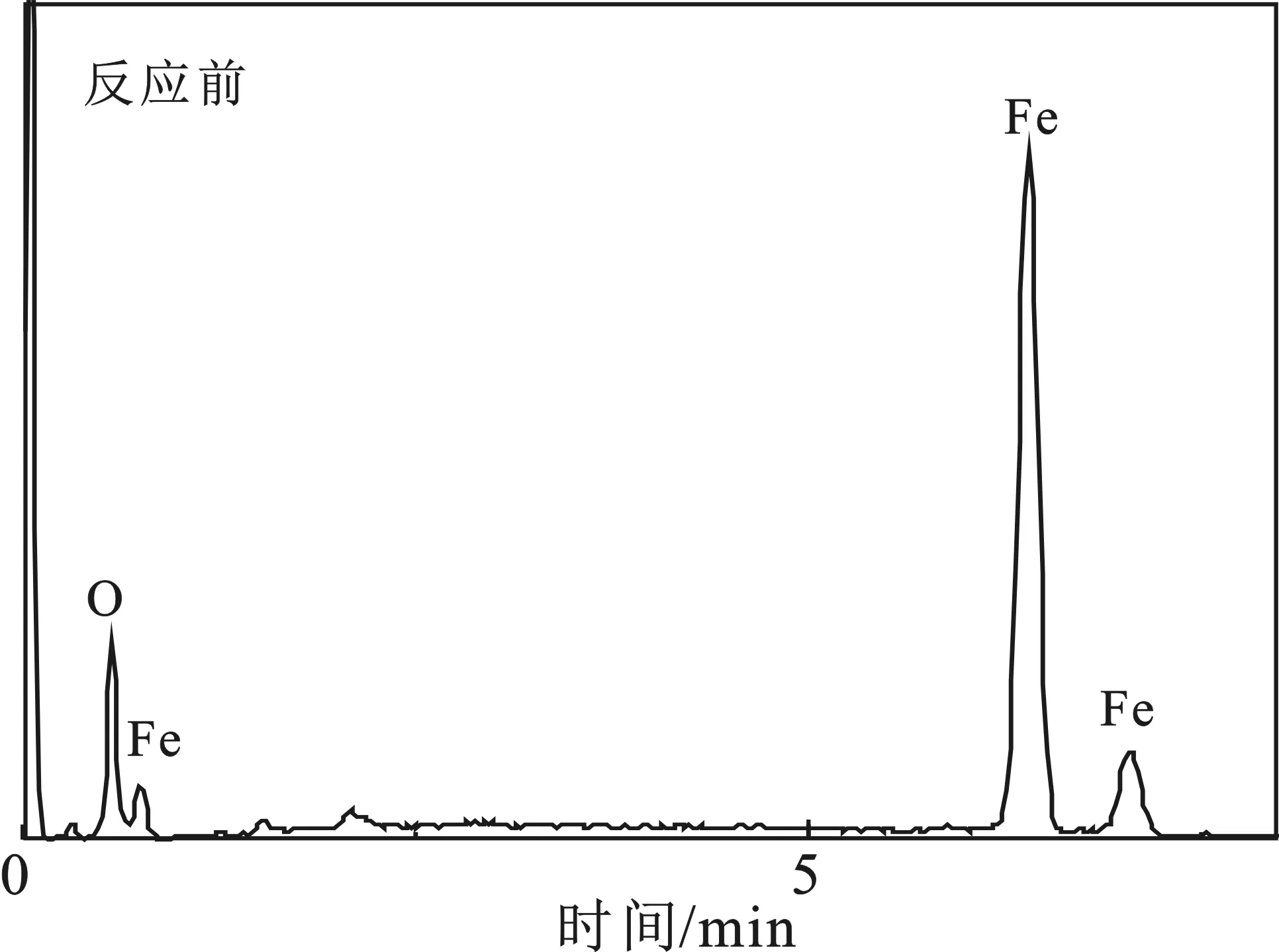

图8 反应前后Fe3O4的SEM-EDS图Fig.8 SEM-EDS pictures of Fe3O4 before andafter reaction
由图8和表2可知,反应后样品表面的铁元素含量降低,氧元素含量增多。此现象是在催化氧化去除NO的过程中,由于溶液中的强氧化环境,使得Fe3O4表面的一些Fe2+发生了氧化反应,提高了氧元素的含量,并导致铁元素含量的降低。
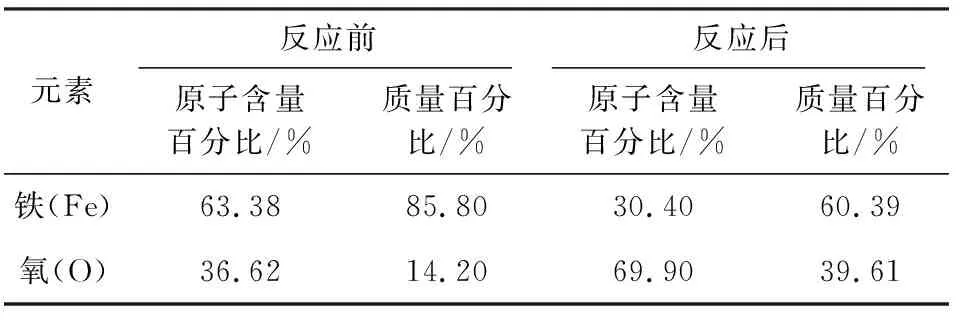
表2 反应前后Fe3O4的元素含量Table 2 Element content table of Fe3O4before and after reaction
3 结论
以Fe3O4作为催化剂,耦合微纳米气泡催化氧化吸收NO,考察最佳脱硝效率条件。并采用XRD、SEM、EDS和XPS手段对使用前后的Fe3O4进行了表征分析,得到的结论如下:
(1)Fe3O4具有很好的催化效果,虽然相对离子形态的Fe2+和Fe3+,固体形态的Fe3O4催化效果有所不如,但Fe3O4具有磁性,可回收,且无二次污染的特点,比离子形态的Fe2+和Fe3+催化剂更具有工业可行性。
(2)Fe3O4投加量为5 g、pH为3,进气量为 50 mL/min 时,NO的吸收效果最好,达到了93.8%。
(3)Fe3O4反应前后物相和表面形貌没有太大差异,但是使用后Fe3O4表面的Fe元素含量有所降低,O元素含量增高。Fe3O4本身同时具备Fe2+和Fe3+,可以促进催化氧化NO的吸收。

