肌少症对老年骨质疏松性胸腰段脊柱压缩性骨折术后病死率的影响
王华 王超 殷建
南京医科大学附属江宁医院骨科(南京211100)
社会人口老龄化逐渐加重,肌少症和骨质疏松症所带来的问题逐渐凸显。骨骼和肌肉是相邻的组织,二者具有多种共同的调节因素和信号通路,因此一些学者提出了“肌少症-骨质疏松症”的概念,将二者称为“活动障碍综合征”[1]。骨质疏松性胸腰段脊柱压缩性骨折(osteoporotic thoracolumbar compression fracture,OTLCF)常见于老年骨质疏松症患者,伤后可能引起长期腰背部疼痛、脊柱畸形、活动障碍甚至死亡等,严重影响老年人的生活质量及寿命。目前临床上治疗OTLCF 的主要术式之一是经皮椎体后凸成形术(percutaneous kyphoplasty,PKP),具有创伤小、快速缓解疼痛和减少卧床时间等特点,提高了老年患者的生活质量[2]。然而OTLCF 患者接受PKP 术后生存时间及其影响因素研究尚少,其中患者的身体机能及营养状况是重要因素之一。
肌少症(sarcopenia)是与自然增龄相关的骨骼肌功能和质量的丢失,其与跌倒、骨折、功能丧失和病死率增加相关。MAURO 等[3]研究发现在肝衰竭等待肝移植的患者中,肌少症和病死率密切相关。RICHARDS 等[4]发现结合并有肌少症的直肠癌患者住院时间及1 年病死率增加。ZHANG 等[5]发现肌少症是早期乳腺癌患者死亡的危险因素。SALMAN 等[6]发现肌少症是干细胞癌切除术后1 年病死率的独立危险因素。已有研究发现,OTLCF合并肌少症患者病死率明显增加[7],然而肌少症对OTLCF 老年患者病死率的影响研究尚少。本研究通过分析肌少症和老年OTLCF 术后生存曲线之间的关系,首次提出并探讨肌少症对OTLCF 老年患者病死率的影响,为临床上治疗老年OTLCF 合并肌少症患者提供新思路及方法,从而提高老年患者的生存质量,延长生存时间。
1 对象与方法
1.1 研究对象回顾分析南京医科大学附属江宁医院骨科自2014 年2 月至2017 年2 月收治的65 岁以上OTLCF 患者。本研究通过南京医科大学附属江宁医院伦理委员会批准(伦审批第201401015)。纳入标准:(1)年龄≥65 岁;(2)致伤原因:自行摔伤;(3)胸腰段脊柱压缩性骨折(T10-L2);(4)首次脊柱骨折且为单个椎体压缩性骨折;(5)骨密度T值<-2.5 SD;(6)接受PKP 手术;(7)既往无脊柱或四肢骨折史;(8)无先天性下肢畸形或功能障碍;(9)术前行胸部CT 扫描。排除标准:(1)年龄<65岁;(2)多发性(脊柱)骨折(包括陈旧性脊柱骨折);(3)接受非PKP 手术;(4)合并脊髓神经损伤、疾病;(5)严重的基础疾病;(6)脊柱(脊髓)原发性或转移性肿瘤。
1.2 方法本研究基于胸部CT 计算出的SMI 来诊断肌少症。SMI 值:以肌肉面积所测量的总和除以患者身高的平方(cm2/m2)。肌肉面积计算方法为:在胸12 椎体椎弓根水平层面CT 图像上,测量包括竖脊肌、背阔肌、内斜肌、外斜肌、腹直肌、肋间外肌和肋间肌在内的肌肉面积。使用PACS 3.6 软件对图像进行分析。采用NEMEC等[8]提出的胸12 水平SMI 诊断界值:低于42.6 cm2/m2(男)和30.6 cm2/m2(女)诊断为肌少症。
PKP 手术方式:患者行基础麻醉,俯卧位。采取双侧椎弓根入路,在G 臂机透视下穿刺,经双侧球囊扩张,椎体高度复位满意后,注入适量骨水泥,拔出导管,缝合包扎伤口。术后联合康复科医师对患者进行肌肉舒缩功能练习,指导患者每日定时进行肢体功能锻炼,重点对患者进行健康宣教,注意避免扭伤及摔跌倒,每日补充适量蛋白质,尤其是必需氨基酸的摄入。术后使用维生素D 及钙片常规进行抗骨质疏松治疗。
1.3 统计学方法应用SPSS 22.0 软件进行统计分析。根据患者生存时间绘制生存曲线。采用Kaplan Meier 分析生存曲线,使用χ2检验分析生存率差异。采用Cox 单因素及多因素回归分析肌少症、骨折部位、年龄、性别及美国麻醉师协会(American Society of Anesthetists,ASA)等级等因素对术后病死率的影响。连续变量以平均数±标准差表示,P<0.05 表示差异具有统计学意义。
2 结果
2.1 患者一般情况共有114 例患者纳入本研究,其中肌少症组49 例,非肌少症组65 例,患者一般情况见表1。
2.2 老年OTLCF 患者术后病死率
2.2.1 总体病死率1 例患者在术后12 个月内死亡,12 个月病死率为0.88%。3 例患者在术后24 个月内死亡,24个月病死率为2.63%。11例患者在术后36 个月内死亡,24 个月病死率为9.65%。
2.2.2 肌少症组和非肌少症组患者的病死率肌少症组术后12、24 和36 个月病死率分别为0、4.08%和18.40%,非肌少症组分别为:1.54%、1.54%和3.08%。两组术后12个月及24个月病死率差异无统计学意义(P= 0.385、0.803)。术后36 个月病死率差异有统计学意义(P= 0.016),见图1、表2。
2.2.3 影响OTLCF 患者术后36 个月病死率的因素分析采用Cox回归分析年龄(<80岁=1,≥80 岁=2)、性别(男=1,女=2)、肌少症(肌少症=1,非肌少症=2)、ASA 等级(1、2、3)及骨折部位(胸椎骨折=1,腰椎骨折=2)变量对术后36 个月病死率的影响。结果显示性别、肌少症、ASA等级是影响OTLCF患者术后36 个月病死率的因素(表3)。
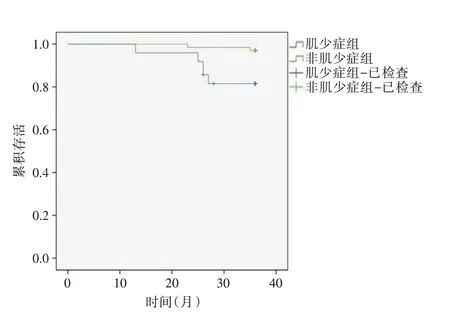
图1 肌少症组和非肌少症组OTLCF 患者术后36 个月生存曲线Fig.1 Survival curve of OTLCF patients at 36 months after operation in sarcopenia group and non-sarcopenia group
3 讨论
随着年龄不断增长,肌肉的力量和质量的峰值通常在成年后达到峰值(和骨密度的变化相一致),逐渐平稳后便加速下降[9-10]。欧洲老年人肌少症工作组(EWGSOP)将肌少症定义为渐进的和普遍的骨骼肌质量(纤维体积和数量)和强度下降,可能导致身体残疾,生存质量下降甚至死亡[11]。随着近年来对肌少症的研究不断加深,EWGSOP在2018 年表达了新的肌少症共识,并提出了新的诊断标准及治疗方法。肌少症的诊断方法较多,其中CT 和MRI 可以准确地区分肌肉、脂肪及骨骼组织,是肌少症诊断的金标准[12],基于胸部或腹部CT 计算SMI 值常被用于临床诊断肌少症。
肌少症作为预测患者病死率的独立影响因素,逐渐被临床医生重视。对肿瘤患者的研究发现,通过评估步态、握力和骨骼肌质量可以有效预测术后并发症和生存周期[13-14]。在创伤骨科中,肌少症和脆性骨折的发生密切相关[15-16]。HIDA等[17]研究发现肌少症是OTLCF 发生的独立危险因素。研究发现,脊柱压缩性骨折一年病死率为2%~42%[18],其中术前健康状态、肿瘤、是否使用激素和ASA 等级是影响患者生存的独立危险因素[19-20]。BOKSHAN 等[15]发现肌少症患者具有更长的住院时间、更高的并发症发生率及病死率,因此肌少症在一定程度上可以预测脊柱骨折患者术后病死率。
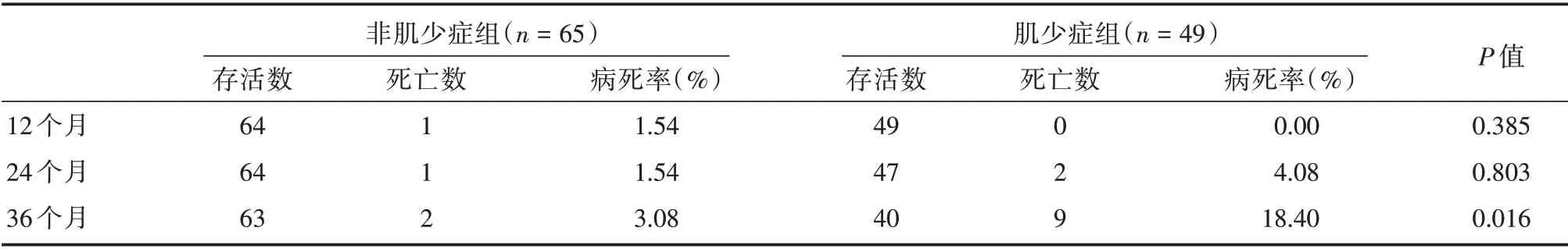
表2 肌少症组和非肌少症组患者术后12、24、36 个月病死率对比Tab.2 Comparison of mortality rates of 12 months,24 months and 36 months after operation in sarcopenia group and non-sarcopenia group
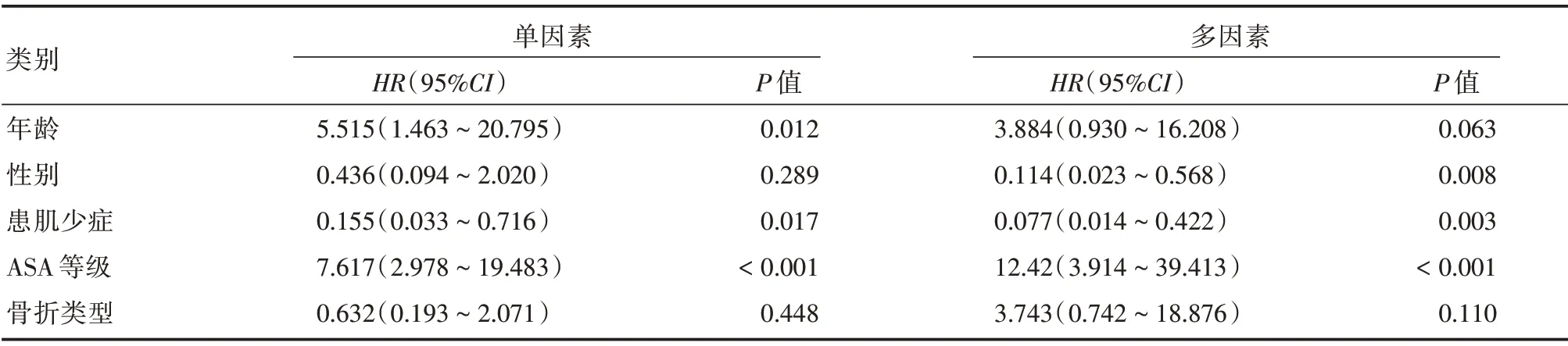
表3 术后36 个月病死率多变量Cox 回归分析Tab.3 A multivariate cox regression analysis of 36 months postoperative mortality
OTLCF常发生于老年患者,极大降低了老年人的生存质量[21]。PKP 微创手术能够快速缓解疼痛,部分增加椎体高度,减少了患者的卧床时间,但是不同OTLCF 患者接受PKP 术后的生存时间不尽相同。本研究根据肌少症组和非肌少症组术后病死率绘制生存曲线,结果显示,肌少症组和非肌少症组术后12 个月和24 个月(近期)病死率差异无统计学意义,而术后36 个月(远期)病死率差异具有统计学意义。单因素分析显示患有肌少症和ASA 等级间差异具有统计学意义,而患者的年龄、性别和骨折部位间差异无统计学意义。结果发现,肌少症对OTLCF 患者术后短期病死率无明显影响,但影响患者长期存活率,所以在对OTLCF 治疗过程中,对合并有肌少症的患者在围手术期需加强管理和健康教育,应进行长期饮食和运动干预,补充适量的优质蛋白和亮氨酸等,联合康复医学科对患者进行定期随访并指导患者肢体功能锻炼。另外,ASA 等级也是影响OTLCF 患者术后远期率的重要危险因素,对于ASA 等级较高的患者需加强术中生命体征监测和术后管理,重视基础疾病和合并症的处理。
本研究选择胸腰段脊柱骨折患者作为研究对象是因为该部位是老年人摔倒的常见骨折部位,高位胸椎或低位腰椎因部位特殊,多由高能量的暴力所致,常伴有较严重的脊髓损伤及其余脏器合并症,故未纳入分析。本研究具有一定的局限性。肌少症的诊断目前还缺乏统一的标准,目前国内尚缺乏肌少症大样本数据,尚未提出符合我国特点的诊断标准。根据欧洲肌少症工作组提出的肌少症最新的诊断标准[22],握力是诊断肌少症的条件之一,由于本研究开始时间较早,未采取握力值对肌少症进行筛选。另外,脊柱骨折对患者的身高可能产生一定的影响,从而影响SMI 值,可能使结果产生偏倚。随访时间及纳入样本数量有待进一步增加。

