嵌合抗原受体T细胞治疗致细胞因子释放综合征与神经毒性的现状及展望
石亚群 俞妍慧
1长治医学院研究生院(山西长治046000);2长治医学院附属和平医院血液科(山西长治046000)
嵌合抗原受体T 细胞(chimeric antigen receptor engineered T cell,CAR-T)结合了肿瘤特异性识别区域的高亲和力和T 细胞的细胞溶解特性,其将抗原识别特异性转导成信号级联反应,从而激发T细胞效应器功能杀死肿瘤细胞,属于过继免疫治疗的一种。目前CAR-T细胞已发展至第四代,其在临床试验中已显示良好的抗血液恶性肿瘤的能力。随着CAR-T 细胞疗法的迅速兴起,其潜在的致命性不良反应逐渐被发现,因此及早发现这些不良反应并进行干预对患者的预后是至关重要的。
1 CAR-T 的临床应用
CAR-T 细胞疗法是一项突破性技术,靶向CD19 的CAR-T 细胞疗法在较短的时间内彻底改变了复发/难治性急性淋巴细胞白血病治疗方式,多项试验显示患者的缓解率高达70%~90%[1],因此CD19 成为CAR-T 治疗B 细胞淋巴瘤的理想靶点,除CD19外,CD20、CD22、κ轻链、ROR1蛋白对于B 细胞淋巴瘤治疗也是具有一定潜力的靶点[2]。多发性骨髓瘤抗原包括B 细胞成熟抗原(BCMA)、CD138、CD38、CD56、CD44、信号淋巴细胞激活分子家族成员7(SLAMF7)和κ轻链作为CAR 靶点正在研究中[3-4],其中BCMA 在大多数多发性骨髓瘤恶性细胞中都有表达,靶向BCMA 的CAR-T 细胞具有很强的抗骨髓瘤活性[5]。相比于血液系统肿瘤,实体瘤中CAR-T 的应用受到很多因素的限制,其中主要因素包括:肿瘤异质性、T 细胞耗竭、肿瘤微环境抑制和T 细胞运输障碍[6],因此CAR-T细胞疗法在实体瘤试验中基本停留在检测安全性的阶段[7]。
2 细胞因子释放综合征和免疫效应细胞相关神经毒性综合征的病理生理学机制
2.1 细胞因子释放综合征的病理生理学机制CAR-T 细胞疗法中常见的毒性反应之一是细胞因子释放综合征(cytokine release syndrome,CRS),其起因是CAR-T 细胞在识别体内肿瘤细胞后被激活,继而促进大量细胞因子释放,触发一系列全身炎症反应的发生[8],所释放的细胞因子进一步激活免疫细胞(巨噬细胞、单核细胞、T 细胞、B 细胞等)释放大量炎性细胞因子进而促使CRS 的发生[9-10]。这些炎症介质和细胞因子可促进内皮细胞活化,导致血液动力学不稳定、毛细血管渗漏和消耗性凝血病。此外,小鼠研究模型表明儿茶酚胺也可通过激活免疫细胞中肾上腺素的自扩增前馈回路和细胞因子的产生而促进CRS 的发展[11]。CRS 通常表现为高热、寒战、肌肉痛、全身乏力、食欲不振,严重时可发生全身器官功能衰竭[12]。研究显示血清中细胞因子IL-6 水平与CRS 严重程度密切相关,IL-6 通过信号转导会导致严重的CRS症状,如血管渗漏、补体和凝血级联反应的激活导致弥散性血管内凝血[13-14]及心肌病。由于IL-6受体抗体(tocilizumab)与IL-6 受体结合阻断T 细胞活化下游单核细胞和巨噬细胞产生的IL-6,因此用IL-6 受体抗体早期干预可以减轻CRS 的严重程度,并且至今仍没有发现其对CAR-T 细胞抗肿瘤作用的不良影响[15]。
2.2 免疫效应细胞相关神经毒性综合征的病理生理学机制免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome,ICANS)也是CAR-T 细胞疗法中常见的严重不良反应之一,通常表现为神经毒性,其症状包括识字困难、失语和混乱,严重时进展为意识模糊、昏迷、癫痫、运动障碍和脑水肿[16-17]。神经毒性的严重程度与CRS 的严重程度相关,这表明与CRS 相关的全身炎症反应会促使神经毒性的发生[17]。对患有严重CRS 和神经毒性的成年患者的研究表明,内皮细胞活化明显,内皮细胞的活化可能导致血脑屏障的破坏,使免疫效应细胞和炎性介质渗入中枢神经系统[18-20]。一些研究机构对具有致命神经毒性成年人的大脑进行尸检,发现其大脑存在内皮功能障碍和血脑屏障破坏的证据[21-22]。与成人研究相反,用靶向CD19 的CAR-T细胞治疗的儿童急性淋巴细胞白血病的患者中,没有内皮细胞激活的报道[20]。对急性神经毒性患者脑脊液的研究显示部分细胞因子在血清中的浓度通常高于脑脊液,这表明可渗透性的血脑屏障导致了脑脊液中的高细胞因子水平。然而,与血清相比,脑脊液中IL-8、IP10 和MCP-1 的浓度更高,这表明中枢神经系统内的局部产生也可能有贡献[19]。
宿主和肿瘤因素也可能与CRS 和ICANS 的严重性相关[23-24],如高肿瘤负荷和高基线炎症状态会导致严重的CRS 和ICANS。此外,治疗的相关因素也会影响不良反应的等级,如高剂量CAR-T细胞输注和不同CAR 结构设计可能会导致体内CAR-T 细胞的扩增及毒性的增加。
3 CRS 和IVANS 的分级及管理
3.1 CRS和ICANS 的分级不同研究机构间CRS和ICANS 的分级存在着差异,这导致临床试验中报告的不良反应的发生率和严重程度存在着偏差,因此迫切需要为CAR-T 细胞相关不良反应建立共识分级系统。最近,美国移植和细胞治疗学会(American Society for Transplantation and Cellular Therapy,ASTCT)于2018 年6 月在华盛顿特区举办了一个研讨会,该研讨会发布了针对CRS 和ICANS 的ASTCT 共识评分系统,目的是在CRS 和ICANS 分级上达成共识,更好地指导CRS 和ICANS的预防和治疗[16]。CRS 的ASTCT 共识评分系统是基于三个生命体征(体温、血压和血氧饱和度)来分级的(表1)[16]。ASTCT 共识评分系统通过进一步完善CARTOX 小组提出的神经毒性分级系统[21]形成了目前的ICANS 的评分系统(表2)。
3.2 CRS 和ICANS 的管理对CRS 和ICANS 的早期诊断及干预对于预防CAR-T 细胞治疗后的严重不良后果是至关重要的[12]。CRS管理的关键方面包括支持护理和干预措施,以消除潜在有害的CAR-T 细胞效应子功能或下游免疫效应[25]。神经毒性通常出现在CRS 后,根据ASTCT 共识标准,神经毒性的治疗包括支持疗法、抗癫痫治疗和/或联合皮质类固醇,如果存在并发的CRS,可以给予IL-6 受体抗体;但是,在没有发生CRS 时不建议使用IL-6 受体抗体,因为在这种情况下使用无效。
4 CRS 和ICANS 的应对策略
修改CAR-T 细胞结构设计以改善细胞因子相关毒性是目前研究热点。目前控制CAR-T 细胞的方法可归纳为三类:被动控制、诱导控制、自主CAR-T 细胞。(1)被动控制方法包括亲和力调节CARs[26]和瞬时转染T 细胞[27],这些方法可直接限制CAR-T 细胞介导的细胞毒性。(2)诱导控制的原理是使用抗体或诱导自杀系统来消除CAR-T 细胞,如将携带有“自杀”基因的病毒载体编码到CAR 构建体中[28]、酪氨酸激酶抑制剂达沙替尼抑制CAR 信号[29]、将适配器(CAR 识别分子)连接到肿瘤抗原的抗体或配体上以控制CAR-T 细胞对抗原的活性[30]。这些方法依赖于联合用药,从而使CAR-T 细胞的使用依赖于所选药物的药代动力学、组织可用性和潜在不良反应,当发生严重不良反应时,诱导CAR-T 细胞凋亡,终止治疗。(3)自主CAR-T 细胞具有自我调节性,可以根据正常和癌细胞表面表达的蛋白决定是否发起或阻止对目标细胞的杀伤作用,如构建双特异性CAR-T[31]、在CAR 结构[32]中加入缺氧诱导因子来控制CAR 的表达,自主CAR-T 细胞使用所谓的布尔逻辑门和肿瘤选择机制来产生特异性自主CARs,以便更好地区分肿瘤细胞和正常细胞。
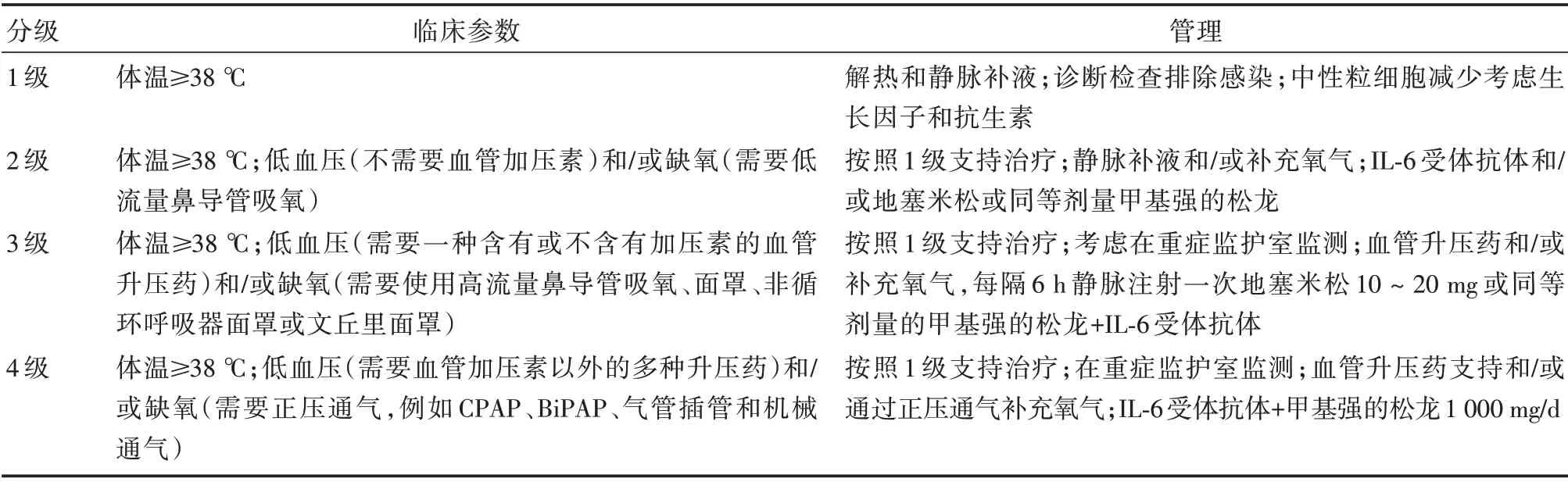
表1 ASTCT CRS 分级及管理Tab.1 Classification and management of ASTCT CRS

表2 ASTCT ICANS 分级及管理Tab.2 Classification and management of ASTCT ICANS
5 小结
正如本综述所强调的,用CAR-T 细胞治疗表达CD19 的复发或难治性B 细胞恶性肿瘤已经非常成功,然而在治疗过程中可能发生显著的毒性反应。因此,对于这种疗法,挑战和机遇仍是并存的。当前对不良反应的管理重点在于严格监控、及时发现,对于级别较低的不良反应给予对症支持治疗,而严重不良反应则应给予tocilizumab 和/或皮质类固醇。目前,CAR-T 不良反应的预防策略及CAR-T 细胞产品创新的重点是在不影响细胞免疫疗法疗效的同时进一步提高这些治疗手段的安全性。

