低甲氧基果胶应用于重型颅脑损伤患者的临床观察
臧守华 张玉坤 陈军
苏州大学附属第一医院麻醉科重症监护病房(江苏苏州215000)
重型颅脑损伤(sTBI)是因暴力直接或间接作用于头部引起颅脑组织的损伤,是重症监护病房常见的严重急性创伤[1]。患者易合并中枢性高热、癫痫发作、因意识障碍导致的频繁躁动以及创伤造成的交感神经异常兴奋,从而使此阶段基础代谢率明显升高、能量消耗增加、血糖波动较大及蛋白质分解大于合成而处于负氮平衡状态。因此早期合理的肠内营养支持,对于纠正sTBI 患者的代谢紊乱、增强机体免疫力、改善整体预后尤为重要[2-3]。但是在临床约有50% ~80%的sTBI 患者,在颅脑损伤2 周内存在腹胀、腹泻、胃潴留等胃肠不耐受症状,严重影响患者的营养状况及预后[4]。目前通用的肠内营养均为液体配方,而胃食管返流引起的吸入性肺炎和腹泻是液体配方肠内营养的主要并发症[5],因此肠内营养添加低甲氧基果胶,利用其在胃酸中发生胶凝作用将肠内营养半固化,是否有利于减少返流误吸的发生率,另因其作为可溶性的膳食纤维及肠道益生元,是否可改善肠道菌群内环境,减轻sTBI 患者的胃肠不耐受,这些均值得去探索。本研究通过肠内营养添加低甲氧基果胶,观察sTBI 患者的血糖平均值、血糖变异系数、干预治疗期间胰岛素使用情况、胃肠道耐受情况、机械通气(MV)时间、呼吸机相关性肺炎(VAP)发生率以及7 d 后前白蛋白(PA)等指标,分析其对血糖水平、胃肠功能、营养指标及预后的调控作用。
1 资料与方法
1.1 病例纳入与排除标准(1)纳入标准:伤后24 h 内收住入院并在入院后48 h 内开始经鼻胃管进行肠内营养的闭合性重型颅脑损伤患者;年龄18~60 岁;格拉斯哥昏迷评分(GCS)为5~8 分。(2)排除标准:入院时即存在肺炎或其他感染性疾病的患者;伴发胸腹部外伤者;既往有血液病、消化道疾病或糖尿病、甲状腺功能亢进等内分泌系统疾病者;免疫抑制患者;人类免疫缺陷病毒(HIV)阳性者;妊娠或哺乳期妇女;癌症患者;体质量指数(BMI)>30 kg/m2或者BMI <18.5 kg/m2的患者[5]。
1.2 临床资料本研究经医院伦理委员会批准进行,并由患者或其授权家属签署知情同意书,选取2017 年1 月至2019 年12 月入住苏州大学附属第一医院外科重症监护病房(SICU)及神经外科重症监护病房(NSICU)的患者80 例。通过SPSS 25.0软件提取随机数字表,将患者平均分为两组,每组40 例。两组患者性别,年龄,入院时格拉斯各昏迷(GCS)评分、急性生理与慢性健康状况评分Ⅱ(APACHEⅡ)、进行手术例数等一般资料比较差异均无统计学意义(均P>0.05),具有可比性,见表1。
1.3 方法两组患者入院后均依据《颅脑创伤临床救治指南》[2]采用手术、渗透性治疗降颅压、预防性抗感染、抗癫痫、保护胃肠黏膜等常规治疗措施,并于入院后24~48 h 内开始行肠内营养(EN)。EN 治疗第1 天从25 mL/h 起持续泵入肠内营养制剂,鼻饲总量为500 mL;从第2 天起根据患者胃肠耐受情况逐渐增加肠内营养泵入速度及鼻饲总量,营养支持期间以“允许性低热量”[83.68~104.60 kJ/(kg·d)]为目标,EN 能量不足部分可以静脉营养作为补充。治疗过程中血糖的控制目标为随机血糖<10 mmol/L,若血糖控制不佳时可用胰岛素持续静脉泵入控制血糖。鼻饲期间床头需抬高30°~45°,以避免发生反流误吸。所有患者均采用瑞能(华瑞制药有限公司,批准文号:国药准字H20040722,规格500 mL/袋)为EN 制剂,能量密度5 440 kJ/L。果胶组每日预先鼻胃管内挤入蕊福平(日本丘比株式会社,规格90 mL/袋)半袋,30 ℃温水冲管接肠内营养鼻饲250 mL 后,再30 ℃温水冲管,挤入蕊福平半袋,再次冲管后接肠内营养,按每500 mL 肠内营养配比一袋蕊福平,连续使用7 d 以上。
表1 两组sTBI 患者一般资料比较Tab.1 Comparison of baseline data between two groups of patients±s

表1 两组sTBI 患者一般资料比较Tab.1 Comparison of baseline data between two groups of patients±s
注:sTBI,为重型颅脑损伤;APACHEⅡ,为急性生理与慢性健康状况评分Ⅱ;GCS,为格拉斯哥昏迷评分
组别对照组果胶组检验值P 值性别男24 19 χ2=1.26 0.26女16 21年龄(岁)40.3±11.5 42.2±10.9 t=0.76 0.45 GCS(分)6.1±1.2 6.3±1.0 t=0.81 0.42 APACHEⅡ(分)15.3±4.1 16.0±3.4 t=0.83 0.41手术(例)29 25 χ2=0.91 0.34
1.4 观察指标
1.4.1 血糖及胰岛素使用情况记录干预前的随机血糖水平,并在干预后连续7 d 每6 h 检测1 次末梢血糖值,并计算血糖平均值(GLUave)、血糖变异系数(GLUcv);若有需要可中间加测直至血糖稳定,如连续2 次监测血糖超过10 mmol/L 即给予胰岛素干预治疗(普通胰岛素40 U 加入0.9%氯化钠注射液40 mL 静脉缓慢泵入),并记录7 d 内患者胰岛素使用情况,包括胰岛素使用率和胰岛素累计使用时间平均值。
1.4.2 胃肠道耐受情况记录干预治疗7 d 内发生的胃肠道不耐受情况,包括胃潴留、呕吐、腹胀、腹泻等症状。
1.4.3 营养及预后指标记录干预治疗前及治疗7 d 后血浆前白蛋白(PA)水平;记录机械通气(MV)时间及VAP 发生率,VAP 诊断参照中华医学会诊断标准[6]。
1.5 统计学方法应用SPSS 25.0 软件进行统计分析。符合正态分布的连续计量资料以均数±标准差表示,采用t检验;不符合正态分布的连续计量资料以M(P25,P75)表示,采用Mann-WhitneyU非参检验;分类计数资料采用χ2检验或Fisher 精确检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者血糖情况比较两组患者干预前血糖比较差异无统计学意义(P>0.05),具有可比性。经干预治疗后果胶组7 d 的GLUave、GLUcv 及胰岛素使用时间明显低于对照组(均P<0.05),胰岛素使用率虽然也低于对照组,但差异无统计学意义(P=0.16,表2)。
表2 两组sTBI 患者的血糖情况比较Tab.2 Comparison of blood glucose and amount of insulin used between two groups of patients±s
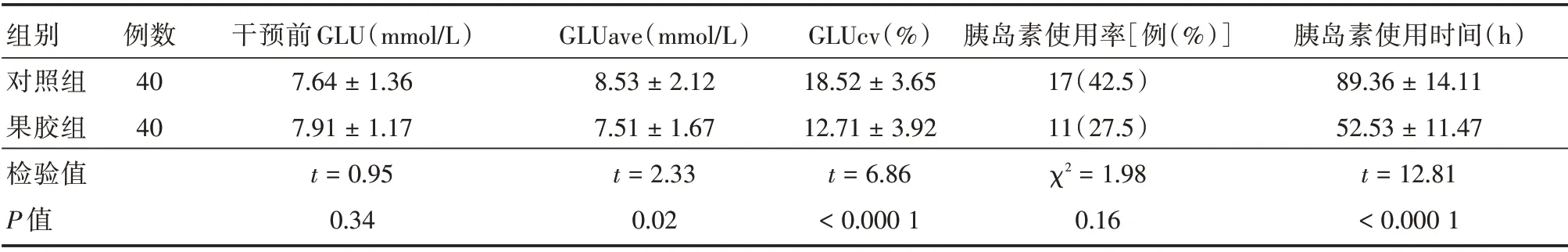
表2 两组sTBI 患者的血糖情况比较Tab.2 Comparison of blood glucose and amount of insulin used between two groups of patients±s
注:sTBI,为重型颅脑损伤;GLUcv,为血糖变异系数;GLUave,为血糖平均值
组别对照组果胶组检验值P 值例数40 40干预前GLU(mmol/L)7.64±1.36 7.91±1.17 t=0.95 0.34 GLUave(mmol/L)8.53±2.12 7.51±1.67 t=2.33 0.02 GLUcv(%)18.52±3.65 12.71±3.92 t=6.86<0.000 1胰岛素使用率[例(%)]17(42.5)11(27.5)χ2=1.98 0.16胰岛素使用时间(h)89.36±14.11 52.53±11.47 t=12.81<0.000 1
2.2 两组患者营养指标、胃肠道耐受情况及预后情况比较两组患者干预前的PA 比较差异无统计学意义(P>0.05),具有可比性,经干预治疗后,两组患者的PA 较前均有所上升,且果胶组明显高于对照组(均P<0.05)。此外,果胶组的胃肠不耐受发生率及MV 时间也均明显低于对照组(均P<0.05),但VAP 发生率两组间对比差异无统计学意义(P>0.05),见表3。
表3 两组sTBI 患者的营养指标、胃肠道耐受情况及预后情况比较Tab.3 Comparison of nutritional index,gastrointestinal tolerance and prognosis between two groups of patients±s
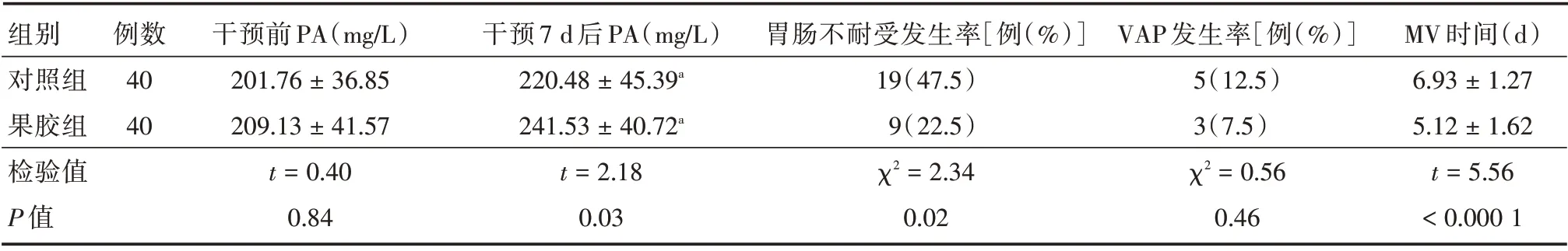
表3 两组sTBI 患者的营养指标、胃肠道耐受情况及预后情况比较Tab.3 Comparison of nutritional index,gastrointestinal tolerance and prognosis between two groups of patients±s
注:sTBI,为重型颅脑损伤;PA,为前白蛋白;VAP,为呼吸机相关性肺炎;MV,为机械通气;与干预前PA 相比,aP <0.05
组别对照组果胶组检验值P 值例数40 40干预前PA(mg/L)201.76±36.85 209.13±41.57 t=0.40 0.84干预7 d 后PA(mg/L)220.48±45.39a 241.53±40.72a t=2.18 0.03胃肠不耐受发生率[例(%)]19(47.5)9(22.5)χ2=2.34 0.02 VAP 发生率[例(%)]5(12.5)3(7.5)χ2=0.56 0.46 MV 时间(d)6.93±1.27 5.12±1.62 t=5.56<0.000 1
3 讨论
sTBI 后肠道菌群处于严重失衡状态[7],且有研究证实脑损伤的严重程度与小肠的收缩活动性呈负相关[8],从而引起sTBI 后腹泻、腹胀、胃潴留等胃肠功能障碍[9]。低甲氧基果胶为水溶性膳食纤维,可以促进双歧杆菌和乳酸杆菌等内源性益生菌的生长,进而抑制病原菌的生长,通过调节肠道菌群结构维护肠道微生态[10-12],而且双歧杆菌、乳酸杆菌等益生菌可以刺激回肠段的收缩并诱导近端结肠松弛反应进而调节肠道的运动[13]。本研究果胶组呕吐、胃潴留、腹胀、腹泻等胃肠不耐受发生率降低可能部分与此相关。另外因低甲氧基果胶可引起食糜的半固化,使胃壁伸展的适应性松弛,减缓了胃肠道对营养液的排空,也有利于降低呕吐、腹泻的发生率[14],并使营养液的吸收更为彻底。由于降低了胃肠不耐受的发生率,使肠内营养支持可以顺利的进行下去,并且缓慢而持久的营养物质吸收,这些均有利于营养指标的改善,果胶组干预7 d 后的PA 水平明显高于对照组。
sTBI 可导致全身性代谢紊乱,机体在创伤急性期通常处于高代谢以及负氮平衡状态,表现为血糖升高、水电解质平衡紊乱和营养不良,其中血糖升高是导致继发性脑损伤加重及死残率升高的重要因素之一,损伤机制可能与高渗透压,乳酸的产生,神经元pH 值的改变,以及兴奋性氨基酸的增加等有关[15-17]。无论是低血糖或是严重高血糖,都会增加患者的病死率,其中危重患者早期的血糖波动是28 d 内死亡的独立危险因素,GLUave 及GLUcv 也是患者死亡的独立危险因素[18-19]。本研究中,果胶组7 d 的GLUave、GLUcv 均明显低于对照组,虽然胰岛素的使用率两组间比较差异无统计学意义,但果胶组的胰岛素使用持续时间明显低于对照组。这可能因肠内营养添加了以蕊福平为代表的低甲氧基果胶,使胃、空肠内的肠内营养剂半固化为正常食糜状,故减缓肠内营养剂从胃内进入小肠的速度,小肠对其吸收速度相对平缓,避免了血糖的剧烈波动及高血糖的发生。低甲基果胶可以促进益生菌的生长,益生菌可有效促进天然免疫,减轻炎症反应[20],天然免疫系统在血糖代谢及胰岛素耐受性调节中具有重要作用[21-22],因此果胶可能通过促进益生菌的生长,调节固有免疫功能减轻胰岛素抵抗、提高胰岛素敏感性[23],从而发挥降血糖作用。
果胶组与对照组VAP 发生率的比较差异无统计学意义,果胶组机械通气时间明显低于对照组,可能因果胶组呕吐、腹胀、胃潴留等胃肠功能障碍发生率降低,故而减少了反流与微误吸的发生,另因肠内营养时添加低甲氧基果胶治疗后营养指标的明显提升,也有利于呼吸肌力的改善,从而缩短了机械通气时间。严重创伤及未加控制的高血糖会加速蛋白质的分解,并导致肌肉的消耗[24],因此推测果胶组由于血糖较对照组明显降低,蛋白质及肌肉的分解消耗也低于对照组,这更有利于脱机的成功实现。
以蕊福平为代表的低甲氧基果胶,在国内应用及报道较少,近几年在日本开始作为肠内营养液的粘度调节剂逐步推广使用,并已有研究表明在胃内液体饮食中添加果胶可以降低胃造瘘患者食管反流、术后肺部感染及腹泻的发生率[25-28]。但目前关于低甲氧基果胶在sTBI 患者中的应用鲜有报道,因此我们设计了此次临床研究,结果发现sTBI 患者在肠内营养时添加低甲氧基果胶有利于血糖的控制,可以降低胃肠不耐受的发生率,缩短机械通气的时间,并有助于营养状况的改善,这为探索sTBI 患者更为合适的肠内营养配方提供了一个新的方向。但是由于本实验的样本量偏小,且为单中心研究,仍需进一步研究方案加以验证,并探讨其内在机制以及对远期预后的影响。

