人工智能三维重建在肺小结节单孔胸腔镜肺段精准切除定位中的价值
徐涑珅
(佳木斯市结核<肿瘤>医院胸外科,黑龙江 佳木斯 154000)
肺癌(lung cancer)的发病率及死亡率在恶性肿瘤中一直高居首位,但晚期肺癌5 年生存率小于20%[1]。肺癌早期诊断、早期治疗成为降低肺癌死亡率的关键,早期肺癌手术后5 年生存率接近100%,通过低剂量CT 检查、肿瘤标记物检测,越来越多的肺小结节和微小结节被早期发现[2]。有研究表明[3],肺小结节恶性概率为20%~40%,且随年龄增长明显升高。针对早期肺癌,特别是肿瘤≤2 cm,手术方式逐渐由肺叶切除术向解剖性肺段切除术转变。解剖性肺段切除既能保证术后远期生存,同时能够最大程度地保留患者的肺功能,从而提高患者术后生存质量[4]。肺段切除的解剖结构复杂,肺的血管、支气管解剖变异较多,做到精准肺段切除,需要明确病变所在的肺段及该肺段的动静脉和支气管解剖情况。普通的薄层CT 呈现的是二维图像,往往难以确定靶段动静脉及支气管的走向及变异[5]。人工智能三维重建技术是利用3D 医学影像与计算机手术辅助系统,应用CT 检查数据对肺血管、支气管进行重建,可立体呈现肺部解剖结构,特别是各个肺段血管支气管三维结构及走向,为精准肺段切除手术提供了有力的技术支持。本研究选取2020 年1~6 月我院收治的50 例肺小结节患者的临床资料,旨在观察人工智能三维重建技术在肺小结节单孔胸腔镜肺段精准切除手术中定位的价值,现报道如下。
1 资料与方法
1.1 一般资料 选取2020 年1~6 月在佳木斯市结核<肿瘤>医院胸外科行单孔胸腔镜肺段精准切除手术治疗的50 例肺小结节患者的临床资料,纳入标准:①符合美国国立综合癌症网络(NCCN)指南建议的手术适应症,即肺结节≤2 cm,且位于外周;②患者资料齐全;③无其他并发症。排除标准:①合并心肝肾等重要脏器疾病者;②中途主动退出者。所有患者年龄29~76 岁,中位年龄57 岁。术前薄层CT显示18 个实性病灶、22 个部分实性磨玻璃样病变、10 个单纯磨玻璃样病变,共50 处肺内小结节,病灶大小8~30 mm,距离邻近脏层胸膜的深度10~45 mm,肺小结节的大小与分布情况见表1。
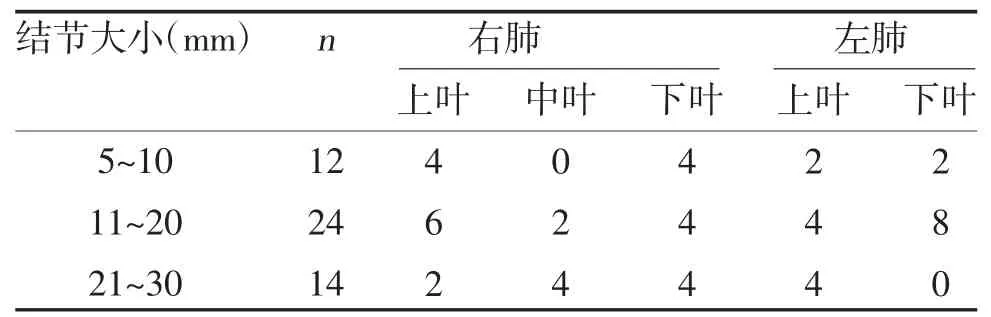
表1 肺小结节的大小与分布情况(n)
1.2 方法
1.2.1 采集方法 根据患者术前2 周内CT 检查所示病灶位置,嘱患者仰卧或俯卧于导管床上,双手抱头,并指导患者呼吸,去掉患者体表金属异物,在患者体表拟穿刺区域放置自制的金属网格状标识物,网格间距为10 mm×10 mm(图1A)。采用数字血管造影机(美国GE 公司生产,型号:Innova3100)透视下正侧位对位后,行旋转扫描。扫描参数:矩阵512×512,视野(FOV)30 cm,旋转速度40°/s,扫描时间5 s,共旋转200°,将采集的图像数据传送至工作站进行重建。重建层厚为2 mm,层距2 mm;重建方法有容积再现(VR)和多平面重建(MRP)。应用重建图像,并结合体表金属标识网格,确定体表进针点(图1B、1C)。常规消毒铺巾,2%利多卡因局麻穿刺点后,先将麻醉针头垂直刺入拟穿刺皮肤点,再次旋转扫描,以确定进针点是否合适。若进针点满意,则根据重建图像制订精确的穿刺方案。嘱患者屏住呼吸,将Hook-wire 套管针按计划迅速刺入病灶区,随后再次旋转扫描,根据重建图像所示针尖和病灶的关系,精确校正进针深度和角度。若套管针成功穿刺到病灶,推进金属钩丝,退出套管针。重复旋转扫描,三维重建图像显示倒钩位于病灶内或位于病灶邻近肺组织内(距离病灶<5 mm),提示定位成功(图1D~1F)。用无菌透明贴包扎钩丝体外部分,将患者送入手术室行单孔胸腔镜肺段精准切除收术。具体操作过程见图1。

图1 定位下操作过程
1.2.2 图像处理 扫描过程中系统生成0.625 mm 原始横断图像及5 mm 重建图像,图像自动传输至工作站后,CT 专业技师对薄层横断图像进行VR 三维重建。其中VR 三维重建视图,部分病例根据需要做不同位置的切视图。
1.2.3 手术方法 双腔气管插管全身麻醉,健侧卧位单肺通气,腋前线、腋中线第5 肋间做一约1 cm 的切口,作为操作孔,在腋中线第7 肋间做1 cm 的切口作为观察孔,腔镜探查,了解胸膜腔情况,探查肿块的位置。用卵圆钳触摸或用手指进行操作,卵圆钳协助触摸肺表面,定位结节情况。对于探查结节成功者应用腔内切割闭合器行肺楔形切除;对于探查结节失败者,根据术前人工智能三维重建技术确定病变位于肺段的位置,然后术中给予鼓肺,用电刀烧灼画出肺段位置,然后行肺段切除。术后寻找肺内结节,快速冰冻送病理检查,如为良性,结束手术,如为恶性行胸腔镜肺叶切除,纵隔淋巴结清扫。
2 结果
50 处肺小结节的术前定位中有48 例定位成功,成功率率为96.00%,术中有2 例定位失败,均在当天内接受单孔胸腔镜肺段精准切除手术,无中转开胸手术病例,所有术后均获得明确的病理诊断结果。定位操作时间16~27 min,平均定位操作时间18.23 min(计算从局麻后到钩丝定位成功的时间);术中出血量53~66 ml,平均出血量55.31 ml;住院时间为8~25 d,平均住院时间15.21 d。有4 例发生无症状气胸(同侧肺叶压缩面积<20%),发生率8.00%,未发生咯血、血胸等并发症。
3 讨论
随着低剂量CT 检查在临床的广泛应用,肺部小结节检出率为8%~51%,其中恶性占1.19%~12.00%,而纯磨玻璃样病变(r-GGO)有59%~73%为恶性[6]。对于有高度恶性概率(>60%)的肺部小结节,无手术禁忌证或者无法耐受手术,首选手术治疗[7]。胸腔镜手术中,对于一些直径较小、不在胸膜表面的结节及一些GGO 的定位,通常采用术中超声、核素示踪剂及Hook-wire 定位等方法[8]。处理肺部小结节,尤其是靠近肺门的深部结节,往往无法楔形切除,故需行肺段或肺叶切除,但肺叶切除会对肺功能形成较大的损害[9],术后证实是良性病变的患者非常难以接受。研究证明[10],胸腔镜肺段精准切除治疗肺部小结节,与肺叶切除相比,虽然复发率和5 年生存率无明显差异,但却更好地保护了术后肺功能,对于良性病变及肺部小结节具有更好的优势。
单孔胸腔镜肺段切除术为使用单孔切口,不撑开肋骨,在完全胸腔镜下实施的解剖性肺段切除术,必要时加行系统淋巴结清扫,主要适用于无法行肺楔形切除或不能耐受肺叶切除术的患者[11]。Innova CT 是数字平板探测器血管造影系统与改进的CT重建技术相结合的医用成像设备。Innova CT 的C臂系统围绕患者旋转扫描1 次,可以获得多达几百幅二维图像,将这些采集的信息传送到AW 工作站经校正后进行断层重建[12]。重建原理是使用线性轨迹追踪算法沿预定方向的最大信号强度作为成像像素,同时重建出横断面、矢状面、冠状面的断层图像,还可以根据需要获得任意角度的重建图像[13]。没有侵及脏层胸膜的肺内小结节在胸腔镜下难以识别,需术前标记或定位。应用微弹簧圈标记胸腔镜下无法应用手指触诊的肺内小结节,可显著增加病变的精准切除率,有效地避免过度切除正常肺组织。一项前瞻性研究分析了术前CT 引导下微弹簧圈定位肺内小结节的作用,结果提示与未进行术前定位的患者比较,术前定位可有效地提升病变切除精准度,减少开胸或肺叶切除率,缩短手术时间,同时减少切割闭合器的应用,术后无显著并发症[14]。另有研究显示[15],术前应用微弹簧圈精准定位可疑肺内小结节,病变切除成功率为100%,显著优于未进行术前定位的病例,因此CT 引导下微弹簧圈定位有助于快速、精确切除肺内小病灶,降低开胸率,并缩短手术时间,有助于术后康复。
本研究中50 例肺小结节的定位中直径≤10 mm的有12 例,位于双肺下叶的有22 例,穿刺定位较困难,但均定位成功,定位成功率达96.00%,定位操作时间16~27 min,平均定位操作时间18.23 min;仅有4 例(8.00%)发生无症状性气胸,并发症发生率低于CT 引导的钩丝定位。在4 例气胸患者中2 例因病灶位于右肺下叶背段,结节较硬,在穿刺过程中病灶被针尖推挤滑动,再加上患者不能配合呼吸,导致穿刺过程中产生气胸,定位失败;另2 例病灶位于右肺尖,Hook-wire 套管针仅能从锁骨下狭小的空间进针,在多次调整针尖方向的过程中产生气胸。在成功定位的肺小结节中,术中仅有2 例定位失败,但手术医师根据穿刺形成的局部胸膜下血肿找到病灶所在部位,顺利进行楔形切除。本例钩丝脱落的原因可能因病灶位置较浅,定位针倒钩不能充分打开所致。
综上所述,在单孔胸腔镜肺段精准切除术过程中,人工智能三维重建技术术前定位肺小结节,操作快捷、安全,定位准确,特别在直径≤10 mm 的肺微小结节的定位中具有一定的优势。

